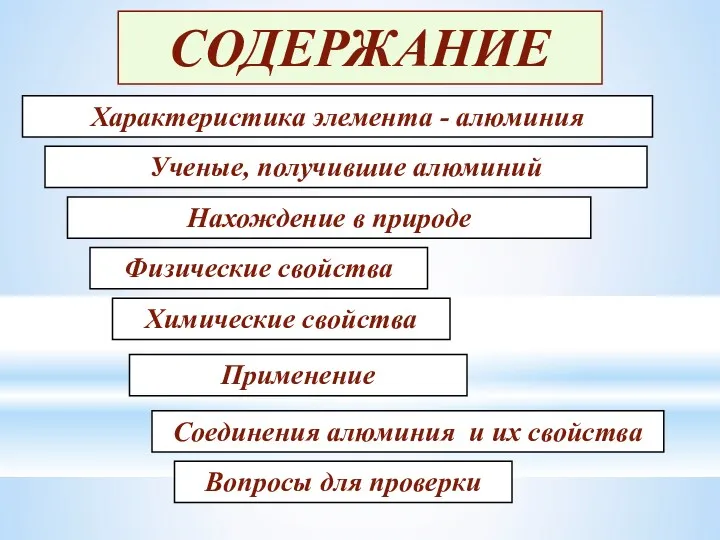
Содержание
- 2. СОДЕРЖАНИЕ Ученые, получившие алюминий Характеристика элемента - алюминия Нахождение в природе Физические свойства Химические свойства Применение
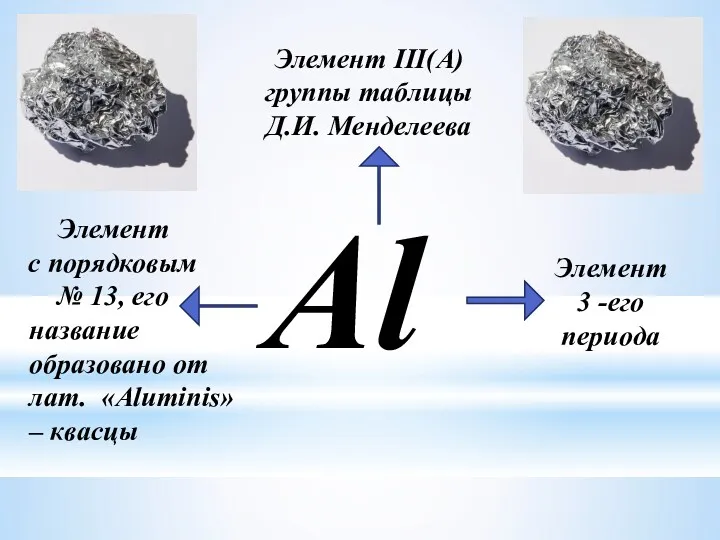
- 3. Al Элемент III(A) группы таблицы Д.И. Менделеева Элемент с порядковым № 13, его Элемент 3 -его
- 4. Строение атома алюминия Заряд ядра атома алюминия +13 В атоме 3 энергетических уровня Электронная оболочка атома
- 5. Датский физик Ганс Эрстед (1777-1851) Впервые алюминий был получен им в 1825 году действием амальгамы калия
- 6. Современное получение алюминия Современные метод получения был разработан независимо друг от друга: американцем Чарльзом Холлом и
- 7. Будучи студентом Оберлинского колледжа, он узнал, что можно разбогатеть и получить благодарность человечества, если изобрести способ
- 8. Поль Эру (1863-1914) – французский инженер - химик В 1889 году открыл алюминиевый завод во Фроне
- 9. Физические свойства мягкий легкий (с малой плотностью – 2,7 г/см3) с высокой тепло- и электропроводностью легкоплавкий
- 10. Нахождение в природе По распространенности в земной коре алюминий занимает 3-е место после кислорода и кремния
- 11. с серой, образуя сульфид алюминия: 2Al + 3S = Al2S3 с азотом, образуя нитрид алюминия: 2Al
- 12. Химические свойства 1. с водой (после удаления защитной оксидной пленки) 2Al + 6H2O = 2Al(OH)3 +
- 13. ПРИМЕНЕНИЕ АЛЮМИНИЯ Легкий сплав дюраль используется в различных областях В Авиации В Космической технике В Электротехнике
- 14. Соединения алюминия Оксид алюминия (Al2O3) Гидроксид алюминия Al(OH)3
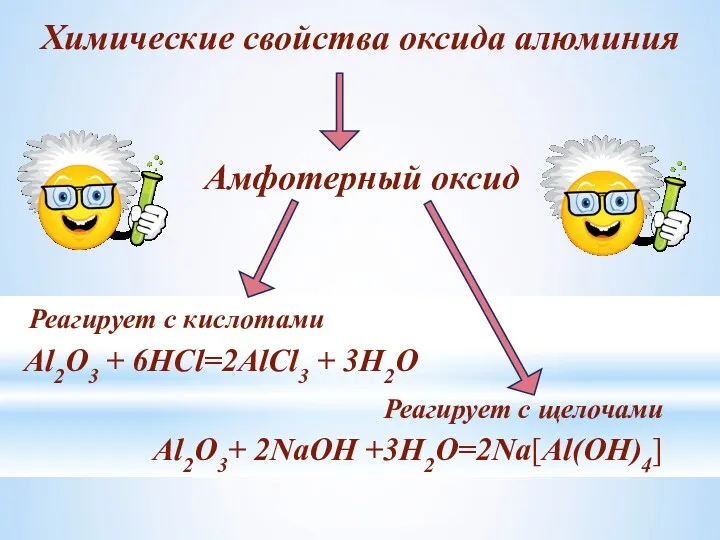
- 15. Химические свойства оксида алюминия Амфотерный оксид Реагирует с кислотами Реагирует с щелочами Al2O3 + 6HCl=2AlCl3 +
- 16. Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al + 3O2 =
- 17. Al2O3 Глинозём Корунд сапфир рубин Боксит
- 18. Применение сапфиров знаменитые сапфиры английской королевской семьи
- 19. Применение рубинов
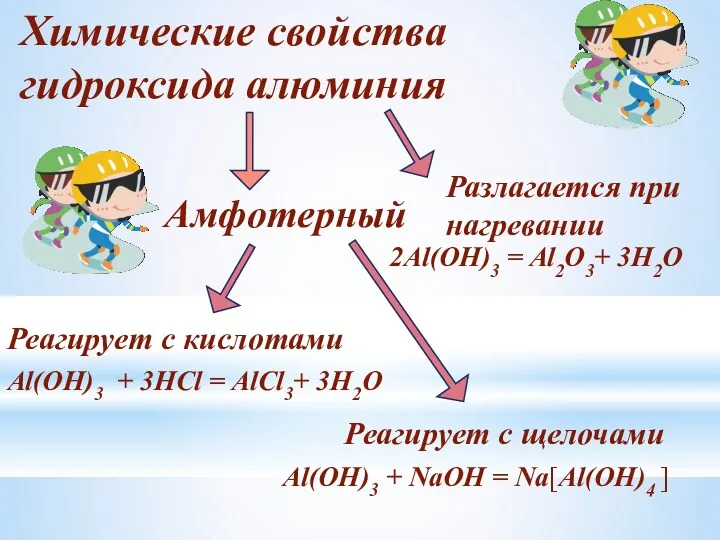
- 20. Химические свойства гидроксида алюминия Амфотерный Реагирует с кислотами Реагирует с щелочами Al(OH)3 + 3HCl = AlCl3+
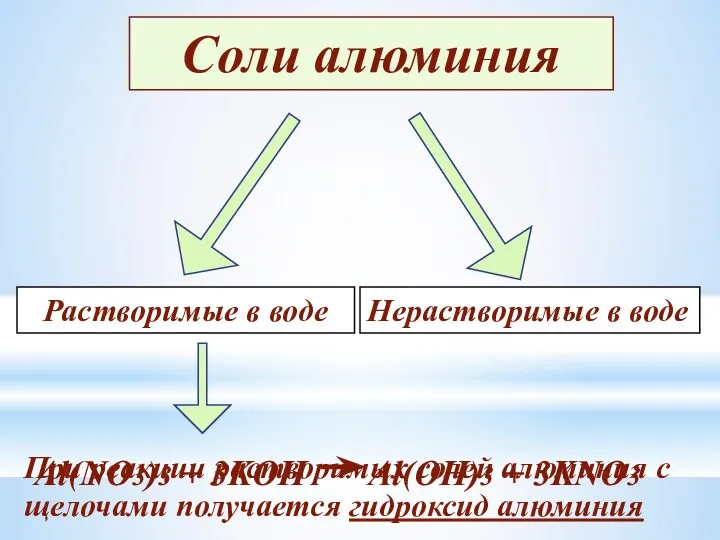
- 21. Соли алюминия Растворимые в воде Нерастворимые в воде При реакции растворимых солей алюминия с щелочами получается
- 22. Вставьте пропущенные слова в текст: Проверьте себя: Алюминий – это металл, у которого в соединениях степень
- 23. Какие из соединений вступят в реакцию с алюминием: Cl2 K2O CuSO4 H2O S BaSO4 HCl Cr
- 25. Скачать презентацию

















 Тема. Водородная связь
Тема. Водородная связь Анализ жидких средств для мытья посуды
Анализ жидких средств для мытья посуды Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Материалы с малой плотностью
Материалы с малой плотностью Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Застосування алканів
Застосування алканів Классы неорганических веществ
Классы неорганических веществ Индикаторы на кухне
Индикаторы на кухне Чисті речовини і суміші
Чисті речовини і суміші Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар
Синтетикалық пиретроидтар. Инсектицидтердің тиомочевиндер, нейтротоксиндер, гормоналды, авермектиндер, карбаматтар Решение задач по теме: «Электролиз»
Решение задач по теме: «Электролиз» Углеводы. Урок по химии для 9 класса
Углеводы. Урок по химии для 9 класса Химическая промышленность России
Химическая промышленность России Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот
Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот Кривая охлаждения железа и структуры сплавов
Кривая охлаждения железа и структуры сплавов Основные классы неорганических соединений
Основные классы неорганических соединений Альбитит-грейзеновые месторождения
Альбитит-грейзеновые месторождения Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс
Жёсткость воды и способы её устранения. Практическая работа №6. 9 класс Теория строения органического вещества. 10 класс
Теория строения органического вещества. 10 класс Катионы 1, 2 аналитических групп
Катионы 1, 2 аналитических групп Периодические системы химических элементов
Периодические системы химических элементов Токсикология пестицидов
Токсикология пестицидов Алкадиены
Алкадиены Электролитическая диссоциация. Реакции ионного обмена
Электролитическая диссоциация. Реакции ионного обмена Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Чипсы: польза или вред. Химия
Чипсы: польза или вред. Химия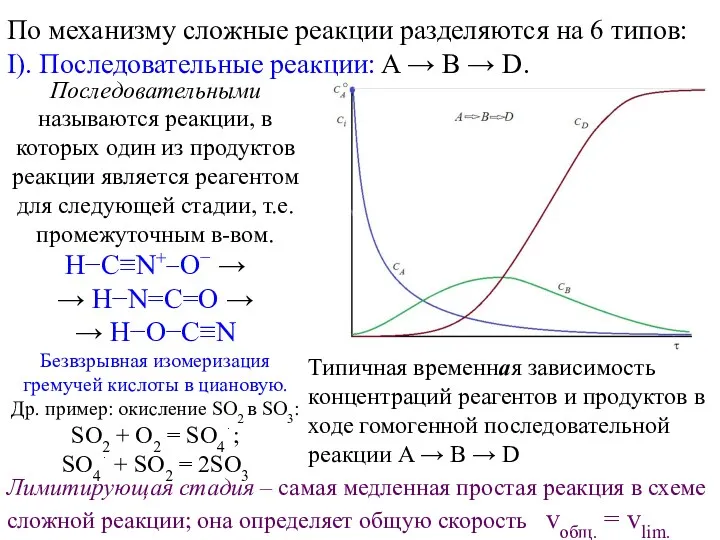 Сложные реакции по механизму
Сложные реакции по механизму