Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот презентация
Содержание
- 3. КИСЛОТЫ Тема урока:
- 4. ЦЕЛИ УРОКА: дать определение кислотам, рассмотреть состав кислот, классифицировать кислоты, рассмотреть схему образования кислотных дождей, ознакомиться
- 5. Кислоты вокруг нас
- 6. Кислоты в животном мире Тропический паук педипальпида стреляет во врагов струйкой жидкости, содержащей 84% уксусной кислоты.
- 7. Кислоты в растительном мире Мухоморы в качестве ядовитых токсинов «используют» иботеновую кислоту. Это вещество так ядовито,
- 8. Томаты содержат яблочную, лимонную, щавелевую кислоты
- 9. Аскорбиновая кислота витамин С
- 10. Кислоты в организме человека Если ты проглотил аскорбинку, Твой организм получил витаминку. Она закрывает болезням врата
- 11. Соляная кислота, находящаяся в желудке, помогает переваривать пищу. Молочная кислота образуется в мышцах при физической нагрузке.
- 12. Кислоты в нашей пище Жуйте лимон, если горло болит, Сок чудотворный вас исцелит.
- 13. Думаю, что не приукрашу, Если хвалить буду я простоквашу. Есть в ней молочная кислота – Молодость
- 14. Кислый - кислота
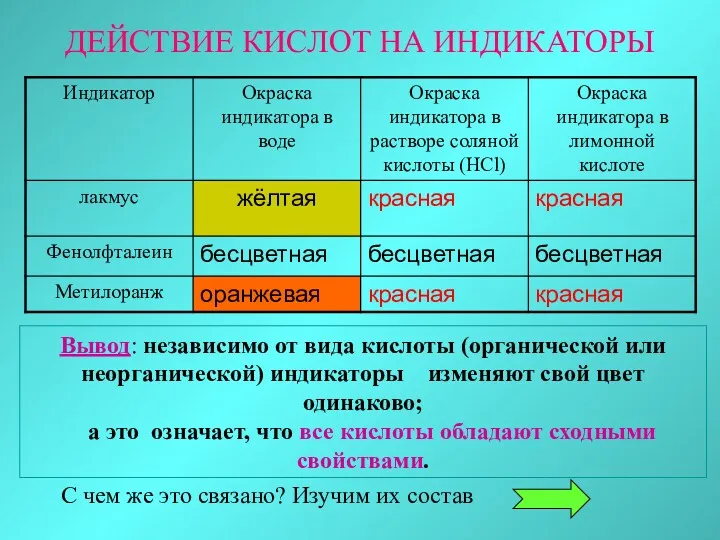
- 15. ДЕЙСТВИЕ КИСЛОТ НА ИНДИКАТОРЫ Вывод: независимо от вида кислоты (органической или неорганической) индикаторы изменяют свой цвет
- 16. Прочитайте формулы кислот. HCl, H2SO4, H3PO4 Кислоты – это сложные вещества, состоящие из ионов водорода и
- 17. КЛАССИФИКАЦИЯ КИСЛОТ
- 18. ОРГАНИЧЕСКИЕ – ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ. 1. По происхождению кислоты бывают
- 19. НЕОРГАНИЧЕСКИЕ- СЕРНАЯ, СОЛЯНАЯ, ПЛАВИКОВАЯ, ФОСФОРНАЯ, АЗОТНАЯ.
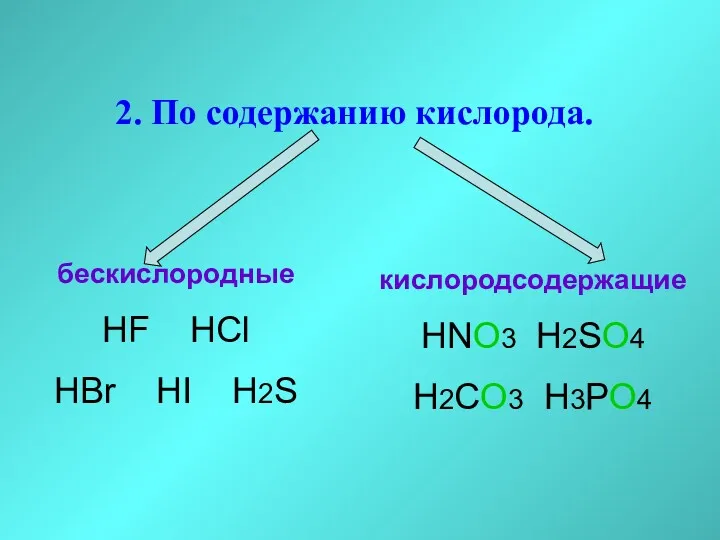
- 20. 2. По содержанию кислорода. бескислородные HF HCl HBr HI H2S кислородсодержащие HNO3 H2SO4 H2CO3 H3PO4
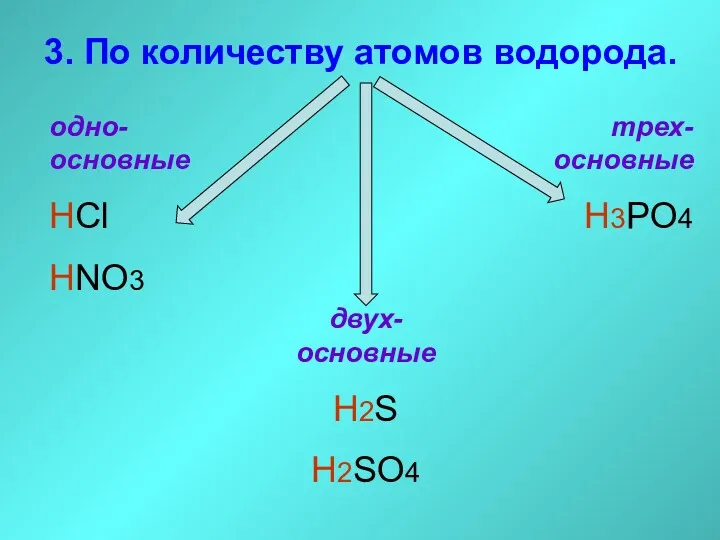
- 21. 3. По количеству атомов водорода. одно-основные HCl HNO3 двух-основные H2S H2SO4 трех-основные H3PO4
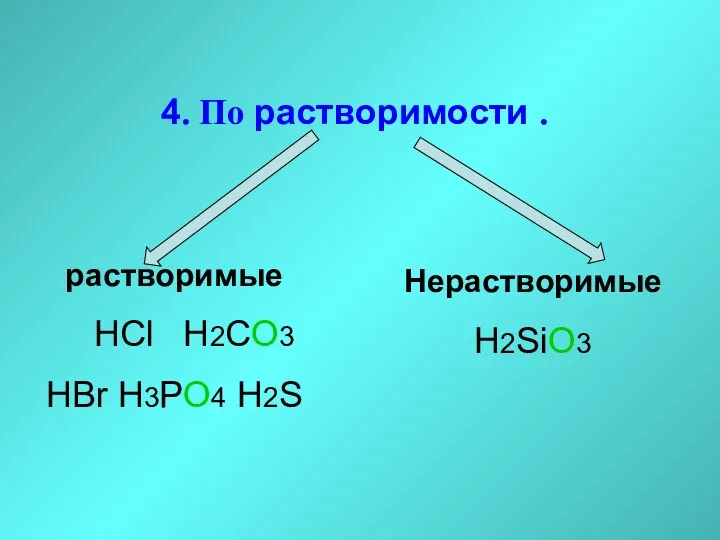
- 22. 4. По растворимости . растворимые HCl H2CO3 HBr H3PO4 H2S Нерастворимые H2SiO3
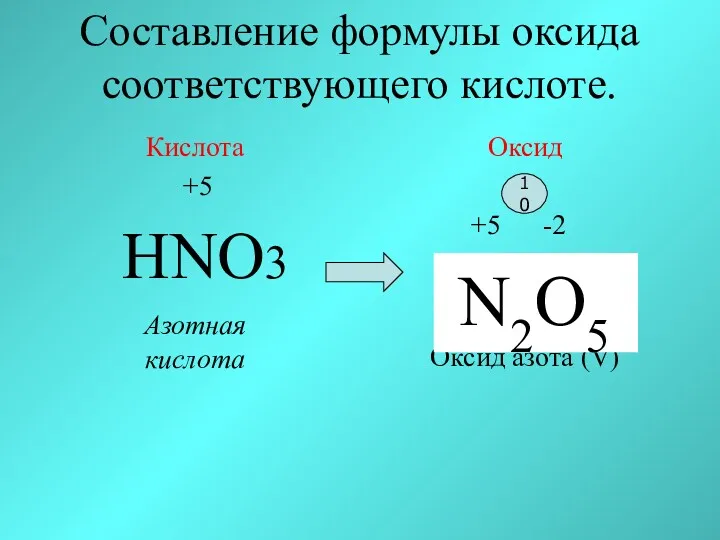
- 23. Составление формулы оксида соответствующего кислоте. Кислота +5 HNO3 Азотная кислота Оксид +5 -2 N O Оксид
- 24. НОМЕНКЛАТУРА КИСЛОТ Бескислородные кислоты: К названию кислотообразующего элемента добавляют гласную «о» и слова «водородная кислота» HCl
- 26. Кислородсодержащие кислоты: К русскому названию кислотообразующего элемента добавляют суффикс: Если элемент проявляет высшую СО (равную №
- 28. Применение Серная кислота – один из основных продуктов химической промышленности. Идет на производство минеральных удобрений (суперфосфат,
- 29. Применяется в металлургии (разложение руд, например, урановых), для очистки нефтепродуктов, как осушитель и др. Мировое производство
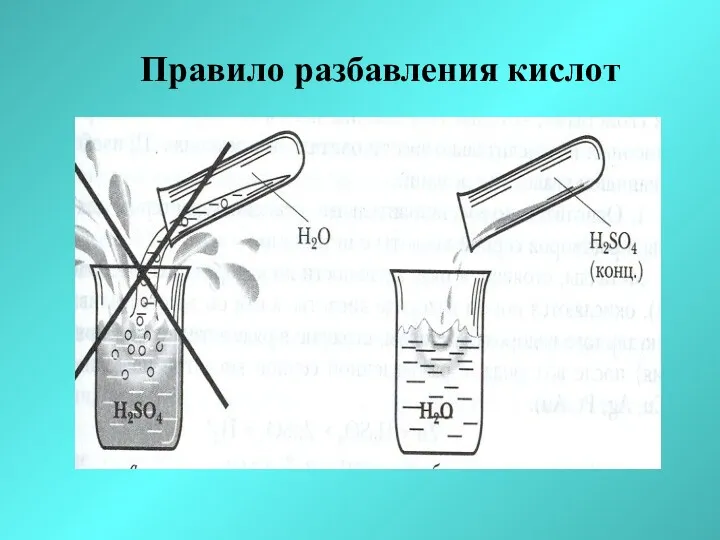
- 30. Правило разбавления кислот
- 31. Что произойдет, если к сахару добавить концентрированную серную кислоту? Интересный опыт:
- 32. Концентрированная серная кислота обугливает органические вещества. Правила техники безопасности: Внимание! Работать с кислотами необходимо аккуратно, так
- 33. Кислоты применяются в медицине. Аскорбиновая, фолиевая, липоевая, ацетил- салициловая и другие
- 34. Кислоты применяются в кулинарии. Уксусная и лимонная кислоты.
- 35. Домашнее задание: § 20, учить формулы и названия кислот, подготовиться к химическому диктанту
- 36. Тест по теме «КИСЛОТЫ»
- 37. 1. Выберите группу веществ, в которой указаны только формулы кислот. а) НСL, H2 O, H2 CO3а)
- 38. 2. Выберите группу, в которой указаны формулы только кислородсодержащих кислот а)НСL, Н2 SО4 , НNO3 б)Н2
- 39. 3. Выберите группу, в которой указаны формулы только одноосновных кислот а) НСL, НNO3, НFа б) Н2
- 40. 4. Под действием растворов кислот лакмус синий становится: а) малиновым б) не изменяет окраску в) красным
- 41. 5. «Кровью химии» называют: а)Соляную кислоту HСL б)Азотную кислоту HNO3 в)Фосфорную кислоту H3PO4 г)Серную кислоту H2SO4
- 43. Скачать презентацию


































 Кристаллические решётки и их виды
Кристаллические решётки и их виды Enantioselective Total Synthesis
Enantioselective Total Synthesis Химические свойства солей
Химические свойства солей Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Группа ультраосновных пород
Группа ультраосновных пород Строение атома
Строение атома Серная кислота
Серная кислота 20230419_izomery
20230419_izomery Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату kremniy
kremniy Алкены. Непредельные углеводороды
Алкены. Непредельные углеводороды Типы химических реакций. Систематизация и обобщение знаний
Типы химических реакций. Систематизация и обобщение знаний Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Методы получения органических галогенидов
Методы получения органических галогенидов Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном
Неметали. Фізичні та хімічні властивості. Явище адсорбції. Сполуки неметалічних елементів з Гідрогеном Химия аминокислот. Лекция № 4
Химия аминокислот. Лекция № 4 Стратегия химической промышленности
Стратегия химической промышленности Вещества
Вещества Химия 20 века
Химия 20 века Газовые смеси
Газовые смеси Правила техники безопасности при работе в химическом кабинете
Правила техники безопасности при работе в химическом кабинете Формы парфюмерно-косметической продукции
Формы парфюмерно-косметической продукции Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс Создание косметических средств
Создание косметических средств Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Металлы в природе. Способы получения металлов
Металлы в природе. Способы получения металлов