Содержание
- 2. ВОПРОСЫ: Какие вещества относят к солям? Как составляют формулы солей? Как называются соли ? - хлориды,
- 3. 1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓ каждый предыдущий металл вытесняет
- 4. ЗАДАНИЕ Допишите уравнения реакций: Al + FeSO₄ = Cu + MgCl₂ →
- 5. ЗАДАНИЕ Допишите уравнения реакций: Al + FeSO₄ → III II Fe + Al₂(SO₄)₃ 2 3 3
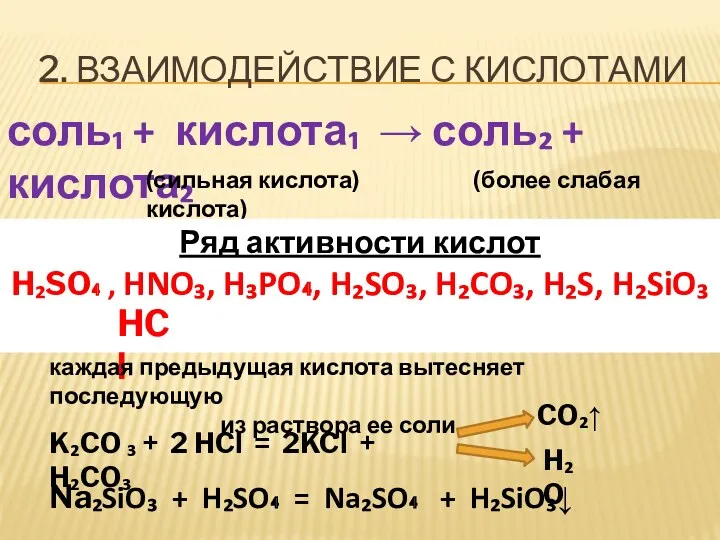
- 6. 2. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ соль₁ + кислота₁ → соль₂ + кислота₂ (сильная кислота) (более слабая кислота)
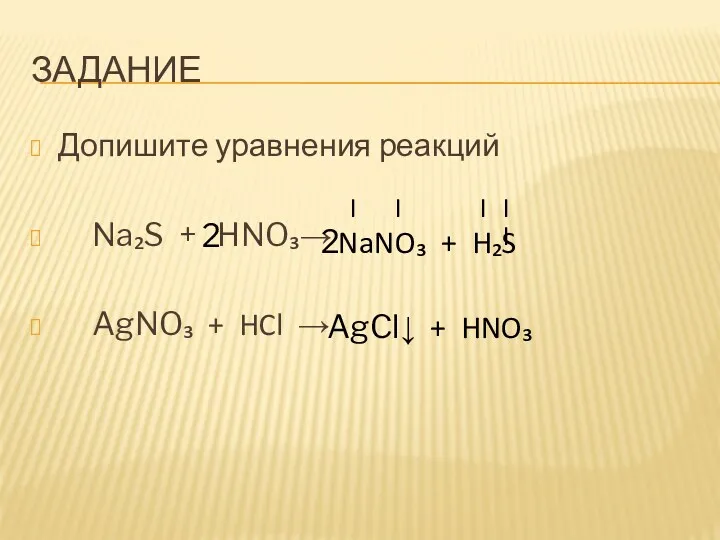
- 7. ЗАДАНИЕ Допишите уравнения реакций Na₂S + HNO₃→ AgNO₃ + HCl →
- 8. ЗАДАНИЕ Допишите уравнения реакций Na₂S + HNO₃→ AgNO₃ + HCl → I I I II NaNO₃
- 9. 3. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ соль₁ +основание₁ = соль₂ +основание₂↓ CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
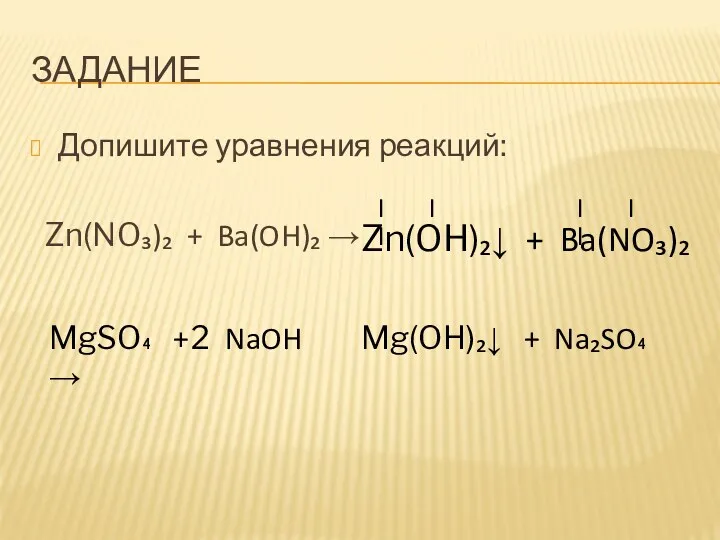
- 10. ЗАДАНИЕ Допишите уравнения реакций: Zn(NO₃)₂ + Ba(OH)₂ → MgSO₄ + NaOH →
- 11. ЗАДАНИЕ Допишите уравнения реакций: Zn(NO₃)₂ + Ba(OH)₂ → Zn(OH)₂↓ + Ba(NO₃)₂ II I II I MgSO₄
- 12. 4. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ соль₁ +соль₂= новая соль₁↓+ новая соль₂ BaCl₂ + Na₂SO₄ = BaSO₄↓ +
- 13. ЗАДАНИЕ Допишите уравнения реакций: MgCl₂ + Na₂CO₃ → Ca(NO₃)₂ + K₃PO₄ →
- 14. ЗАДАНИЕ Допишите уравнения реакций: MgCl₂ + Na₂CO₃ → Ca(NO₃)₂ + K₃PO₄ → MgCO₃↓ + NaCl II
- 15. 5. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИ НЕРАСТВОРИМЫХ СОЛЕЙ соль ↓ → оксид металла + оксид неметалла t⁰C BaSiO₃↓
- 16. ВЫВОД: + металл → + кислота → + основание → + соль → разложение при нагревании
- 17. Домашнее задание. - читать § 47,с. 161 ; - выполнить онлайн – тест https://onlinetestpad.com/zbhtg63fcedcu
- 19. Скачать презентацию













 Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Electrolysis
Electrolysis Химическая кинетика. Катализ. Химическое равновесие
Химическая кинетика. Катализ. Химическое равновесие Арены. Бензол
Арены. Бензол Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно
Экоэстафета. ученики 9 Б класса гимназии №6 г. Гродно Электролиз расплавов и водных растворов солей
Электролиз расплавов и водных растворов солей Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Ароматические амины
Ароматические амины Химическая наука и промышленность в годы ВОВ
Химическая наука и промышленность в годы ВОВ Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері
Титан және оның қорытпалары. Титанның физика-химиялық қасиеттері Азотная кислота
Азотная кислота Неметаллы: общая характеристика
Неметаллы: общая характеристика Кремний және оның қосылыстары
Кремний және оның қосылыстары Біохімія вуглеводів
Біохімія вуглеводів Каучук, резина и другие
Каучук, резина и другие Алюминий. Характеристика алюминия по положению в ПСХЭ. Строение атома
Алюминий. Характеристика алюминия по положению в ПСХЭ. Строение атома Массообменные процессы
Массообменные процессы Содержание кислорода и углекислого газа в помещениях школы
Содержание кислорода и углекислого газа в помещениях школы Основные классы органических соединений и их роль в живых организмах
Основные классы органических соединений и их роль в живых организмах Пластмаси. Класифікація пластмас
Пластмаси. Класифікація пластмас Основания. Классы неорганических соединений
Основания. Классы неорганических соединений Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Закон сохранения массы веществ
Закон сохранения массы веществ Силіцій
Силіцій Методы химии
Методы химии Понятие о коррозии металлов. Способы защиты от коррозии
Понятие о коррозии металлов. Способы защиты от коррозии Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Фракционирование клеточных экстрактов
Фракционирование клеточных экстрактов