Содержание
- 2. Девиз: «Знать – значит победить» Цель работы Задачи Изучить коррозию металлов, исследовать причины и условия её
- 3. Результат: прямые потери массы металла; косвенные потери - утрата важнейших свойств. Коррозия – рыжая крыса, Грызёт
- 4. Делийская железная колонна Эйфелева башня Высота 7, 2 м, вес около 6 тонн Возраст 1600 лет
- 5. Тема урока: «Понятие о коррозии металлов. Способы защиты от коррозии»
- 6. «Знать – значит победить» А. Н. Несмеянов Цели урока: познакомиться с типами коррозии, со способами защиты
- 7. Графический диктант 1 вариант Для Меди (Си) 2 вариант Для калия (К) Это активный щелочной металл.
- 8. Графический диктант Металлом можно воспользоваться для получения серебра из его соли. Может вытеснять цинк из его
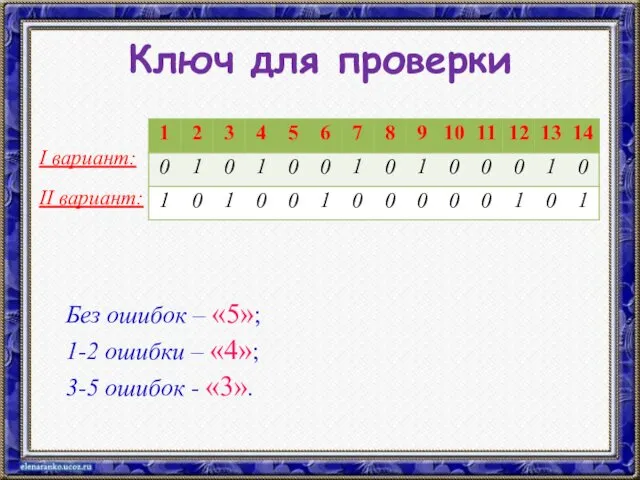
- 9. Ключ для проверки I вариант: II вариант: Без ошибок – «5»; 1-2 ошибки – «4»; 3-5
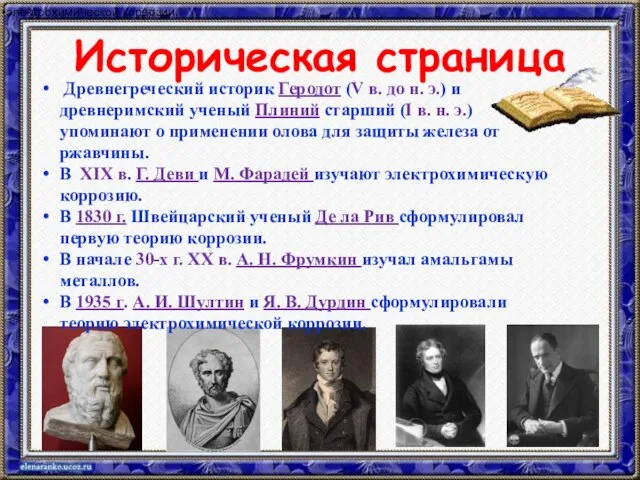
- 10. Историческая страница электрохимической коррозии. Древнегреческий историк Геродот (V в. до н. э.) и древнеримский ученый Плиний
- 11. Информационная страница КОРРОЗИЯ – это разрушение металлов и сплавов под действием внешней среды. Коррозия – от
- 13. Почему темнеет яблоко?
- 14. Интересные факты
- 15. Интересные факты О том, сколь коварна и прожорлива коррозия, знают все автомобилисты. Двигатель порой готов еще
- 16. Информационная страница КОРРОЗИЯ – это окислительно-восстановительный процесс, при котором атомы металла переходят в ионы. В роли
- 17. с. 108-109 учебника
- 18. Химическая коррозия Газовая В жидких не электролитах В нефти В сере В органических веществах 4Fe +
- 19. Электрохимическая коррозия 2Fe + O2 + 2H2O = 2Fe(OH)2 Fe - 2е- → Fe2+ О2 О2
- 20. Виды коррозии
- 21. По виду коррозионной среды
- 22. Газовая Атмосферная Жидкостная Почвенная Блуждающими токами
- 23. По характеру разрушений
- 24. Сплошная коррозия Равномерная Неравномерная
- 25. Местная коррозия Язвенная Точечная Пятнами
- 26. Причины возникновения местной коррозии Соль на дорогах Морская вода Межкристаллитная коррозия
- 27. Факторы, влияющие на скорость коррозии Экспериментальная страница
- 28. Цель: исследовать влияние сред, контактов металлов на скорость коррозии
- 29. Гипотеза исследования Коррозия металлов – химическая реакция, значит на её скорость может влиять контакт с другими
- 30. Метод исследования Эксперимент
- 31. Что делали 1 стакан: Fe + H2O 2 стакан: Fe + р-р NaCl 3 стакан: Fe,
- 32. Результат эксперимента
- 33. Что наблюдали Стакан №1. Железо слабо прокорродировало, в чистой воде коррозия идет медленнее, так как это
- 34. Стакан №2. Скорость коррозии выше, чем в первом случае, следовательно, NaCl увеличивает скорость коррозии.
- 35. Стакан №3. Железный гвоздь в контакте с медной проволокой, опущенный в раствор NaCl сильно прокорродировал.
- 36. Стакан №4. В контакте с цинком железо не корродирует.
- 37. Стакан №5. Железный гвоздь, опущенный в раствор NaCl, к которому добавили NaOH, не корродирует.
- 38. Вывод Действительно, мы увидели, что скорость коррозии меняется в зависимости от контакта с другими химическими веществами.
- 39. ПРИМЕРЫ КОРРОЗИИ
- 40. луженое железо Консервная банка
- 41. Оцинкованное ведро Основа – железо, поверхность – серебристо-белый блестящий металл – Zn
- 42. Практическая страница «Просто знать – ещё не всё, знания нужно уметь использовать». Гёте
- 43. Ингибиторы – это вещества, способные в малых количествах замедлять протекание химических процессов или останавливать их.
- 44. Практическая страница Способы защиты металлов от коррозии: Шлифование поверхностей.
- 45. Способы защиты металлов от коррозии: Использование легированных сталей Практическая страница
- 46. Способы защиты металлов от коррозии: Нанесение защитных покрытий: Неметаллических (лаки, эмали, смазка, масла) Практическая страница
- 47. Способы защиты металлов от коррозии: Нанесение защитных покрытий: металлических (покрытие одного металла слоем другого) Например никелирование,
- 48. Способы защиты металлов от коррозии: Нанесение защитных покрытий: Химических: Воронение, Оксидные пленки, Полимерные пленки И другие…
- 49. Способы защиты металлов от коррозии: Электрохимические методы Протекторная защита – к металлической конструкции присоединяется кусок более
- 50. Способы защиты металлов от коррозии: Электрохимические методы: Катодная защита – конструкция присоединяется к внешнему источнику тока
- 51. Способы защиты металлов от коррозии: Обработка среды (В котельных установках из воды удаляется кислород.) Практическая страница
- 52. Нанотехнология. Самовосстанавливающийся газопровод.
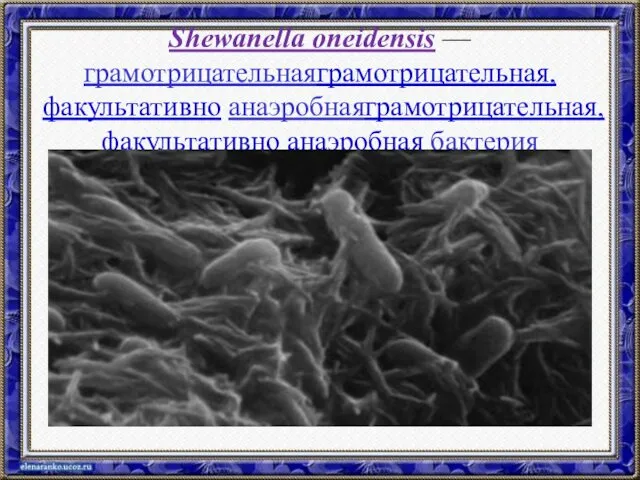
- 53. Shewanella oneidensis — грамотрицательнаяграмотрицательная, факультативно анаэробнаяграмотрицательная, факультативно анаэробная бактерия
- 54. «Стоп! Красный свет!» Вопросы: Что такое коррозия? Какие виды коррозии вы знаете? Когда и кем была
- 55. Задача Сантехника попросили поставить водопроводный кран, на стальную трубу. В наличии оказались хромированный и медный краны.
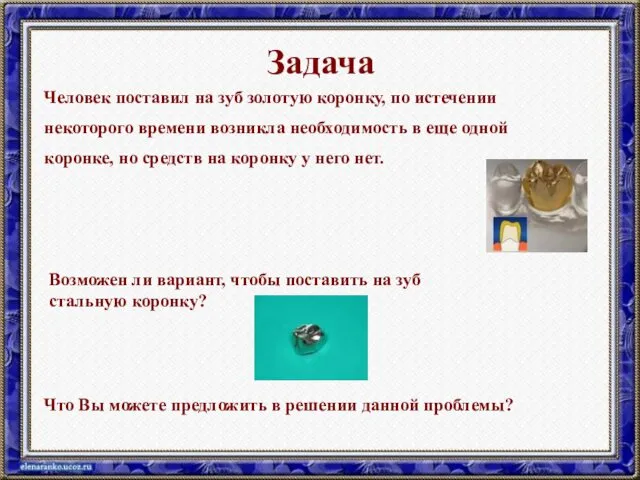
- 56. Задача Человек поставил на зуб золотую коронку, по истечении некоторого времени возникла необходимость в еще одной
- 57. Задача Определите массу оксида серы (VI), которую можно получить при окислении 124 г оксида серы (IV),
- 58. Задача Определите объем водовода, который образуется при растворении в соляной кислоте 150 г латуни, содержашей по
- 59. Задача Расчитайте массовые доли (в %) элементов в С12Н22О12.
- 61. Рефлексия Сегодня на уроке я узнал(а)… Было интересно… Было трудно… Я выполнял(а) задания… Я понял(а), что…
- 63. Скачать презентацию
























































 Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Углеводы, монозы, биозы. Лекция 15
Углеводы, монозы, биозы. Лекция 15 Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений
Безазотистые вторичные метаболиты минорных групп в фармации. Биохимия, функциональное значение в царстве растений ae2db93272ef42dba476a56bbc56b895
ae2db93272ef42dba476a56bbc56b895 S-элементтердің жалпы сипаттамасы
S-элементтердің жалпы сипаттамасы Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Хімічний лабіринт
Хімічний лабіринт Аминокислоты. Классификация аминокислот
Аминокислоты. Классификация аминокислот Жесткость воды и способы её устранения
Жесткость воды и способы её устранения Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Главная подгруппа V группы..Азот
Главная подгруппа V группы..Азот Поделочные камни
Поделочные камни Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Кислород. 8 класс
Кислород. 8 класс Чисті речовини і суміші
Чисті речовини і суміші Электролиз
Электролиз Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз
Электрохимия. Электродные потенциалы. Электродвижущие силы. Электролиз Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Методы титрования. Перманганатометрия. (Лекция 24)
Методы титрования. Перманганатометрия. (Лекция 24) Химические свойства металлов
Химические свойства металлов Гидролиз солей
Гидролиз солей Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії
Формування поняття про окисно-відновні реакції в процес і вивчення шкільного курсу хімії Каменный уголь
Каменный уголь Электродные системы
Электродные системы Методы разделения белковых смесей. Электрофорез
Методы разделения белковых смесей. Электрофорез Анализ 3% раствора водорода пероксида
Анализ 3% раствора водорода пероксида Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования
Ароматические кислоты и их производные. Общая характеристика, методы получения и исследования