Содержание
- 2. Аминокислоты Аминокислоты - это органические соединения, в состав которых входят одна или несколько карбоксильных групп и
- 3. По характеру углеводородного радикала аминокислоты делятся на: алифатические (радикал является остатком предельного углеводорода) ароматические (в состав
- 4. По положению аминогруппы аминокислоты делятся на: α-аминокислоты (аминогруппа находится у атома углерода, соседнего с карбоксильной группой)
- 5. Изомерия аминокислот изомерия углеродного скелета изомерия положения аминогрупп оптическая изомерия Все α-аминокислоты, кроме глицина H2N-CH2-COOH, содержат
- 6. Номенклатура аминокислот Международная номенклатура За основу выбирают самую длинную цепь, содержащую карбоксильную и аминогруппы, NH2-группа обозначается
- 7. По способности организма синтезировать из предшественников: Незаменимые аминокислоты — это аминокислоты, которые не могут быть синтезированы
- 8. Способы получения. 1) Гидролиз белков. Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси
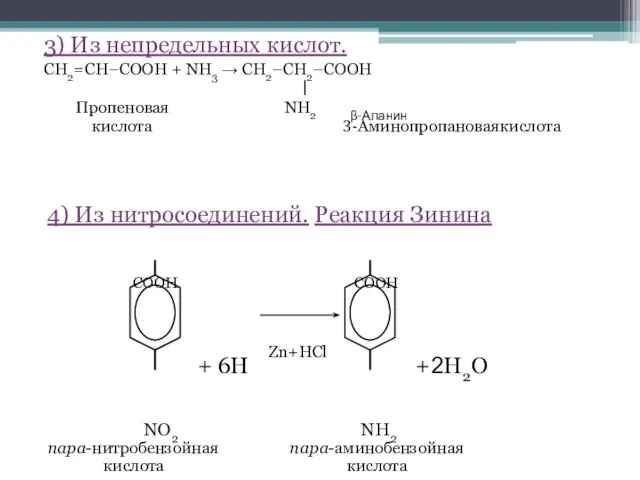
- 9. 3) Из непредельных кислот. CH2=CH–COOH + NH3 → CH2–CH2–COOH Пропеновая NH2 β-Аланин кислота 3-Аминопропановаякислота 4) Из
- 10. Физические свойства аминокислот Аминокислоты – бесцветные кристаллические вещества, большинство растворимы в воде, нерастворимы в неполярных органических
- 11. Химические свойства Амфотерность. Аминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной
- 12. 2) Образование внутренних солей. CH2–COOH → CH2–COO - - +H + NH2 NH2 +H+ CH2–COOH CH2–COO
- 13. Реакции по карбоксильной группе Взаимодействие с оксидами металлов, гидроксидами и солями слабых кислот. 2CH2-COOH + Na2CO3
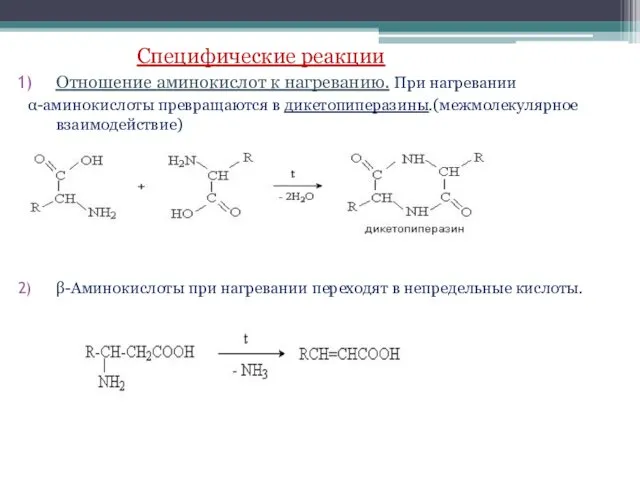
- 14. Специфические реакции Отношение аминокислот к нагреванию. При нагревании α-аминокислоты превращаются в дикетопиперазины.(межмолекулярное взаимодействие) β-Аминокислоты при нагревании
- 15. γ-аминокислоты при нагревании образуют циклические амиды , γ-лактамы.(внутримолекулярное взаимодействие) t CH3-CH2- CH2-COOH CH2-CH2-CH2+ H2O NH2 C
- 16. Белки
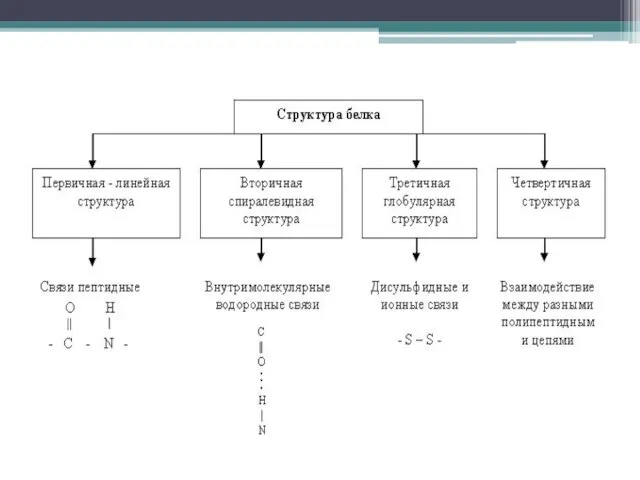
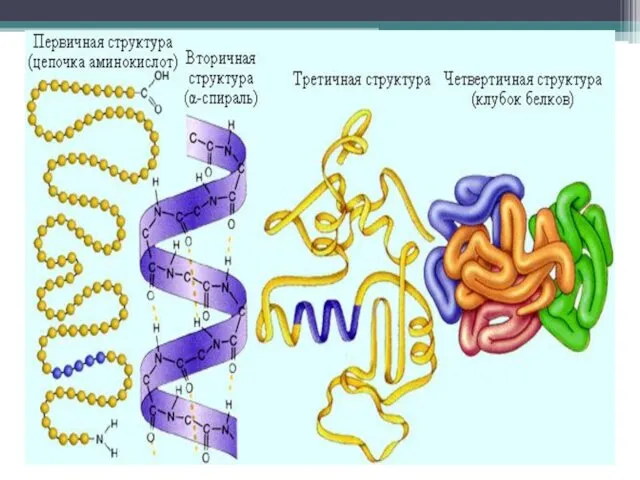
- 17. Белки – это природные высокомолекулярные соединения(биополимеры),структурную основу которой составляют полипептидные цепи, построенные из остатков α–аминокислот. По
- 20. Физические свойства белков. Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они
- 21. Химические свойства Гидролиз белков Гидролиз белков — это необратимое разрушение первичной структуры в кислом или щелочном
- 22. Пенообразование. Процесс пенообразования– это способность белков образовывать высококонцентрированные системы «жидкость– газ», называемые пенами. Устойчивость пены, в
- 23. Амфотерные свойства. Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как
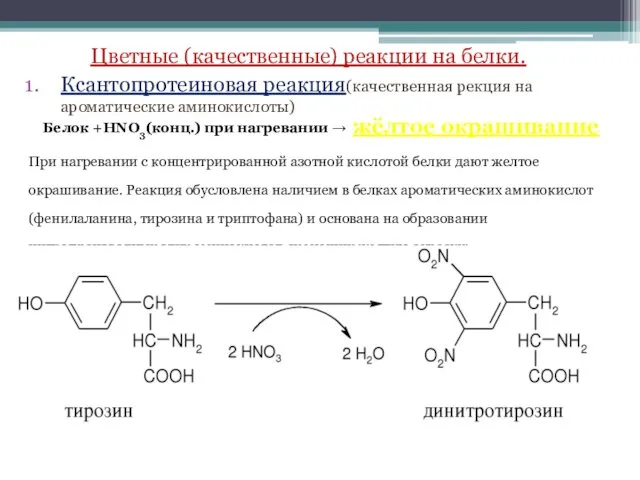
- 24. Цветные (качественные) реакции на белки. Ксантопротеиновая реакция(качественная рекция на ароматические аминокислоты) Белок +HNO3(конц.) при нагревании →
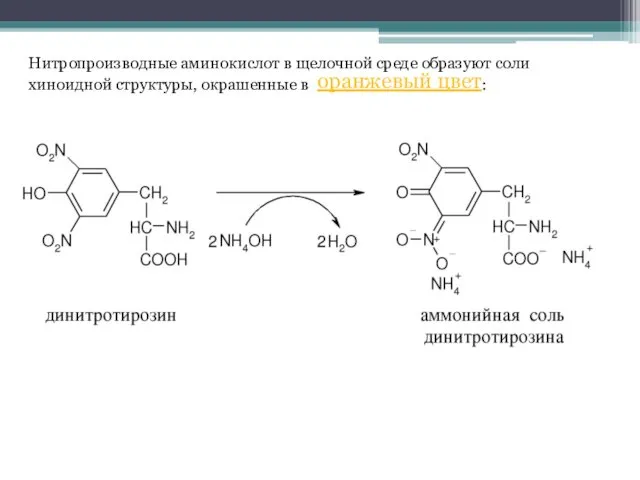
- 25. Нитропроизводные аминокислот в щелочной среде образуют соли хиноидной структуры, окрашенные в : оранжевый цвет
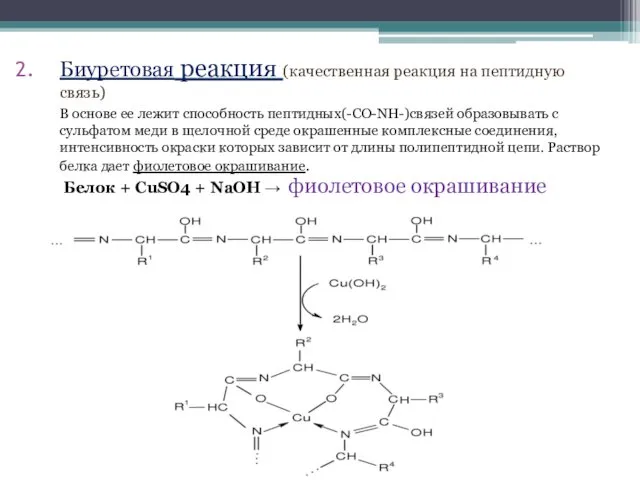
- 26. Биуретовая реакция (качественная реакция на пептидную связь) В основе ее лежит способность пептидных(-CO-NH-)связей образовывать с сульфатом
- 27. Реакция Фоля (Цистеиновая реакция) качественная реакция на серосодержащие аминокислоты(на цистеин и цистин), входящие в состав белка
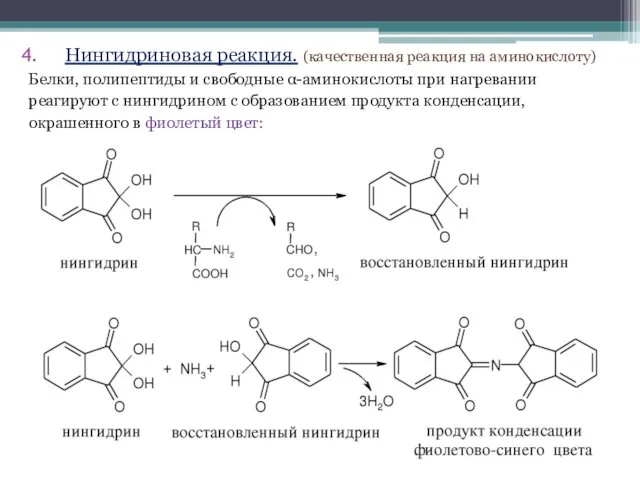
- 28. Нингидриновая реакция. (качественная реакция на аминокислоту) Белки, полипептиды и свободные α-аминокислоты при нагревании реагируют с нингидрином
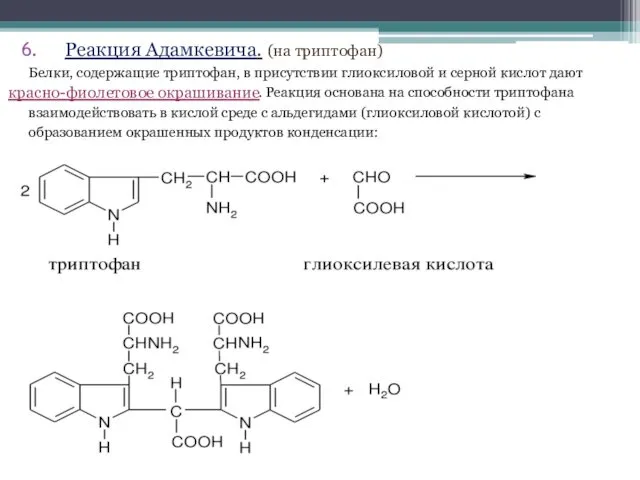
- 29. Реакция Адамкевича. (на триптофан) Белки, содержащие триптофан, в присутствии глиоксиловой и серной кислот дают . Реакция
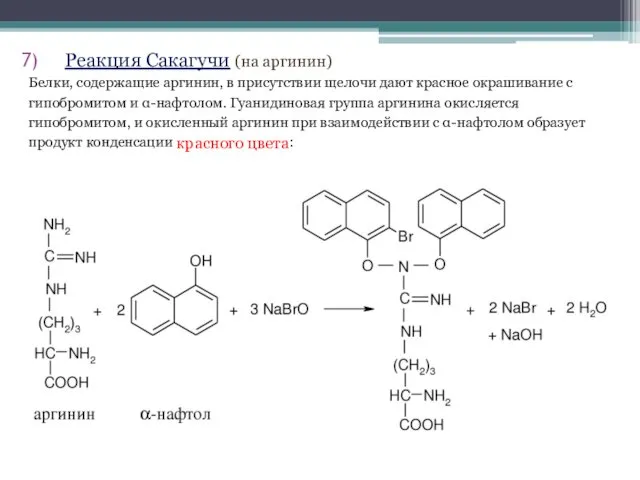
- 30. Реакция Сакагучи (на аргинин) Белки, содержащие аргинин, в присутствии щелочи дают красное окрашивание с гипобромитом и
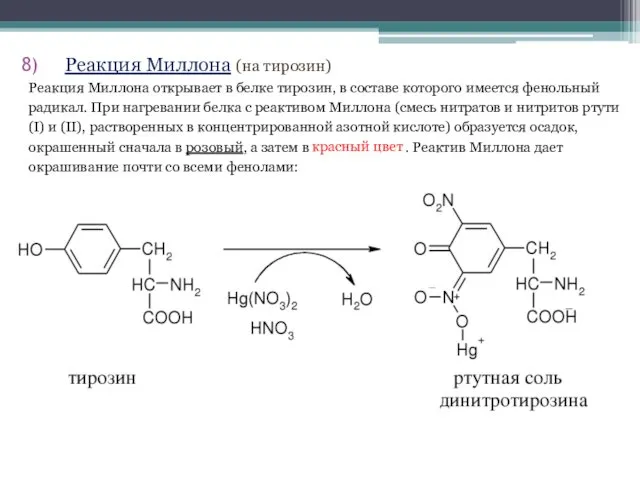
- 31. Реакция Миллона (на тирозин) Реакция Миллона открывает в белке тирозин, в составе которого имеется фенольный радикал.
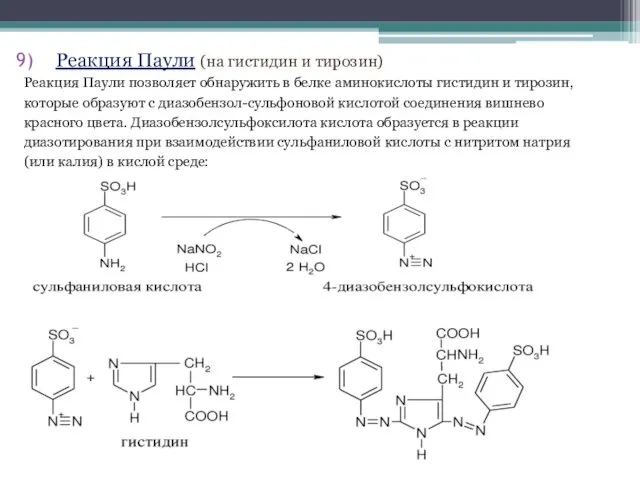
- 32. Реакция Паули (на гистидин и тирозин) Реакция Паули позволяет обнаружить в белке аминокислоты гистидин и тирозин,
- 34. Скачать презентацию


















 Амины. Классификация аминов. Характеристика метиламина и анилина
Амины. Классификация аминов. Характеристика метиламина и анилина Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Основания. Гидроксид аммония-NH₃·H₂O
Основания. Гидроксид аммония-NH₃·H₂O Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Полудрагоценные камни
Полудрагоценные камни Проект Кабинет химии будущего
Проект Кабинет химии будущего Аммиак
Аммиак Щелочные металлы
Щелочные металлы Классификация и номенклатура неорганических веществ
Классификация и номенклатура неорганических веществ Теория возникновения электродных и ОВ-потенциалов
Теория возникновения электродных и ОВ-потенциалов Железо. Fe (лат. Феррум)
Железо. Fe (лат. Феррум) Различные теории кислот и оснований
Различные теории кислот и оснований Состав и свойства сжиженного газа. Вопрос №1
Состав и свойства сжиженного газа. Вопрос №1 Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Металдар арасындағы беттік керіліс
Металдар арасындағы беттік керіліс Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Элементы V группы главной подгруппы
Элементы V группы главной подгруппы Химия радиоактивных элементов
Химия радиоактивных элементов Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Предельные углеводороды
Предельные углеводороды Азот
Азот Химия - тұрмыста
Химия - тұрмыста Химическое производство
Химическое производство Электролитическая диссоциация
Электролитическая диссоциация Электролитическая диссоциация
Электролитическая диссоциация Гідроліз солей
Гідроліз солей Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии