Содержание
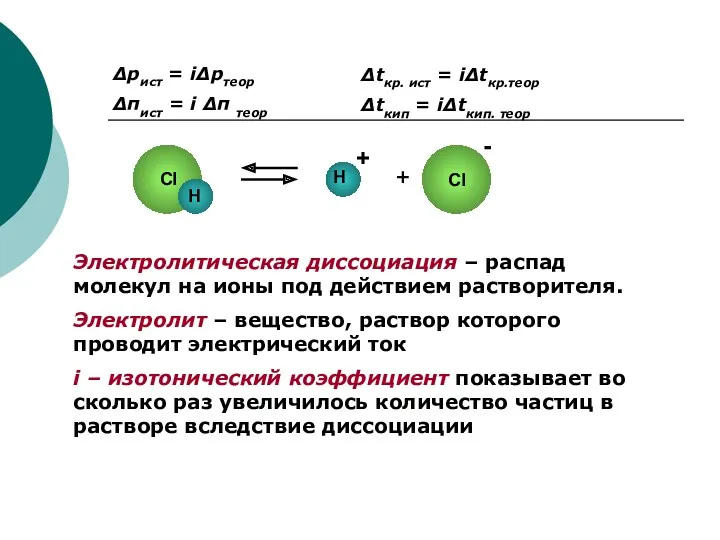
- 2. Δpист = iΔpтеор Δπист = i Δπ теор Δtкр. ист = iΔtкр.теор Δtкип = iΔtкип. теор
- 3. Количественные характеристики процесса диссоциации Степень диссоциации, α – доля молекул, распавшихся на ионы Константа диссоциации Кд
- 4. Классификация электролитов Значения степени диссоциации указаны для 0,1М растворов
- 5. 9.2. Факторы, влияющие на процесс диссоциации 1. Влияние концентрации электролита С понижением концентрации степень диссоциации увеличивается.
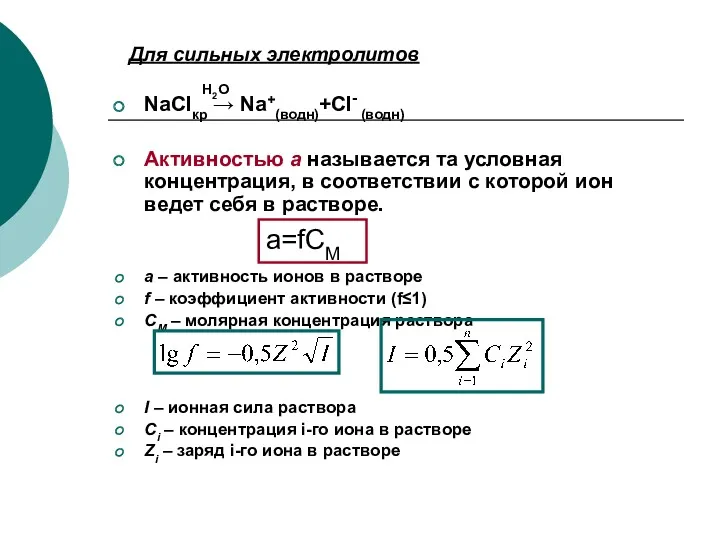
- 6. Для сильных электролитов NaClкр → Na+(водн)+Cl- (водн) Активностью а называется та условная концентрация, в соответствии с
- 7. 2. Влияние температуры на процесс диссоциации Процесс диссоциации – эндотермический. Поэтому с повышением температуры степень диссоциации
- 8. 4. Влияние природы вещества на процесс его диссоциации Чем выше полярность связи, тем легче вещество диссоциирует
- 9. Сила бескислородных кислот зависит от радиуса аниона, а у анионов с близкими радиусами - от величины
- 10. Сила кислородсодержащих кислот, формула которых имеет общий вид ЭОm(OH)n, зависит от природы кислотообразующего элемента и от
- 11. Основания по Аррениусу – это гидроксилсо-держащие соединения, дающие в водном растворе ионы гидроксила Силу основания можно
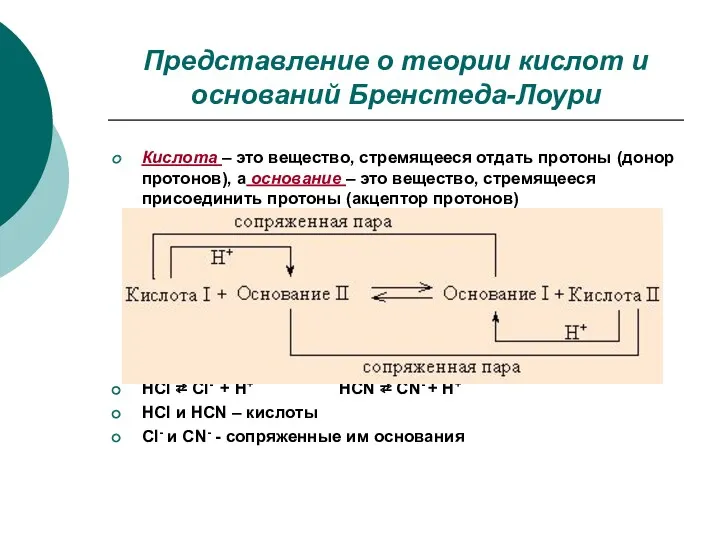
- 12. Представление о теории кислот и оснований Бренстеда-Лоури Кислота – это вещество, стремящееся отдать протоны (донор протонов),
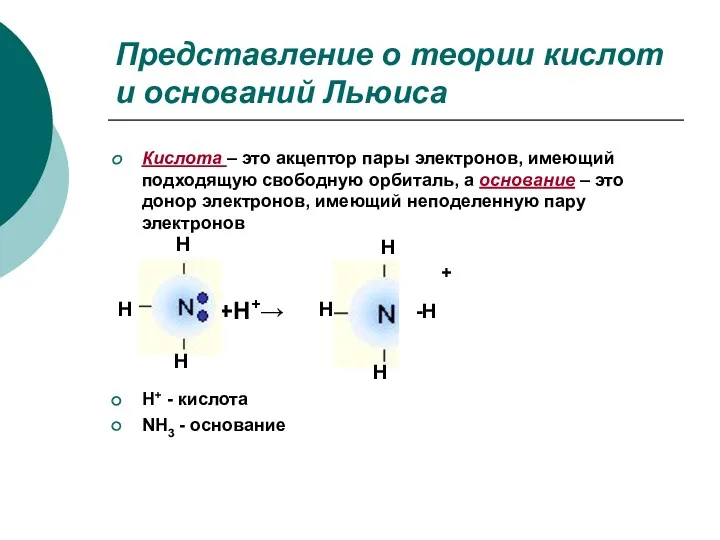
- 13. Представление о теории кислот и оснований Льюиса Кислота – это акцептор пары электронов, имеющий подходящую свободную
- 14. 9.3. Ступенчатая диссоциация электролитов Диссоциация кислот Максимальное число ионов водорода, образующихся при диссоциации из одной молекулы
- 15. Процесс по третьей ступени очень сильно сдвинут влево, то есть в растворе практически отсутствует ион РО4-
- 16. Диссоциация оснований Максимальное число ионов гидроксила, образующихся при диссоциации из одной основания называется его кислотностью. NaOH
- 17. Диссоциация солей Средние соли диссоциируют полностью, в одну ступень: Al2(SO4)3 ⇄ 2Al3+ +3SO42- Кислые и основные
- 18. 9.4. Диссоциация воды. Водородный показатель H2O ⇄ H++OH-; [H2O]р ≈ [H2O]исх; Для объема 1 л m=10000
- 19. Для характеристики реакции среды ввели величину «водородный показатель». Водородный показатель (рН) – это десятичный логарифм концентрации
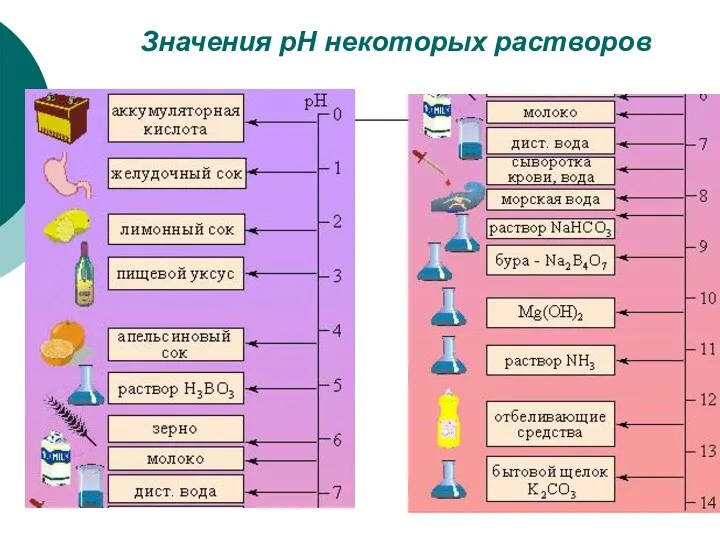
- 20. Значения рН некоторых растворов
- 22. Скачать презентацию












![9.4. Диссоциация воды. Водородный показатель H2O ⇄ H++OH-; [H2O]р ≈](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/253377/slide-17.jpg)

 Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Методи добування у промисловості
Методи добування у промисловості Арены - ароматические соединения
Арены - ароматические соединения Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Кремний. Физические свойства кремния
Кремний. Физические свойства кремния Аспирин: польза или вред?
Аспирин: польза или вред? Щелочные металлы
Щелочные металлы Углерод, как химический элемент и простое вещество
Углерод, как химический элемент и простое вещество Химический состав воздуха
Химический состав воздуха Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем
Оптические свойства дисперсных систем. Оптические методы исследования коллоидных систем Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды)
Алканы (Предельные углеводороды. Парафины. Насыщенные углеводороды) Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды
Реакции ионного обмена в растворах электролитов. рH раствора как показатель кислотности среды Germaniy gruppachasining elementlarining olinishi va xossalari
Germaniy gruppachasining elementlarining olinishi va xossalari Фосфор и его соединения
Фосфор и его соединения Водород
Водород Вода — это уникальное вещество
Вода — это уникальное вещество Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Биополимеры. Классификация полисахаридов (гликаны)
Биополимеры. Классификация полисахаридов (гликаны) Минералы и формы существования марганца
Минералы и формы существования марганца Экспериментальные методы физико-химических исследований. Лекция 7
Экспериментальные методы физико-химических исследований. Лекция 7 Щелочные металлы
Щелочные металлы Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Альдегиды и кетоны
Альдегиды и кетоны Биологически важные вещества жиры
Биологически важные вещества жиры Виды химической связи
Виды химической связи Алкалоиды. Классификация алкалоидов:
Алкалоиды. Классификация алкалоидов: Разбор заданий #ОВРновый, #реакционно и #соточка
Разбор заданий #ОВРновый, #реакционно и #соточка Общие правила техники безопасности при работе в кабинете химии. Урок №2. Практическая работа №1
Общие правила техники безопасности при работе в кабинете химии. Урок №2. Практическая работа №1