Содержание
- 2. История открытия Считается, что фосфор открыл в 1669 году алхимик из Гамбурга Хеннинг Бранд. Он был
- 3. История открытия Он собрал около тонны мочи из солдатских казарм и выпаривал ее до образования сиропообразной
- 4. Природные соединения Из-за большой химической активности встречается в природе только в виде соединений. Важнейшими минералами фосфора
- 5. Природные соединения Крупнейшее месторождение апатитов находится на Кольском полуострове, в районе Хибинских гор. Залежи фосфоритов находятся
- 6. Нахождение в природе Фосфор входит в состав всех живых организмов. А именно он встречается в соединениях:
- 7. Получение Фосфор производят в электрических печах, восстанавливая апатит углем в присутствии кремнезема: Ca3(PO4)2+3SiO2+5C=3CaSiO3+5CO+P2 Пары фосфора при
- 8. Важнейшие соединения Н3РО4 фосфорная кислота Р2О5 оксид фосфора (V)
- 9. Аллотропные модификации фосфора
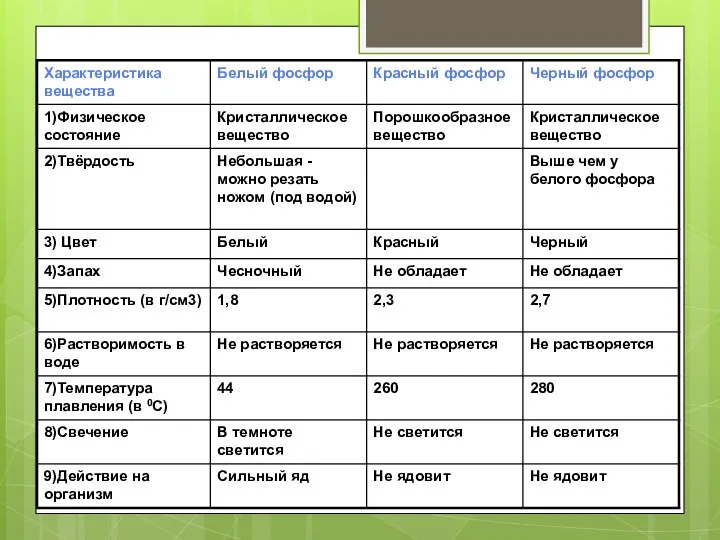
- 10. Физические свойства Элементарный фосфор в обычных условиях представляет собой несколько устойчивых аллотропических модификаций; вопрос аллотропии фосфора
- 12. Аллотропные модификации Горение белого фосфора Белый фосфор окисляется кислородом уже при обычных условиях, а в тонкоизмельченном
- 13. Химические свойства В химических реакциях проявляет окислительно-восстановительную двойственность. Как окислитель взаимодействует со многими металлами, образуя фосфиды.
- 14. Химические свойства При длительном нагревании белого фосфора без доступа воздуха он желтеет и постепенно превращается в
- 15. Оксид фосфора (V) Р2О5 – белый порошок, очень гигроскопичен (самый эффективный осушитель). Является типичным кислотным оксидом.
- 16. Физические свойства P2O5 Белый, рыхлый порошок, гигроскопичный. Хранят в герметически закрытых сосудах.
- 17. Химические свойства P2O5 Проявляет свойства кислотного оксида. 1) реагирует с водой: P2O5 + H2O 2HPO3 P2O5
- 18. Ортофосфорная кислота Получение. Р О + Н О 2 2 5 ↔ 3 4 Р Н
- 19. Ортофосфорная кислота Получение. Ca PO4 + H SO4 ↔ 3 2 2 + ( ) Ca
- 20. Ортофосфорная кислота Ортофосфорная кислота – кристаллическое, нелетучее, твердое, бесцветное вещество. Смешивается с водой в любых отношениях.
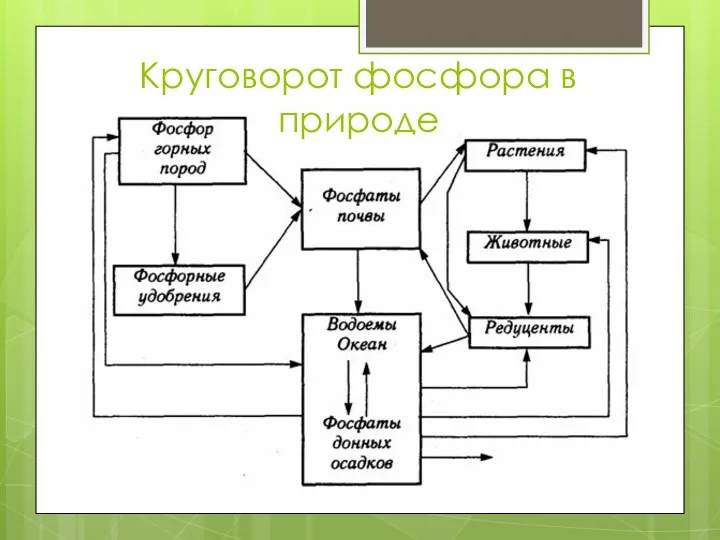
- 21. Круговорот фосфора в природе
- 22. Применение фосфора
- 23. Применение фосфора Около 80% от всего производства белого фосфора идет на синтез чистой ортофосфорной кислоты. Она
- 24. Применение фосфора: спички Первые фосфорные спички – с головкой из белого фосфора – были созданы лишь
- 25. Применение фосфора: спички Зажигательная поверхность спичечного коробка покрыта смесью красного фосфора и порошка стекла. В состав
- 26. Применение фосфора Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная
- 27. Применение фосфора Интересны и другие применения ортофосфорной кислоты в промышленности. Например, было замечено, что пропитка древесины
- 28. Необходим ли фосфор человеку?
- 29. Значение фосфора Фосфор является основой скелета человека и зубов. Живые организмы не могут обходиться без фосфора.
- 30. Биологическая роль фосфора Суточная потребность для взрослого человека 1 грамм Входит в состав скелета Входит в
- 31. Реакция организма на недостаток и избыток фосфора Недостаток фосфора Развивается заболевание рахит, снижается умственная и мышечная
- 33. Скачать презентацию




























 Геохимия литосферы
Геохимия литосферы Диффузия вокруг нас
Диффузия вокруг нас Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Hydrochloric acid HCl
Hydrochloric acid HCl Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Волшебные кристалы
Волшебные кристалы Строение атома
Строение атома Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Металлы, их положение в ПСХЭ, физические и химические свойства
Металлы, их положение в ПСХЭ, физические и химические свойства Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ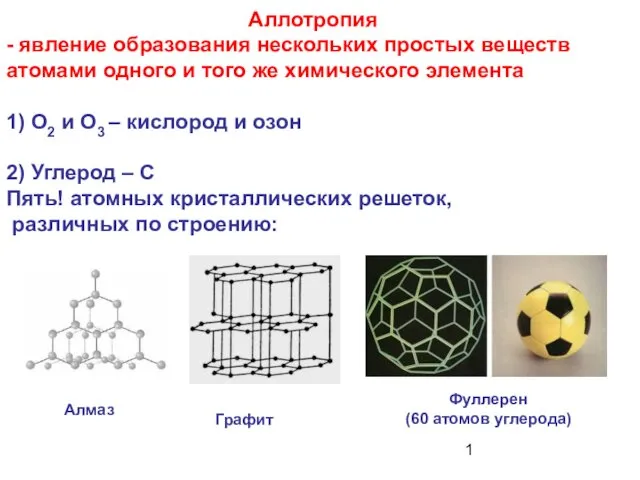 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Дистилляция в химической промышленности
Дистилляция в химической промышленности Растительные индикаторы
Растительные индикаторы Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Гетерофункциональные соединения
Гетерофункциональные соединения Фосфор и его соединения
Фосфор и его соединения Альдегиды и кетоны
Альдегиды и кетоны Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Непредельные углеводороды
Непредельные углеводороды Альтернативная бытовая химия
Альтернативная бытовая химия Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Металлы и Неметаллы
Металлы и Неметаллы Коллигативные свойства растворов
Коллигативные свойства растворов Лабораторная №5. Карбоновые кислоты
Лабораторная №5. Карбоновые кислоты Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии