Содержание
- 2. Мицеллярные растворы ПАВ как термодинамически устойчивые самоорганизованные системы
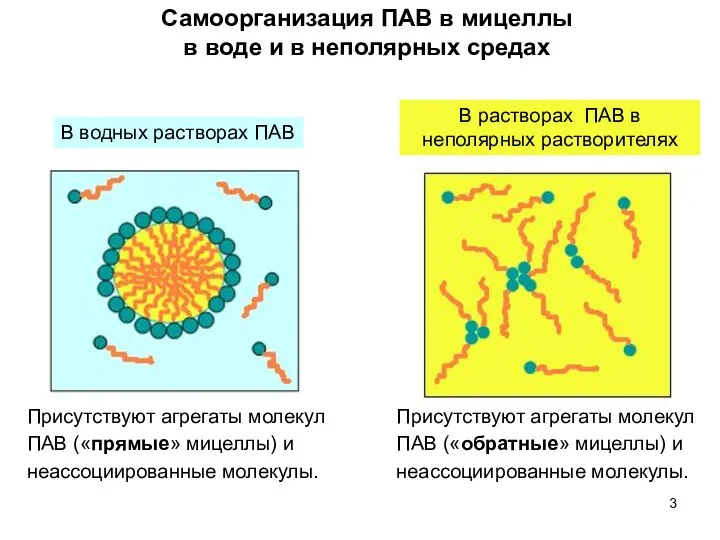
- 3. Самоорганизация ПАВ в мицеллы в воде и в неполярных средах В водных растворах ПАВ Присутствуют агрегаты
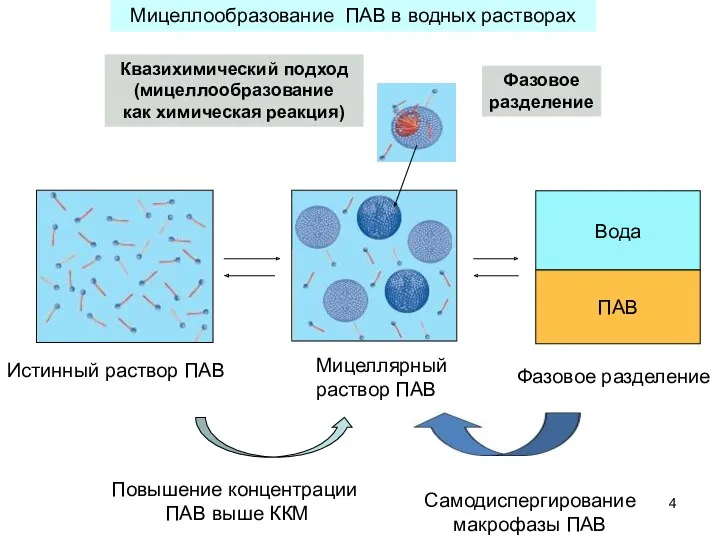
- 4. Вода ПАВ Истинный раствор ПАВ Мицеллярный раствор ПАВ Фазовое разделение Повышение концентрации ПАВ выше ККМ Самодиспергирование
- 5. Мицеллообразующие в водной среде ПАВ (ГЛБ ≥ 12−13) Углеводородная цепь (R) содержит от 8 до18 атомов
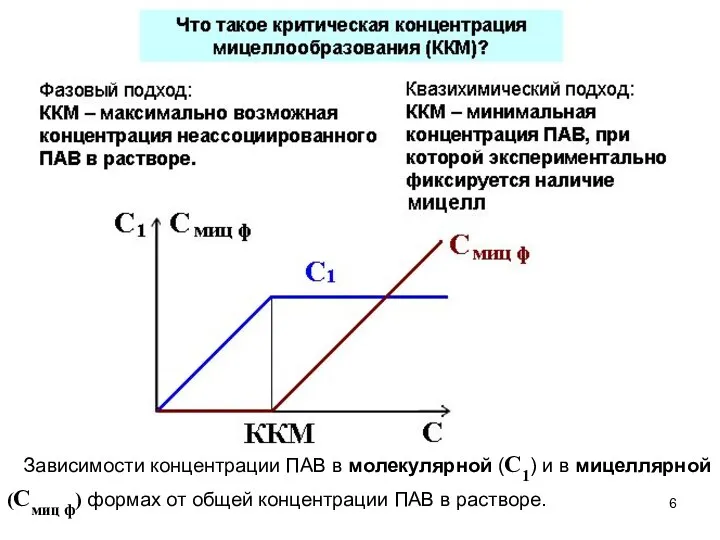
- 6. Зависимости концентрации ПАВ в молекулярной (С1) и в мицеллярной (Смиц ф) формах от общей концентрации ПАВ
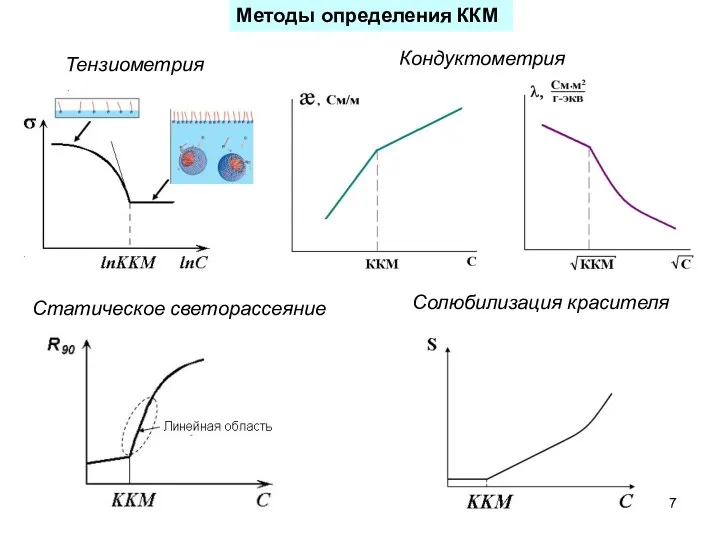
- 7. Методы определения ККМ Тензиометрия Кондуктометрия Статическое светорассеяние Солюбилизация красителя
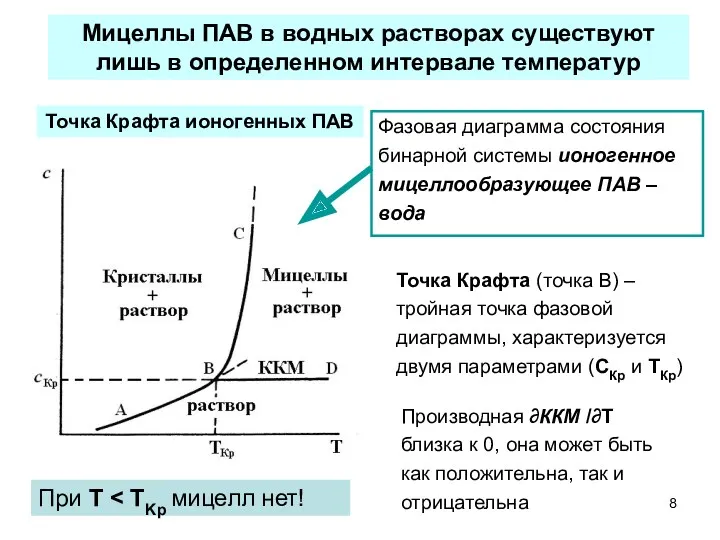
- 8. Производная ∂ККМ /∂T близка к 0, она может быть как положительна, так и отрицательна Мицеллы ПАВ
- 9. Для неионогенных полиоксиэтилированных ПАВ температурная область существования мицеллярных водных растворов ограничена сверху температурой помутнения (ТП), выше
- 10. Термодинамика мицеллообразования неионогенных ПАВ в водных растворах Рассмотрим мицеллообразование неионогенного ПАВ (НПАВ) с позиций квазихимического подхода,
- 11. В изобарно–изотермических условиях стандартная энергия Гиббса для данной реакции в расчете на 1 мицеллу: где k
- 12. Таким образом: где ККМ и KKMc – соответственно критическая концентрация мицеллообразования, выраженная в мольных долях и
- 13. Термодинамика мицеллообразования ионогенных ПАВ в водных растворах Как правило, мицеллообразующие ионогенные ПАВ являются 1:1 валентными электролитами.
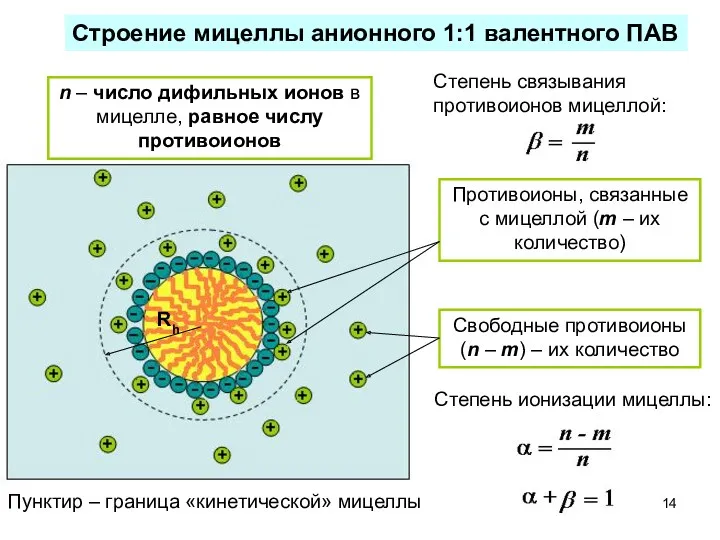
- 14. n – число дифильных ионов в мицелле, равное числу противоионов Строение мицеллы анионного 1:1 валентного ПАВ
- 15. В рамках квазихимического подхода образование «кинетической мицеллы» может быть выражено следующей обратимой химической реакцией: Константа равновесия
- 16. Стандартная энергия Гиббса в расчете на 1 мицеллу запишется: В расчете на 1 моль мицеллярного ПАВ:
- 17. Важно: Для оценки ΔG° необходимо определить ККМ и α (или β) Для широкого круга ионогенных ПАВ
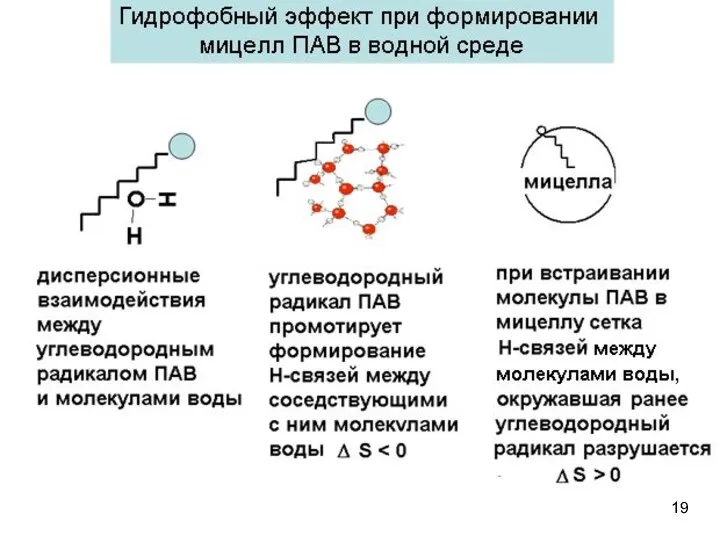
- 18. Причины самоорганизации ПАВ в мицеллы в водной среде Процесс самопроизвольный: Энтропийный характер процесса самоорганизации: Энтропия системы
- 19. 19
- 20. Факторы, влияющие на мицеллообразование ПАВ в водных растворах Длина гидрофобной части молекулы ПАВ Природа полярной группы:
- 23. Влияние длины цепи ионогенных ПАВ на ККМ Эксперимент: для 1-1 валентных ПАВ ККМ уменьшается примерно в
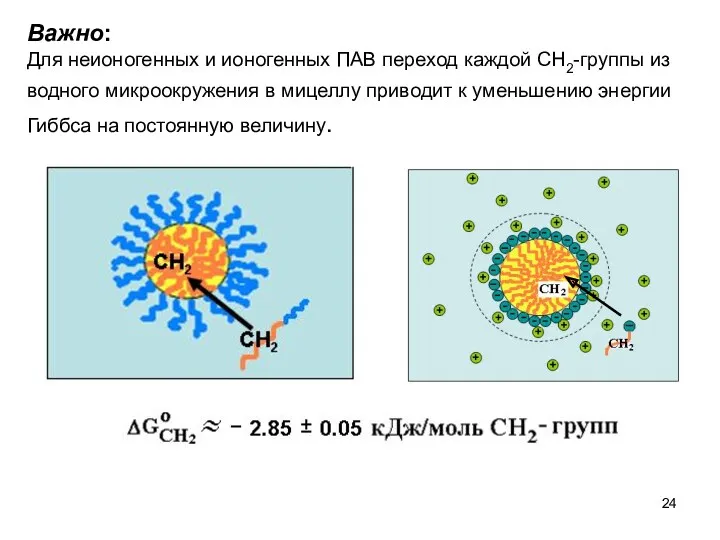
- 24. Важно: Для неионогенных и ионогенных ПАВ переход каждой СН2-группы из водного микроокружения в мицеллу приводит к
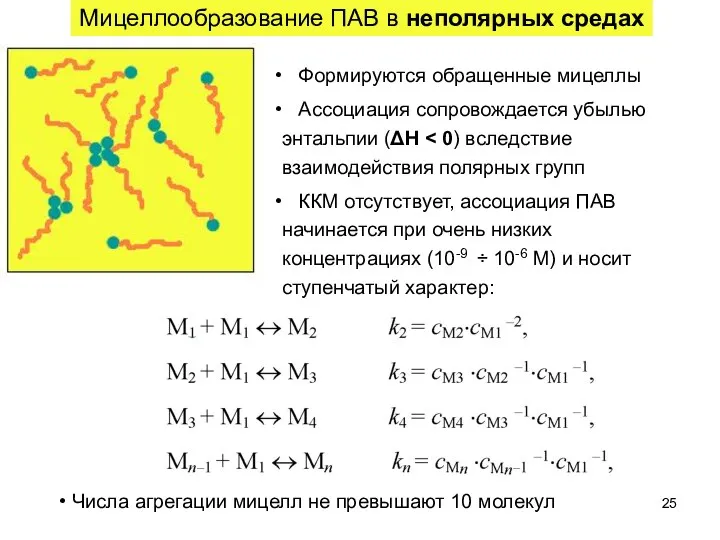
- 25. Мицеллообразование ПАВ в неполярных средах Формируются обращенные мицеллы Ассоциация сопровождается убылью энтальпии (ΔН ККМ отсутствует, ассоциация
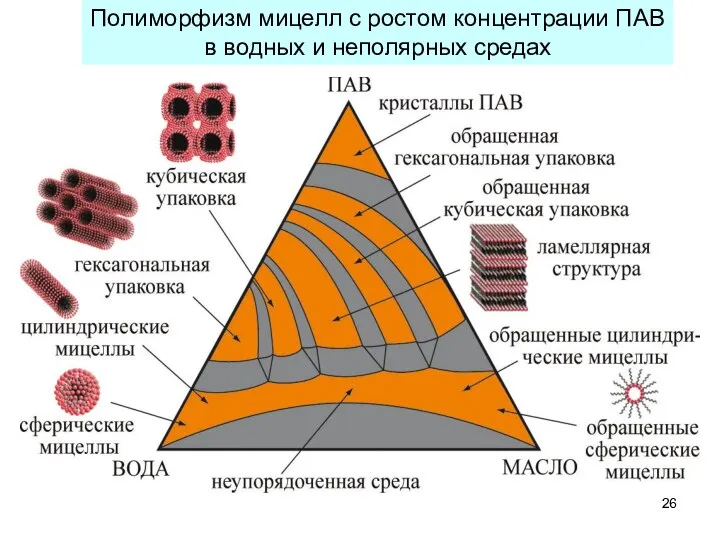
- 26. Полиморфизм мицелл с ростом концентрации ПАВ в водных и неполярных средах
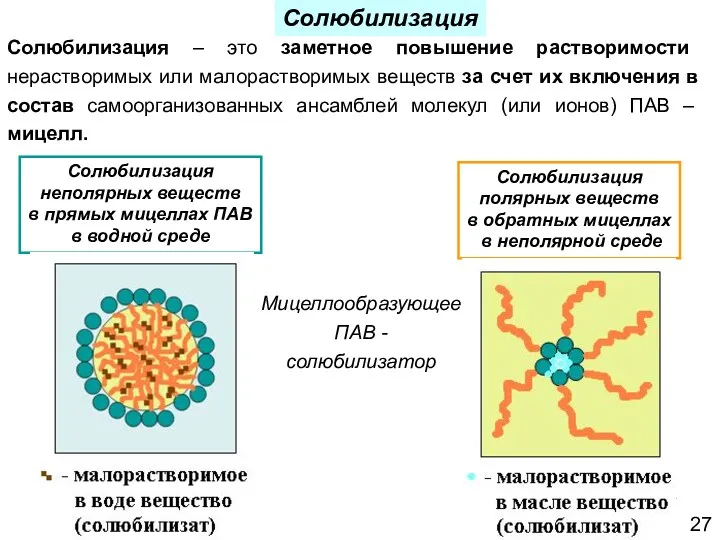
- 27. Солюбилизация – это заметное повышение растворимости нерастворимых или малорастворимых веществ за счет их включения в состав
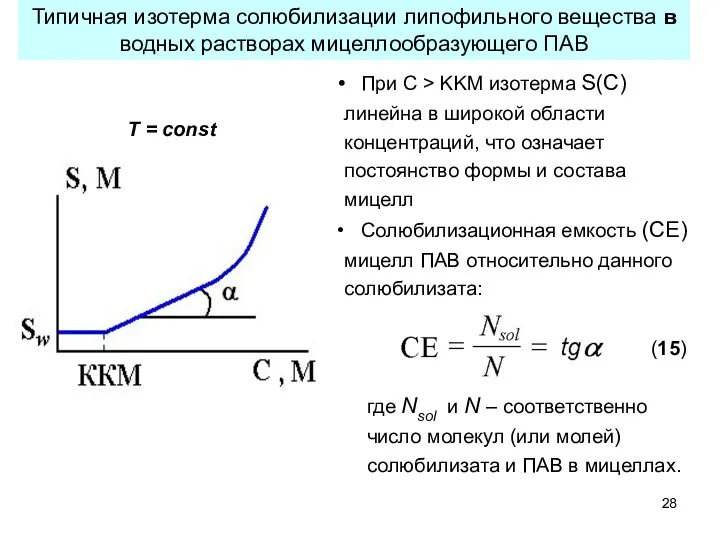
- 28. Типичная изотерма солюбилизации липофильного вещества в водных растворах мицеллообразующего ПАВ Т = const При С >
- 29. Используется «фазовый» подход: мицеллы рассматриваются как высокодисперсная фаза (т.е. как «псевдофаза») Стандартной энергия Гиббса солюбилизации: Термодинамика
- 30. Мольная доля солюбилизата в мицелле: В домицеллярной области растворимость солюбилизата слабо зависит от концентрации ПАВ и
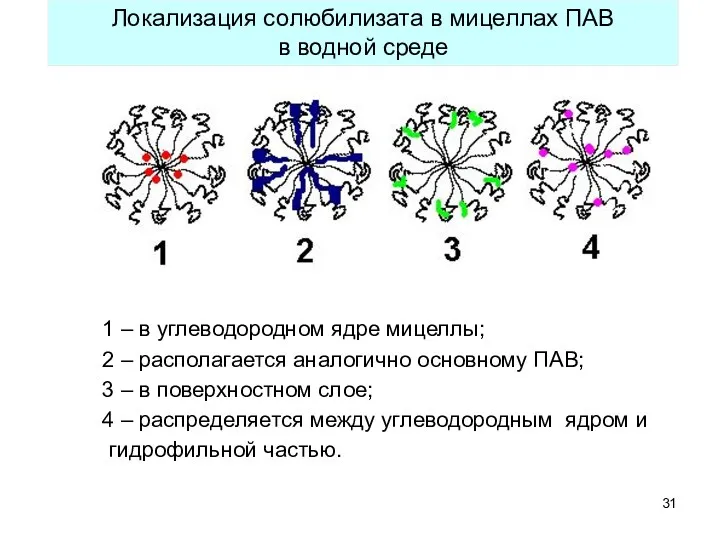
- 31. 1 – в углеводородном ядре мицеллы; 2 – располагается аналогично основному ПАВ; 3 – в поверхностном
- 32. Важно: солюбилизация в водных растворах ПАВ в основном имеет энтропийный характер, обусловленный гидрофобным эффектом. В ряде
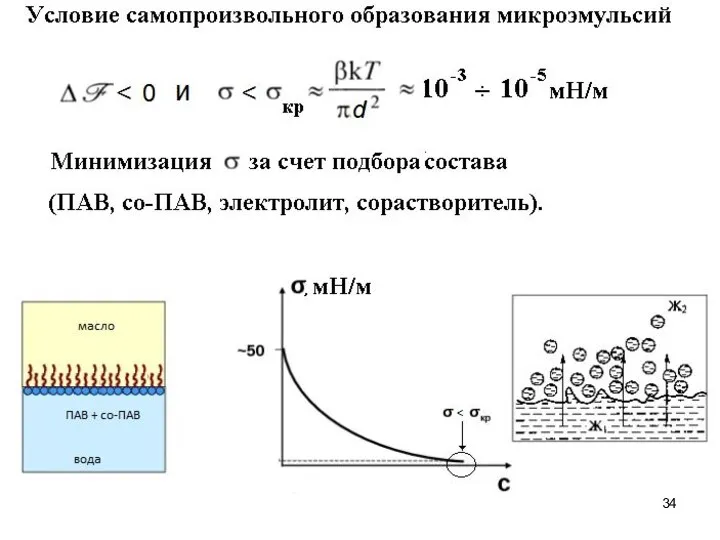
- 33. Микроэмульсии – термодинамически устойчивые оптически прозрачные (или слегка опалесцирующие) многокомпонентные дисперсные системы на основе жидкостей с
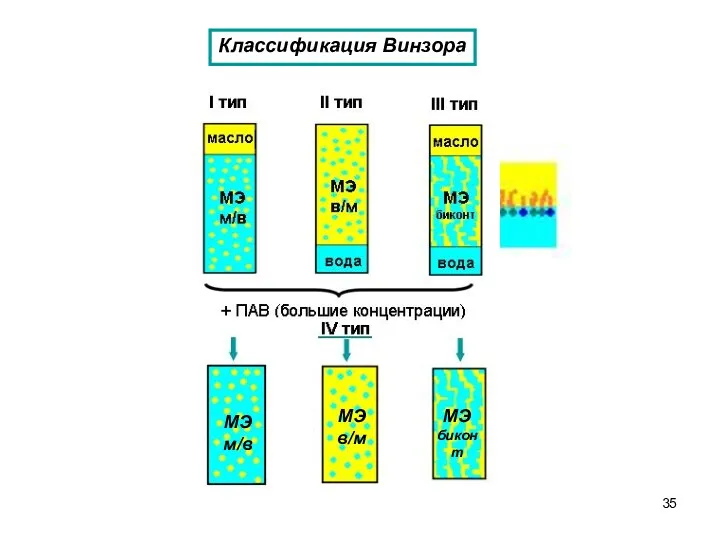
- 35. Классификация Винзора
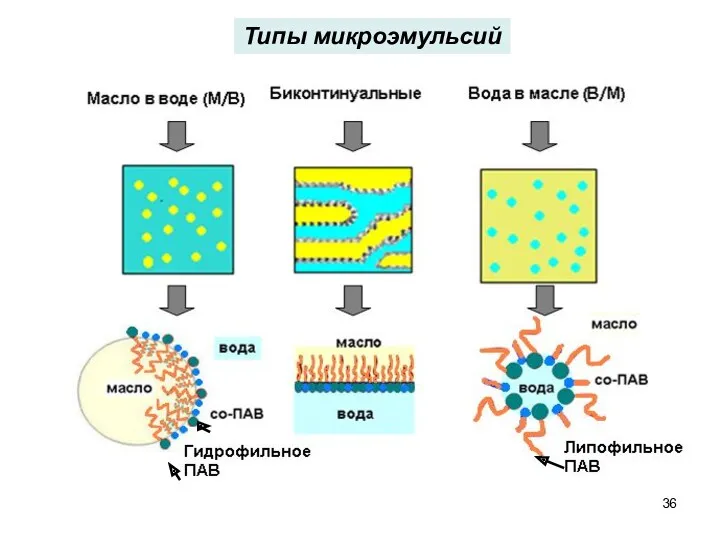
- 36. Типы микроэмульсий
- 37. Структура микроэмульсий и размер частиц Просвечивающая электронная микроскопия Капельный тип МЭ Биконтинуальный тип МЭ Сканирующая электронная
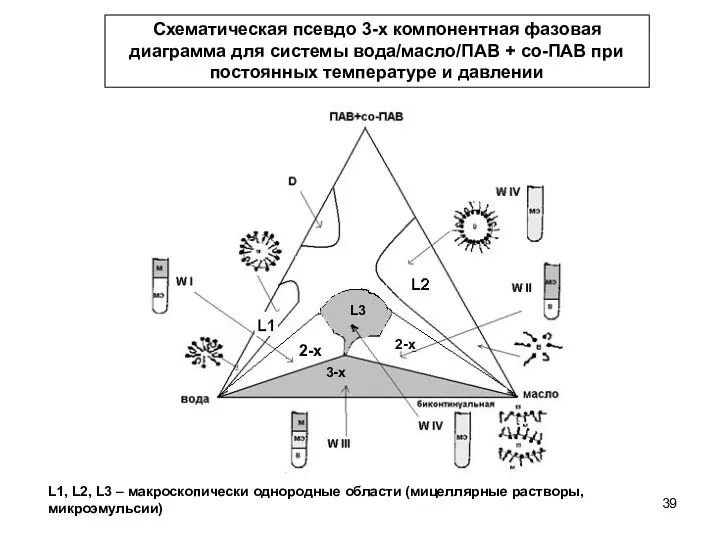
- 38. Фазовое состояние микроэмульсионных систем В основе описания фазового состояния – равносторонний треугольник, каждая вершина которого соответствует
- 39. L1, L2, L3 – макроскопически однородные области (мицеллярные растворы, микроэмульсии) Схематическая псевдо 3-х компонентная фазовая диаграмма
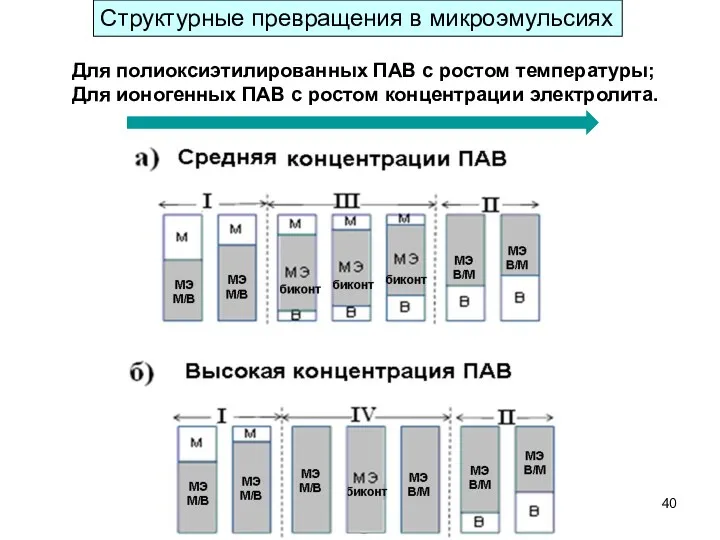
- 40. Структурные превращения в микроэмульсиях Для полиоксиэтилированных ПАВ с ростом температуры; Для ионогенных ПАВ с ростом концентрации
- 41. Рекомендованная литература: Практикум по коллоидной химии: Учебное пособие для вузов / Под ред. В.Г. Куличихина. −
- 43. Скачать презентацию






















 Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений
Особенности строения, реакционной способности и методы синтеза азотсодержащих соединений Строение атома. Теории строения атома
Строение атома. Теории строения атома Элементы подгруппы углерода
Элементы подгруппы углерода Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Камни и минералы
Камни и минералы Предельные углеводороды
Предельные углеводороды Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Методы разделения и концентрирования. Хроматографические методы
Методы разделения и концентрирования. Хроматографические методы 20231116_tipy_himicheskih_reaktsiy
20231116_tipy_himicheskih_reaktsiy Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів
Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів Окисно-відновні реакції. Гальванічні елементи
Окисно-відновні реакції. Гальванічні елементи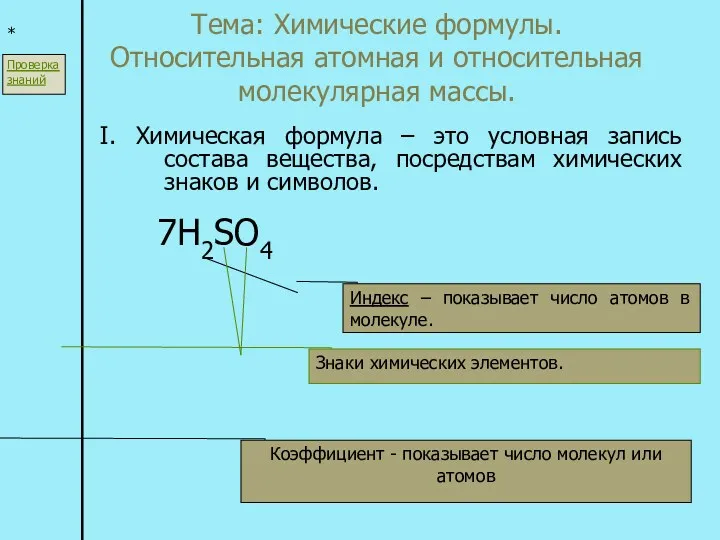 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Водород - топливо будущего
Водород - топливо будущего Углеводороды: предельные и непредельные
Углеводороды: предельные и непредельные Как трудно быть особенной…
Как трудно быть особенной… Alkynes
Alkynes Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3)
Основные положения теории растворов электролитов, используемых в аналитической химии. (Лекция 3) Пластмаси та полімери
Пластмаси та полімери Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Общая и медицинская химия
Общая и медицинская химия Дисперсные системы
Дисперсные системы Получение кислот
Получение кислот Нуклеиновые кислоты. Нуклеотиды
Нуклеиновые кислоты. Нуклеотиды Органическая химия. Пособие
Органическая химия. Пособие Металлы. Свойства металлов
Металлы. Свойства металлов