Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів презентация
- Главная
- Химия
- Збуджений стан атома. Валентні стани елементів. Можливі ступені окиснення неметалічних елементів 2-го і 3-го періодів

Содержание
Слайд 2
Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б)
Скільки електронів може максимально перебувати на: а) одній атомній орбіталі; б)
s-підрівні; в) р-підрівні; г) d-підрівні?
Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі. Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці.
Що називають «неспареним електроном», «електронною парою»?
Чому перший енергетичний рівень заповнюється раніше за другий?
Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
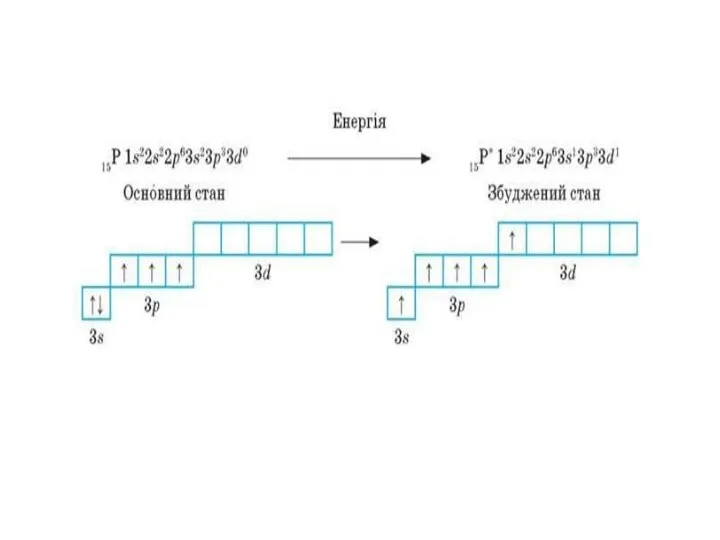
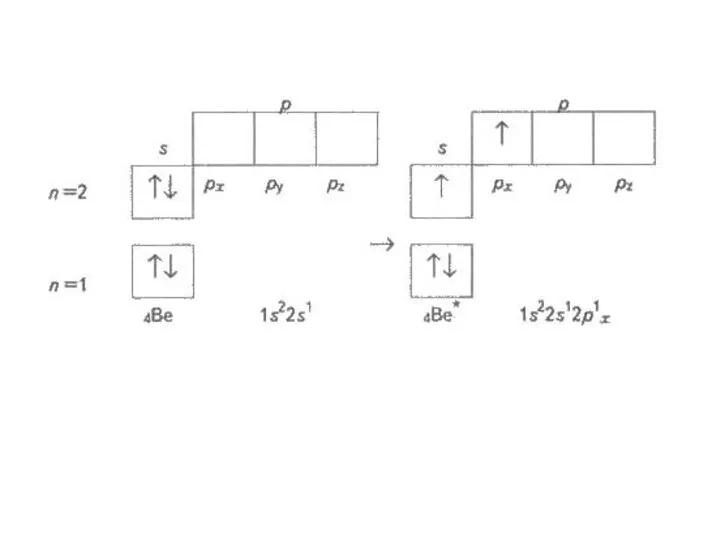
Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі?
Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б) Кальцію; в) Брому?
Дайте визначення принципу найменшої енергії, правила Хунда, принципу Паулі. Схарактеризуйте їхнє значення для визначення розподілу електронів в електронній оболонці.
Що називають «неспареним електроном», «електронною парою»?
Чому перший енергетичний рівень заповнюється раніше за другий?
Наведіть порядок заповнення електронами підрівнів для перших чотирьох енергетичних рівнів.
Чому в атомах Берилію електрони другого енергетичного рівня перебувають на s-орбіталі, а не на р-орбіталі?
Скільки енергетичних рівнів зайнято електронами в атомах: а) Натрію; б) Кальцію; в) Брому?
Слайд 3
Пригадаємо, що таке:
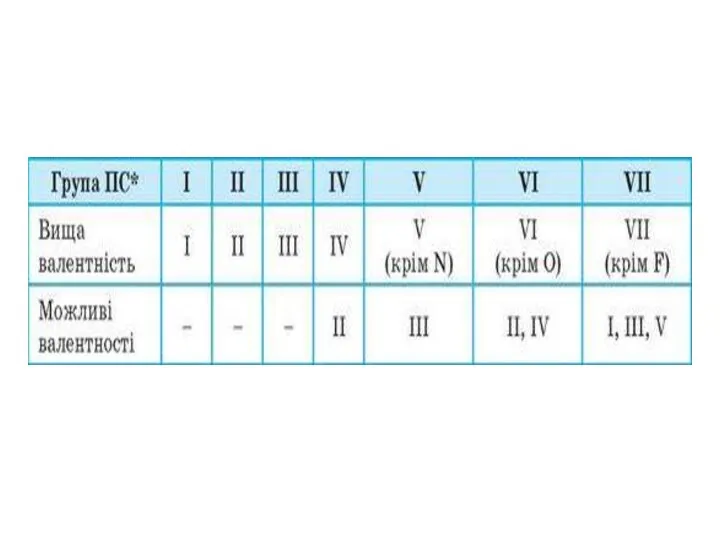
Валентність –
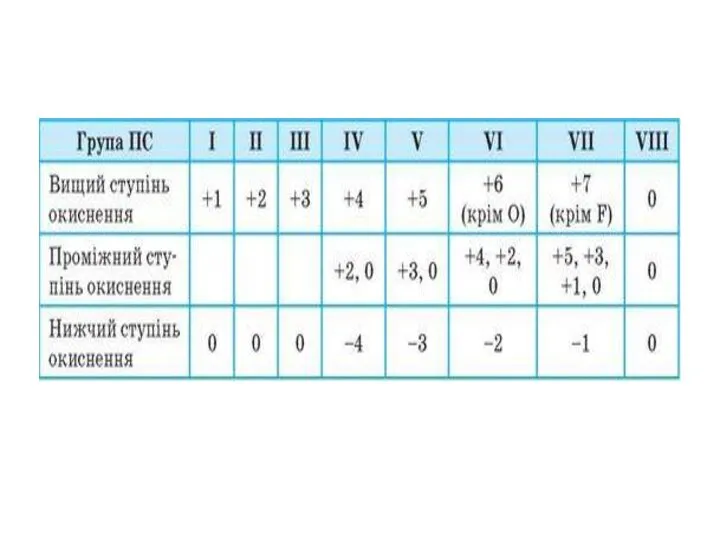
Ступінь окиснення –
Електронегативність -
Пригадаємо, що таке:
Валентність –
Ступінь окиснення –
Електронегативність -
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Слайд 8
Слайд 9
Слайд 10
Слайд 11
Слайд 12
Слайд 13
Слайд 14
Слайд 15
Слайд 16
Слайд 17
Слайд 18
Слайд 19
Слайд 20
Слайд 21
Слайд 22
Слайд 23
Слайд 24
Слайд 25
Слайд 26
Слайд 27
Слайд 28
Слайд 29
Слайд 30
Слайд 31
Слайд 32
Слайд 33
Слайд 34


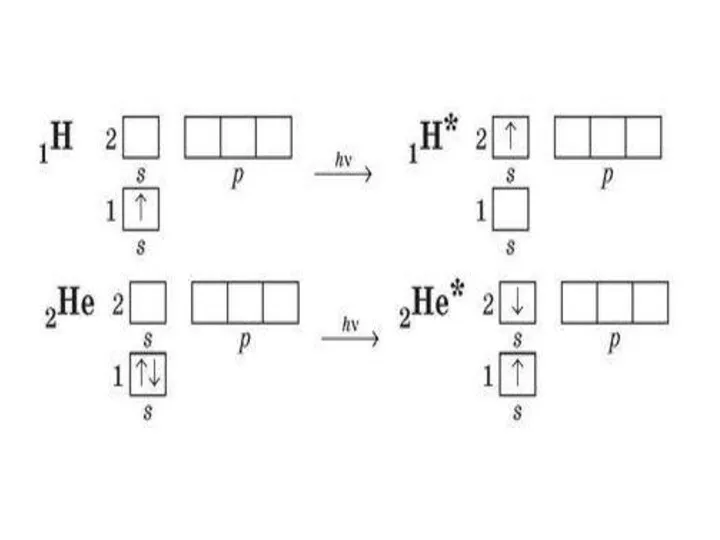
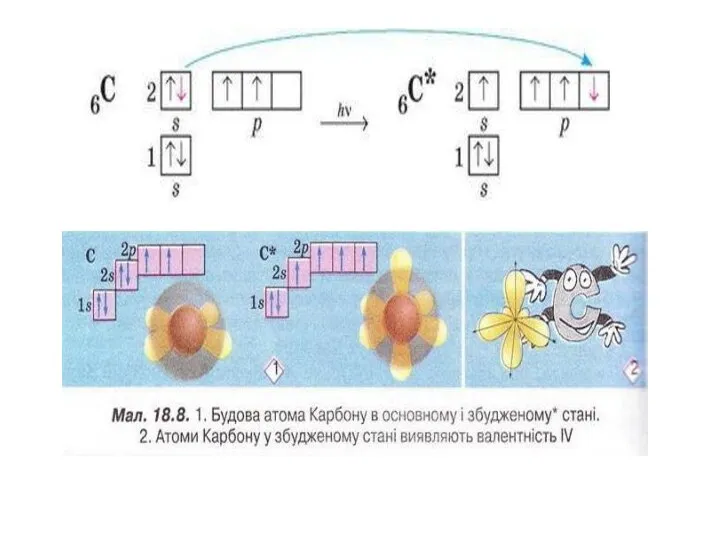
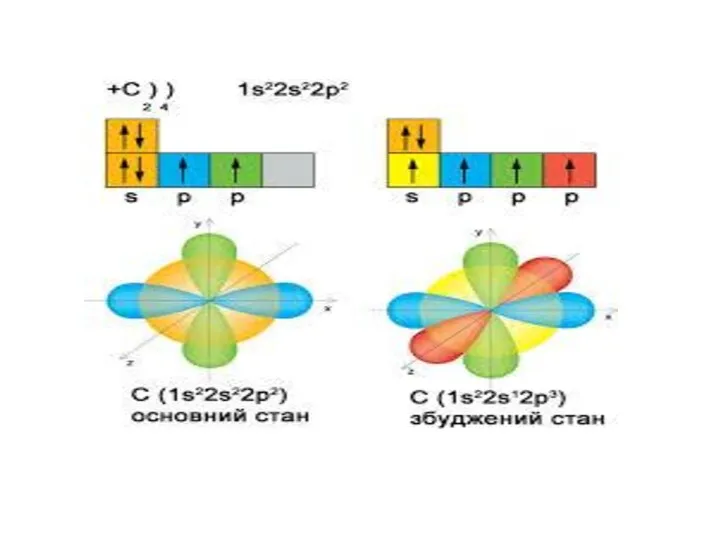
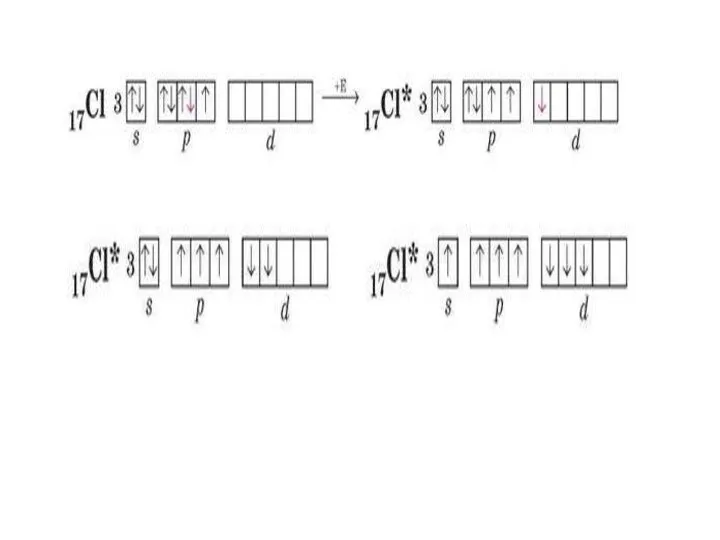























 Строение и электрический заряд коллоидных частиц. Электрокинетические явления
Строение и электрический заряд коллоидных частиц. Электрокинетические явления Физические и химические свойства аренов
Физические и химические свойства аренов Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Благородные металлы
Благородные металлы Применение жиров
Применение жиров Взаємодія води з кислотними оксидами
Взаємодія води з кислотними оксидами Основні класи неорганічних сполук
Основні класи неорганічних сполук Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива
Топливо. Виды топлива. Химический состав топлива. Основные характеристики топлива. Марки топлива Титанның химиялық элементі
Титанның химиялық элементі Свойства кислот
Свойства кислот Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Аминокилоты. Свойства
Аминокилоты. Свойства Электролитическая диссоциация. Положительно-заряженный электрод
Электролитическая диссоциация. Положительно-заряженный электрод Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Металлы. Особенности строения. Классификация, физические и химические свойства
Металлы. Особенности строения. Классификация, физические и химические свойства Хімія у побуті
Хімія у побуті Химия воды
Химия воды Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Теория строения органических соединений
Теория строения органических соединений Железо и его сплавы
Железо и его сплавы Хімічні властивості кислот
Хімічні властивості кислот Ароматические кислоты и их соли
Ароматические кислоты и их соли Химия в повседневной жизни человека
Химия в повседневной жизни человека Периодический закон и строение атома
Периодический закон и строение атома Строение атома
Строение атома Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания
Изменение агрегатного состояния вещества. Двигатели внутреннего сгорания Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс
Химические свойства основных неорганических соединений в свете ЭД и ОВР. 9 класс