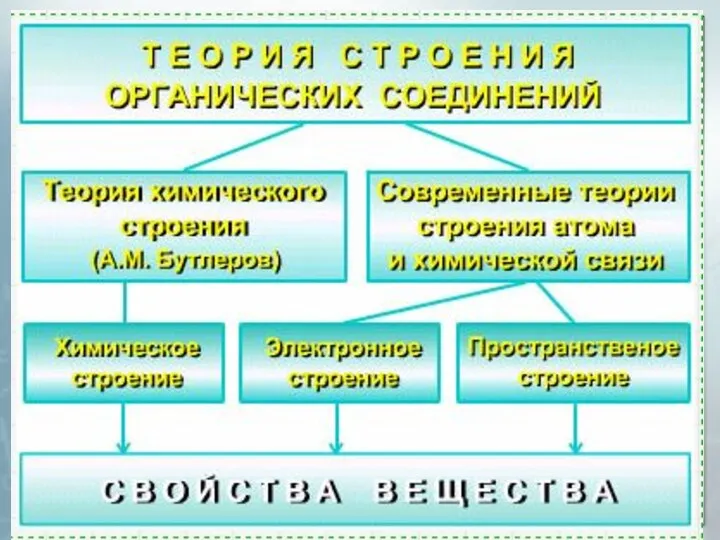
Слайд 2
Слайд 3
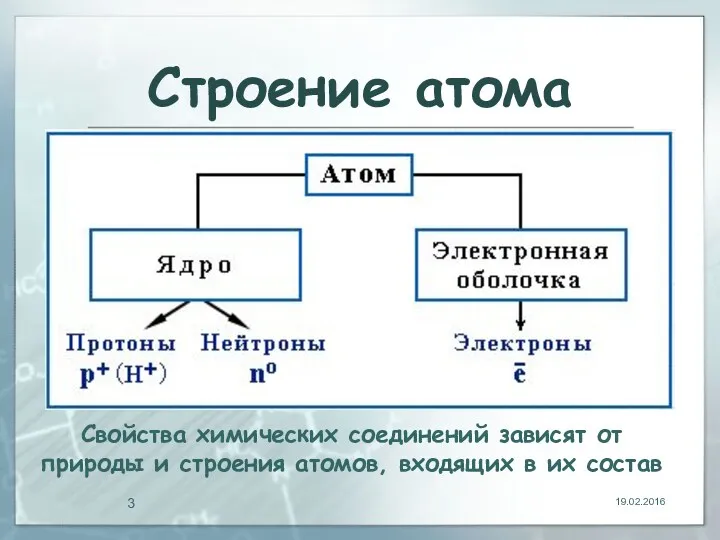
Строение атома
19.02.2016
Свойства химических соединений зависят от природы и строения атомов, входящих
в их состав
Слайд 4

Свойства электрона
19.02.2016
Часть пространства, в котором вероятность нахождения максимальна, называют орбиталью или
электронным облаком
Слайд 5

19.02.2016
Атомная орбиталь (АО) – область наиболее вероятного пребывания электрона в электрическом
поле ядра атома
Слайд 6

Форма и энергия АО
19.02.2016
Первый уровень – 1s,
второй – 2s
Слайд 7

Форма и энергия АО
19.02.2016
Второй уровень – 2s, 2px,2py, 2pz
Слайд 8

Заполнение атомных орбиталей электронами
Принцип устойчивости.
АО заполняются электронами в порядке повышения
их энергетических уровней:
1s < 2s < 2p < 3s < 3p < 4s < 3d …
Слайд 9

Принцип устойчивости
19.02.2016
Слайд 10

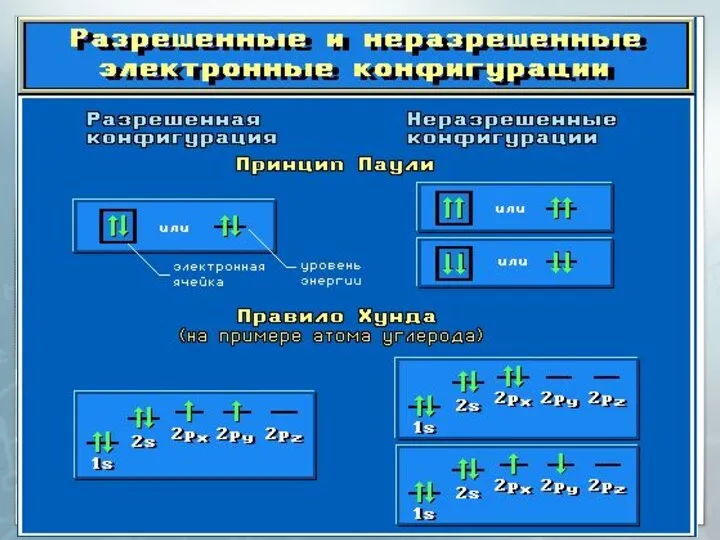
Заполнение атомных орбиталей электронами
Принцип Паули.
На одной АО могут находиться не
более двух электронов с противоположными спинами.
Слайд 11

Заполнение атомных орбиталей электронами
Правило Хунда.
На АО с одинаковой энергией, так
называемых вырожденных орбиталях, электроны стремятся расположиться по одному с параллельными спинами.
Слайд 12
Слайд 13

Контрольная работа
19.02.2016
Слайд 14
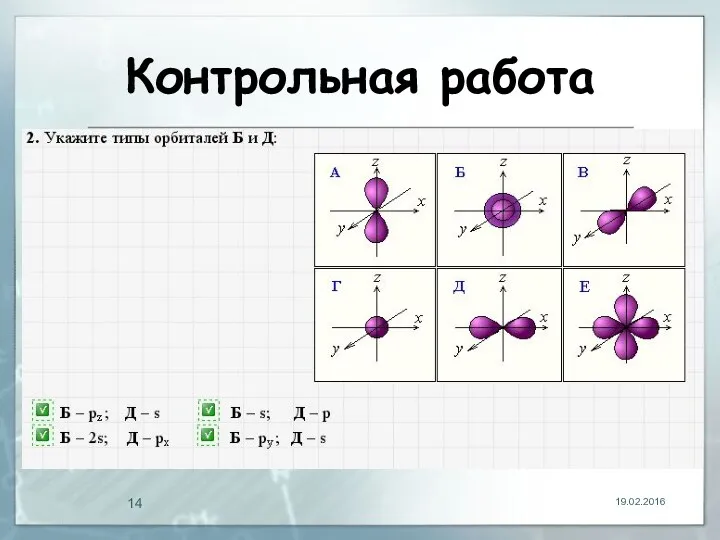
Контрольная работа
19.02.2016
Слайд 15
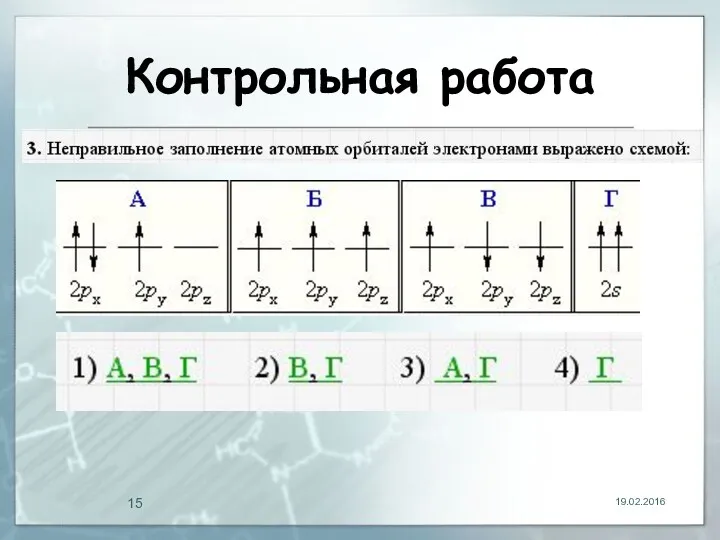
Контрольная работа
19.02.2016
Слайд 16
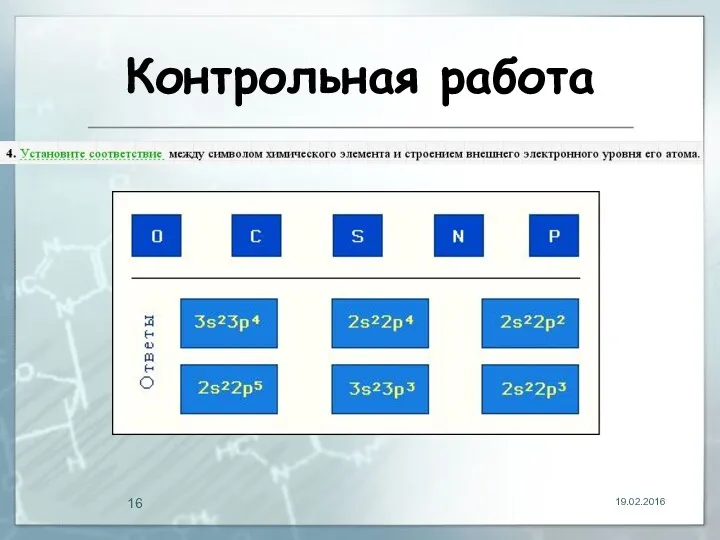
Контрольная работа
19.02.2016
Слайд 17

Контрольная работа
19.02.2016
Слайд 18
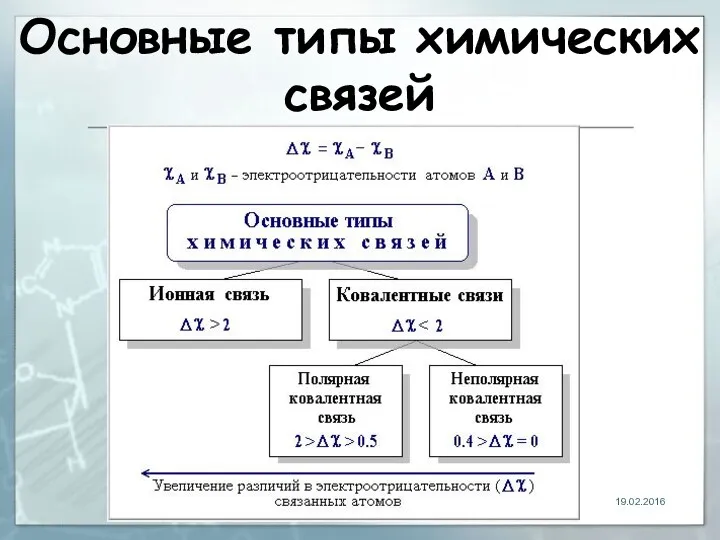
Основные типы химических связей
19.02.2016
Слайд 19

19.02.2016
Ионная связь
химическая связь, основанная на электростатическом притяжении ионов
В органических соединениях
встречается редко, например, в органических солях: RCOO-Na+
Слайд 20

19.02.2016
Электроотрицательность
Способность атома удерживать внешние валентные электроны
Подчиняется периодическому закону: растет слева
направо в периодах и снизу вверх в главных подгруппах в таблице Д.И. Менделеева
Слайд 21

Ковалентная связь
19.02.2016
Связь, образованная путём обобществления пары электронов связываемых атомов
Слайд 22

19.02.2016
Свойства ковалентной связи
Направленность
Насыщаемость
Полярность
Поляризуемость
Слайд 23

Направленность
19.02.2016
Молекулярное строение органических молекул имеет геометрическую форму.
Количественной мерой направленности является угол
между двумя связями (валентный угол)
Слайд 24

Насыщаемость
19.02.2016
Способность атомов образовывать ограниченное число ковалентных связей.
Количество связей определяется числом
внешних атомных орбиталей атома.
Слайд 25

Полярность
19.02.2016
Обусловлена неравномерным распределением электронной плотности вследствии различной электро-отрицательности атомов по
шкале Л.Полинга:
Слайд 26

Полярность
19.02.2016
Ковалентные связи делятся на полярные и неполярные.
Неполярные связи между
двумя одинаковыми атомами:
Н—Н, С—С.
Слайд 27

Полярность
19.02.2016
Полярные связи между двумя атомами с разной электроотрицательностью:
Н—F, С—Сl.
Слайд 28

Поляризуемость
19.02.2016
Смещение электронов под воздействием внешнего электрического поля другой частицы.
Слайд 29

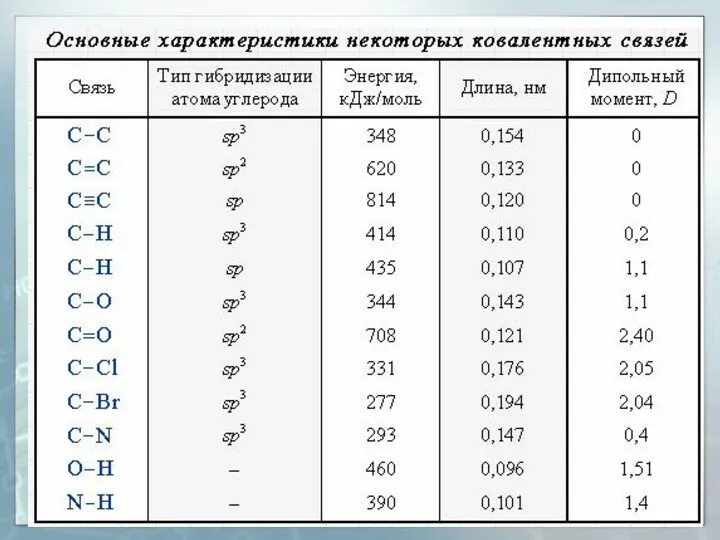
Длина связи
19.02.2016
Расстояние между центрами двух связанных атомов.
На характеристики связей влияет
их кратность
Слайд 30

Энергия связи
19.02.2016
Энергия, выделяемая при образовании связи или необходимая для разъединения
двух связанных атомов
Слайд 31

Дипольный момент (μ или D)
19.02.2016
Величина, характеризующая полярность связи:
l – длина
связи
q – эффективный заряд
Слайд 32
Слайд 33

Контрольная работа
19.02.2016
Слайд 34

Контрольная работа
19.02.2016
Слайд 35

Контрольная работа
19.02.2016
Слайд 36

Контрольная работа
19.02.2016
Слайд 37

Контрольная работа
19.02.2016




































 Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ III А – топтың элементтері
III А – топтың элементтері Удивительные свойства воды
Удивительные свойства воды Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Кристаллизация. Структура жидких металлов
Кристаллизация. Структура жидких металлов Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химиялық элемент оттегі
Химиялық элемент оттегі Теплота горения
Теплота горения Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Некоторые d-элементы
Некоторые d-элементы Пенообразование в растворах поверхностно-активных веществ. Лекция 13
Пенообразование в растворах поверхностно-активных веществ. Лекция 13 Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические свойства солей
Химические свойства солей Хімічні явища, їх ознаки
Хімічні явища, їх ознаки Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Алюминий. Определите элемент
Алюминий. Определите элемент 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft 20231028_kislorod
20231028_kislorod Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов