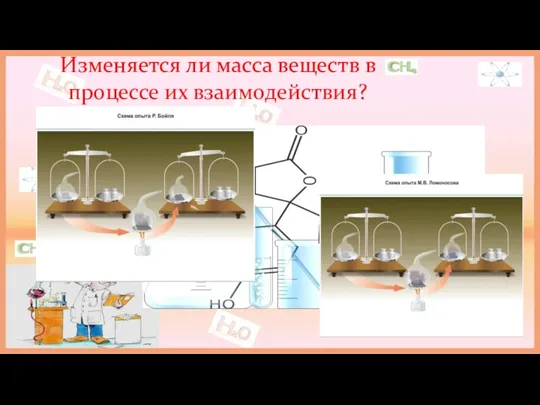
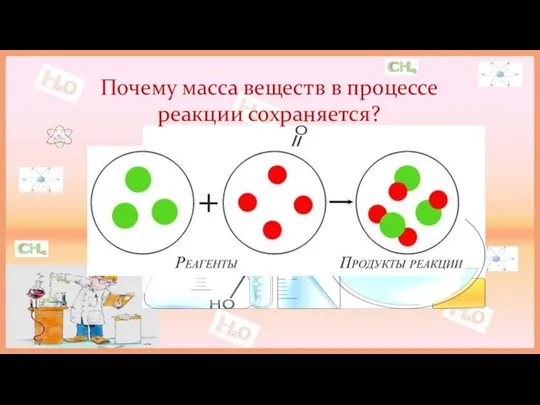
В 1748 году М.В.Ломоносов сформулировал закон сохранения массы веществ.
В 1756 году
Ломоносову удалось проверить опытным путём теоретически открытый закон сохранения массы вещества при химических реакциях.
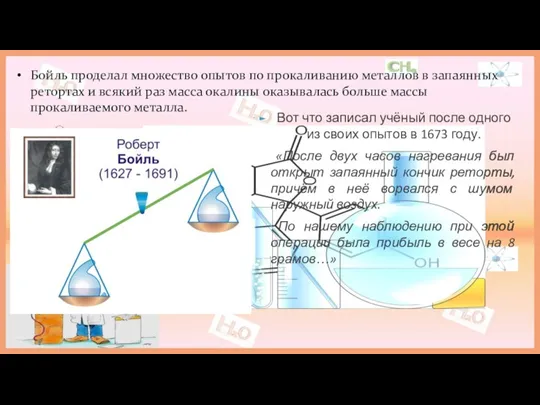
Подобно Бойлю русский учёный делал опыт в запаянных ретортах. Но, в отличие от Бойля, Ломоносов взвешивал сосуды как до, так и после прокаливания не вскрывая.
«Все перемены в натуре случающиеся такого суть состояния, что сколько чего у одного тела отнимется, столько же присовокупится к другому. Так, ежели где убудет материи, то умножится в другом месте; сколько часов положит кто на бдение, столько же сну отнимет...»








 Кристаллическое строение и кристаллизация металлов
Кристаллическое строение и кристаллизация металлов Бережём планету вместе. Нефть
Бережём планету вместе. Нефть Органіка. Органічні речовини
Органіка. Органічні речовини Благородные газы
Благородные газы Растворы и свойства растворов. Лекция 3
Растворы и свойства растворов. Лекция 3 Типы химических реакций
Типы химических реакций Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Новинки СН старт: июль 2016 Профессиональная химия PRO service
Новинки СН старт: июль 2016 Профессиональная химия PRO service Вклад М.В. Ломоносова в развитие науки химия
Вклад М.В. Ломоносова в развитие науки химия Сложные углеводы. Олигосахариды и полисахариды
Сложные углеводы. Олигосахариды и полисахариды Состояние атмосферного воздуха в Ярославской области
Состояние атмосферного воздуха в Ярославской области Драгоценные камни
Драгоценные камни Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі
CaSO4 кристаллының ас жазықтығына проекциясының құрылымдық моделі Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Осадительное титрование. (Лекция 27)
Осадительное титрование. (Лекция 27) Объёмная доля компонента смеси
Объёмная доля компонента смеси Роль воды в химических реакциях
Роль воды в химических реакциях Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Предмет и задачи химии. Вещества и их свойства. (Продолжение)
Предмет и задачи химии. Вещества и их свойства. (Продолжение) Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Показатели жесткости воды
Показатели жесткости воды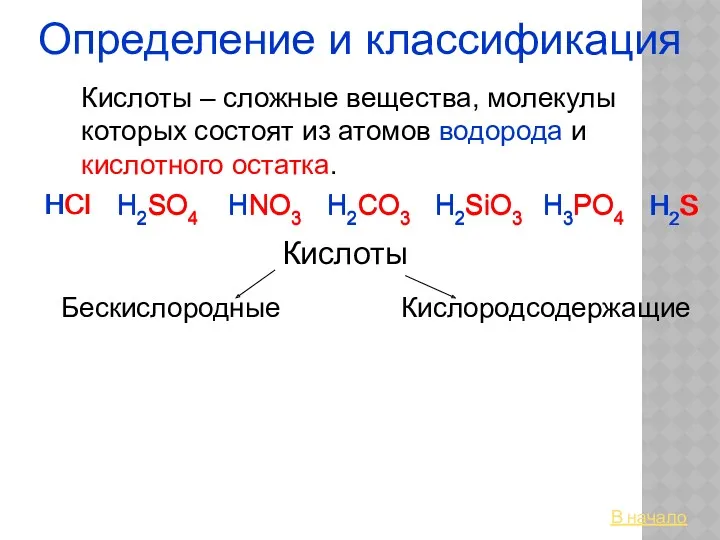 Кислоты. Определение и классификация
Кислоты. Определение и классификация Приёмы обращения с лабораторным оборудованием
Приёмы обращения с лабораторным оборудованием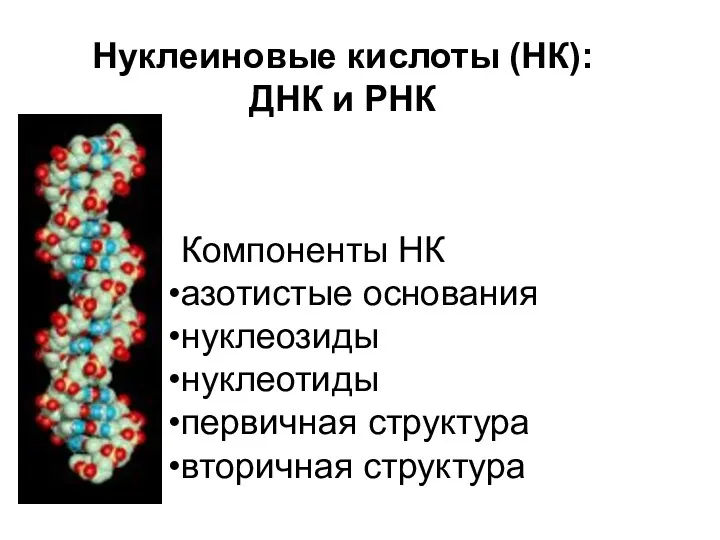 Нуклеиновые кислоты
Нуклеиновые кислоты Радиохимия
Радиохимия Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие