Слайд 2
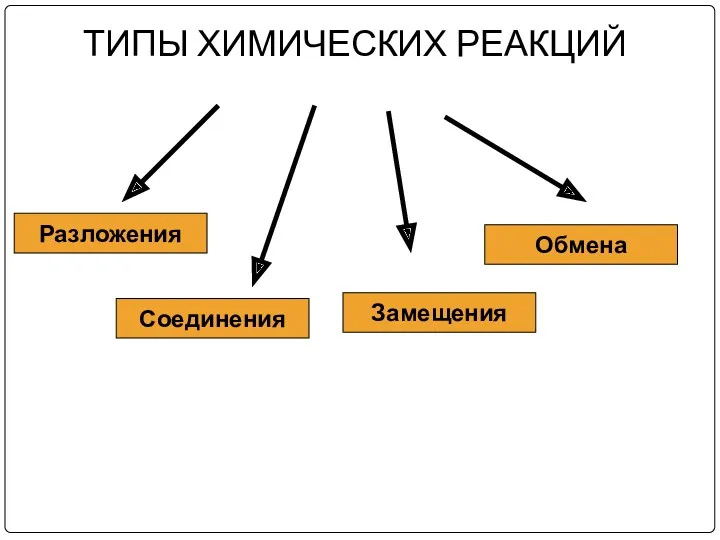
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Соединения
Разложения
Замещения
Обмена
Слайд 3

Реакция разложения малахита:
(CuOH)2CO3 = 2CuO + H2O + CO2
Малахит оксид вода
оксид
меди (II) углерода (IV)
Слайд 4
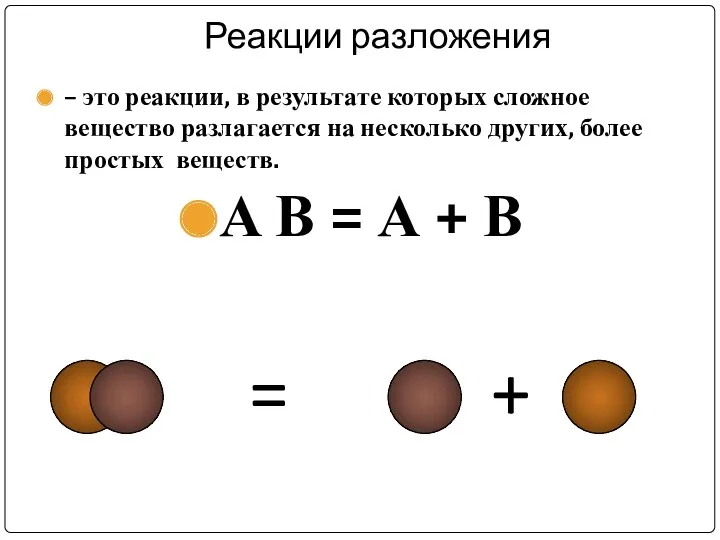
Реакции разложения
– это реакции, в результате которых сложное вещество разлагается
на несколько других, более простых веществ.
А В = А + В
Слайд 5

Признаки реакции разложения
В реакции принимает участие только одно исходное сложное вещество
2.
Образуется два и более новых как простых, так и сложных веществ
3. Как правило почти все реакции разложения будут эндотермические (- Q) (нужна непрерывная подача тепла)
Слайд 6

Реакция соединения
Cu + Cl2 = CuCl2
2Fe + 3Cl2 = 2Fe Cl3
Слайд 7
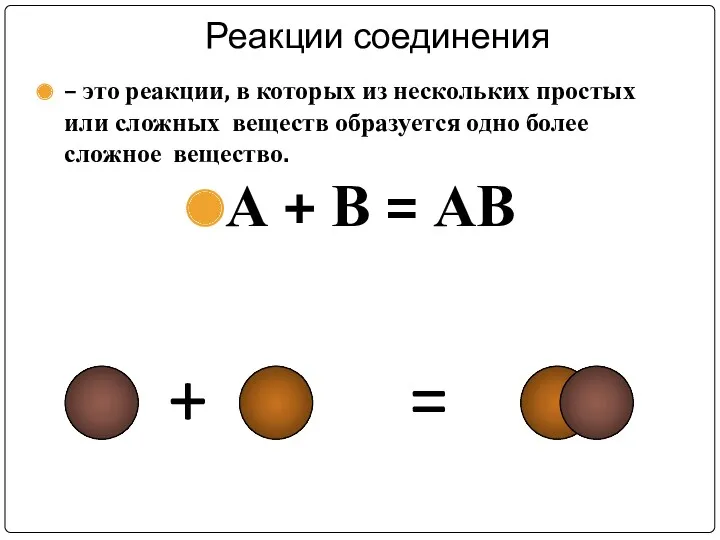
Реакции соединения
– это реакции, в которых из нескольких простых или
сложных веществ образуется одно более сложное вещество.
А + В = АВ
Слайд 8

Признаки реакции соединения
1. В реакции участвуют два или более как простых,
так и сложных веществ
2. Образуется одно сложное вещество
3. Как правило почти все реакции соединения будут экзотермические (+ Q)
Слайд 9
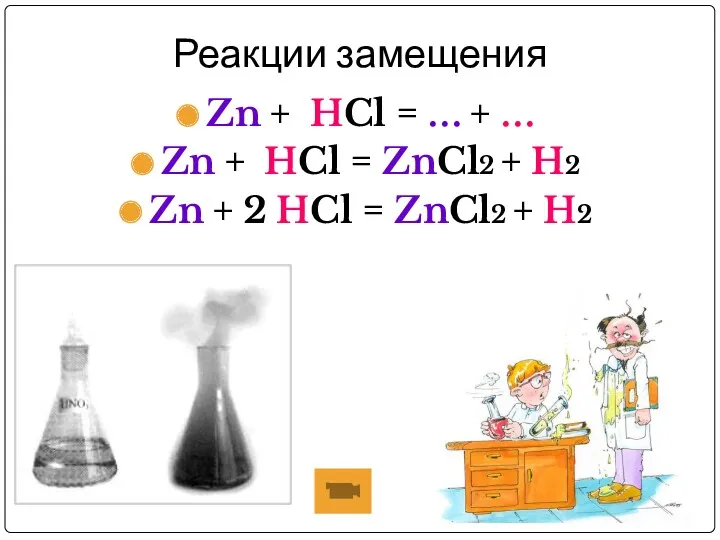
Реакции замещения
Zn + HCl = … + …
Zn + HCl
= ZnCl2 + H2
Zn + 2 HCl = ZnCl2 + H2
Слайд 10
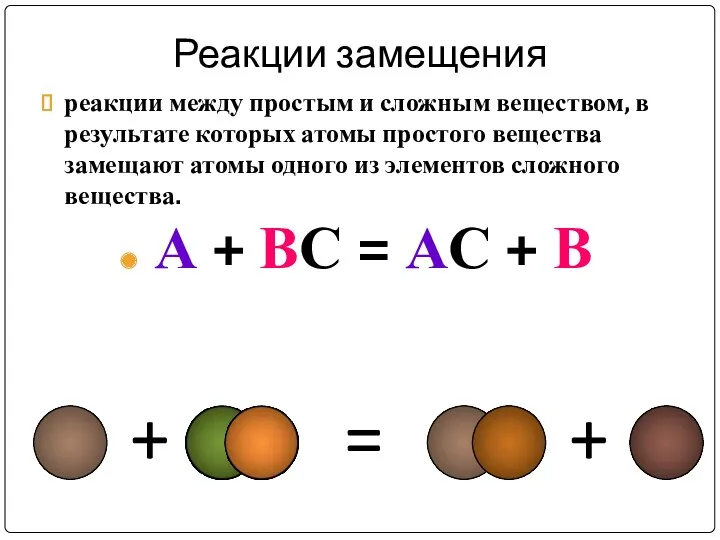
Реакции замещения
реакции между простым и сложным веществом, в результате которых
атомы простого вещества замещают атомы одного из элементов сложного вещества.
А + ВС = АС + В
Слайд 11

Реакции обмена
CuO + H2SO4 = CuSO4 + H2O
Слайд 12
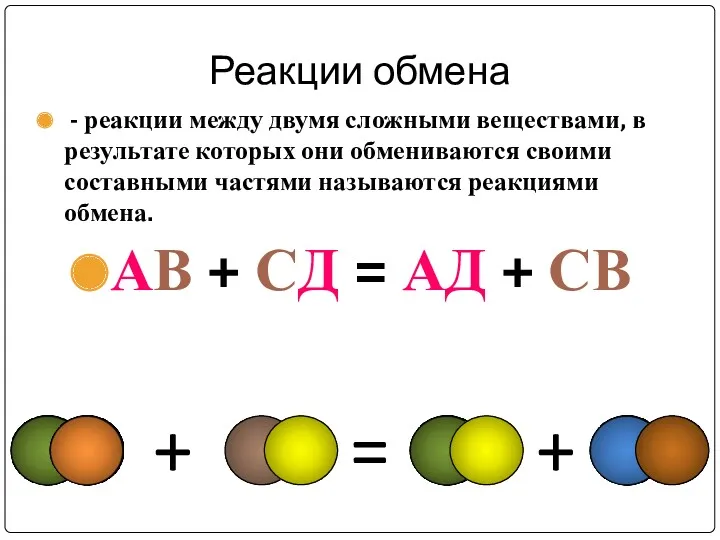
Реакции обмена
- реакции между двумя сложными веществами, в результате которых
они обмениваются своими составными частями называются реакциями обмена.
АВ + СД = АД + СВ
Слайд 13
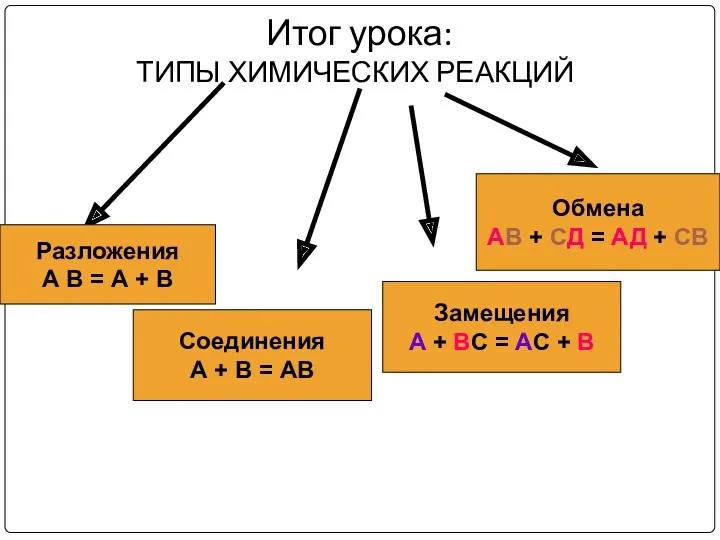
Итог урока:
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Соединения
А + В = АВ
Разложения
А В =
А + В
Замещения
А + ВС = АС + В
Обмена
АВ + СД = АД + СВ
Слайд 14
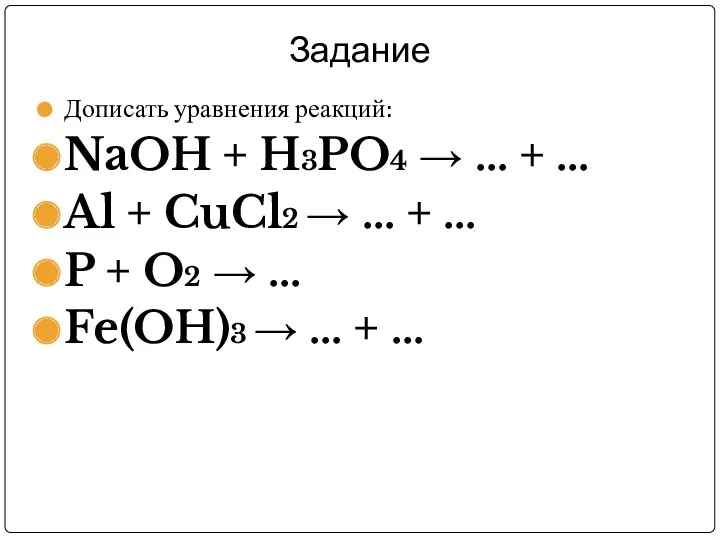
Задание
Дописать уравнения реакций:
NaOH + H3PO4 → … + …
Al + CuCl2
→ … + …
P + O2 → …
Fe(OH)3 → … + …
Слайд 15
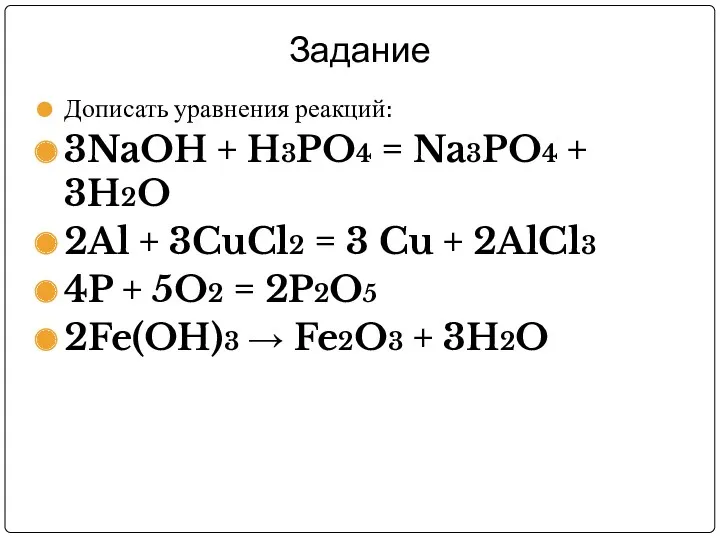
Задание
Дописать уравнения реакций:
3NaOH + H3PO4 = Na3PO4 + 3H2O
2Al + 3CuCl2
= 3 Cu + 2AlCl3
4P + 5O2 = 2P2O5
2Fe(OH)3 → Fe2O3 + 3H2O
Слайд 16

Определите тип реакции
1) CaO + CO2 = CaCO3
2) H2SO4 + 2NaOH
= Na2SO4 + 2H2O
3) Fe + S = FeS
4) 2H2O = 2H2 + O2↑
5) CuO + H2 = Cu + H2O
6) Zn + 2HCl = ZnCl2 + H2↑
7) ZnO + H2SO4 = ZnSO4 + H2O
8) Cu(OH)2 = CuO + H2O
А) соединения
Б) обмена
В) разложения
Г) замещения
Слайд 17
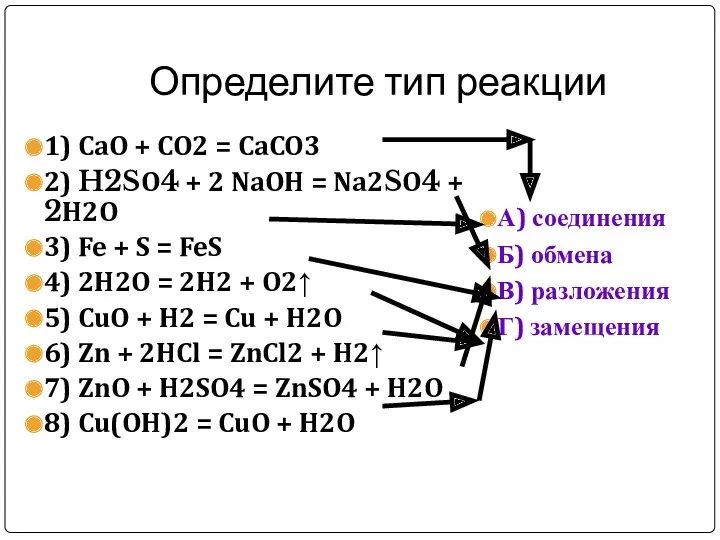
Определите тип реакции
1) CaO + CO2 = CaCO3
2) H2SO4 + 2
NaOH = Na2SO4 + 2H2O
3) Fe + S = FeS
4) 2H2O = 2H2 + O2↑
5) CuO + H2 = Cu + H2O
6) Zn + 2HCl = ZnCl2 + H2↑
7) ZnO + H2SO4 = ZnSO4 + H2O
8) Cu(OH)2 = CuO + H2O
А) соединения
Б) обмена
В) разложения
Г) замещения
Слайд 18

Определите тип реакций и расставьте коэффициенты:
1) HgO → Hg + O2
2)
CaCO3 → CaO + CO2
3) CuSO4 + Fe → Cu + FeSO4
4) CuO + H2 → Cu + H2O
5) H2 + O2 → H2O
6) H2SO4 + KOH → K2SO4 + H2O
7) BaO + SO2 → BaSO3

















 Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Минералы и горные породы
Минералы и горные породы Осадительное титрование. Меркуриметрия
Осадительное титрование. Меркуриметрия Способы получения металлов
Способы получения металлов Вуглеводи
Вуглеводи Соли. 8 класс
Соли. 8 класс General characteristics of halogens. Halogen compounds
General characteristics of halogens. Halogen compounds Все о чае
Все о чае Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі
AgCl негізіндегі нанокомпазиттердің фотокаталитикалық белсенділігі Вещества
Вещества Соединения химических элементов. 8 класс
Соединения химических элементов. 8 класс Электролиз. Электролизеры
Электролиз. Электролизеры Дисперсные системы: получение и свойства
Дисперсные системы: получение и свойства Первичная структура белков и пептидов
Первичная структура белков и пептидов Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Алюминий IIIА топ элементі
Алюминий IIIА топ элементі Углерод
Углерод Химический элемент и формы его существования
Химический элемент и формы его существования Век пластмасс
Век пластмасс Синтетический каучук и его применение
Синтетический каучук и его применение 20231009_zhyostkost_vody
20231009_zhyostkost_vody Свойства кислот в свете теории электролитической диссоциации
Свойства кислот в свете теории электролитической диссоциации Платина. Физические и химические свойства
Платина. Физические и химические свойства Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії
Електронні і графічні електронні формули атомів s-, р-, d- елементів. Принцип мінімальної енергії Алюминий и его соединения
Алюминий и его соединения Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Каучук. Открытие каучука
Каучук. Открытие каучука