Содержание
- 2. Способы получения дисперсных систем Методы получения дисперсных систем делят на диспергационные и конденсационные. Диспергационные методы получения
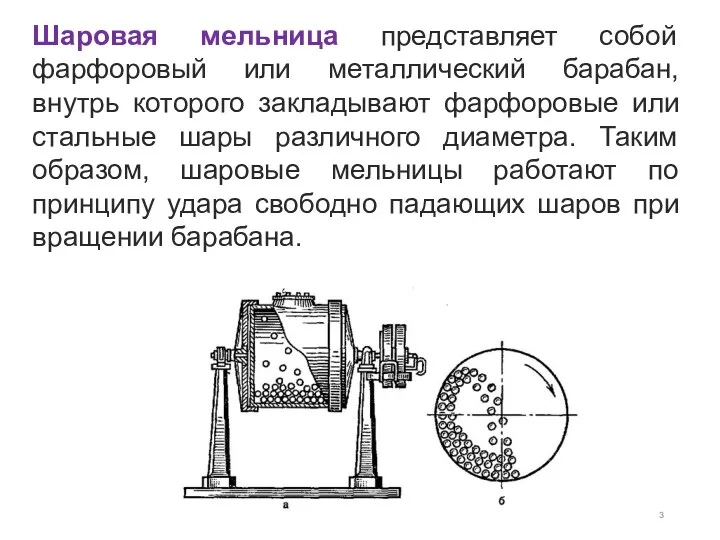
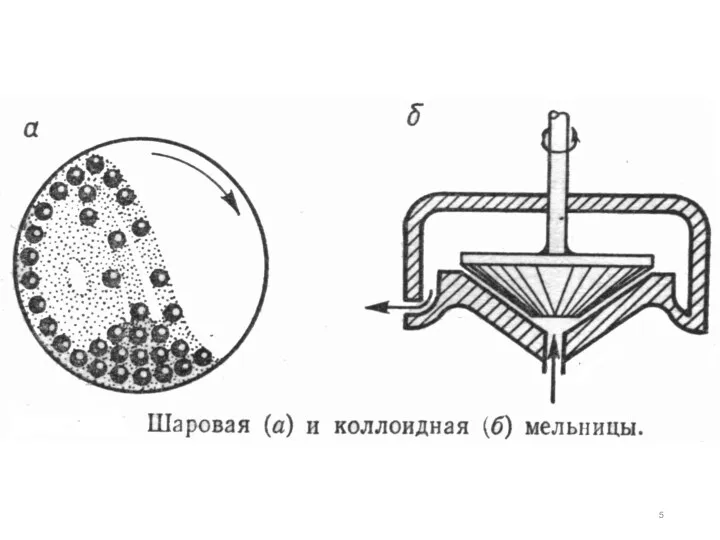
- 3. Шаровая мельница представляет собой фарфоровый или металлический барабан, внутрь которого закладывают фарфоровые или стальные шары различного
- 4. Коллоидные мельницы - работают по принципу удара при больших скоростях или по принципу истирания. Измельчение в
- 6. Конденсационные методы основаны на образовании частиц дисперсной фазы в результате кристаллизации или конденсации из веществ, находящихся
- 7. Физические методы - Конденсация паров жидкости в газовой фазе (образование туманов, облаков); - Конденсация паров при
- 8. Химические методы Получение дисперсных систем методами химической конденсации - это образование молекул нерастворимых веществ в результате
- 9. Коллоидный раствор золота
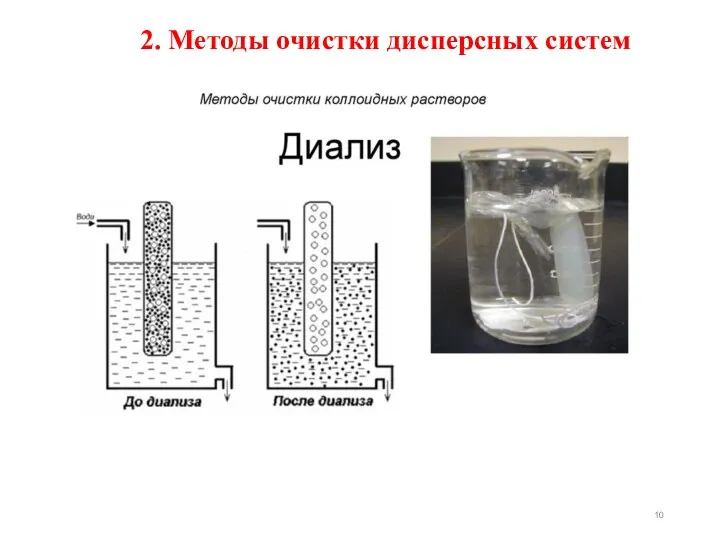
- 10. 2. Методы очистки дисперсных систем
- 11. Диализ. Сущность метода: два сосуда разделённых полупроницаемой мембраной (целлофан, пергамент, полисилоксан, полихлорвинил, полиэтилен). В одном сосуде
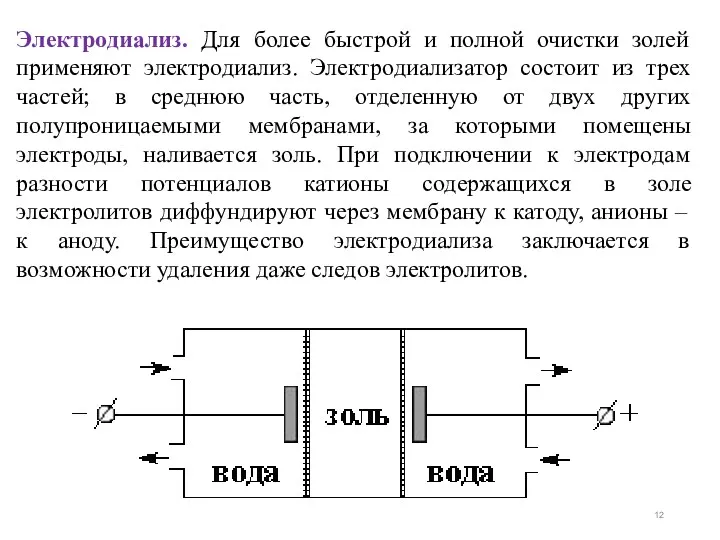
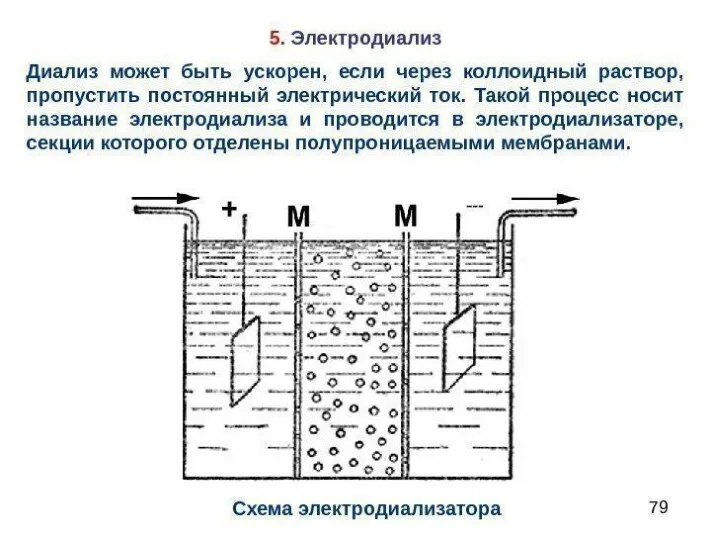
- 12. Электродиализ. Для более быстрой и полной очистки золей применяют электродиализ. Электродиализатор состоит из трех частей; в
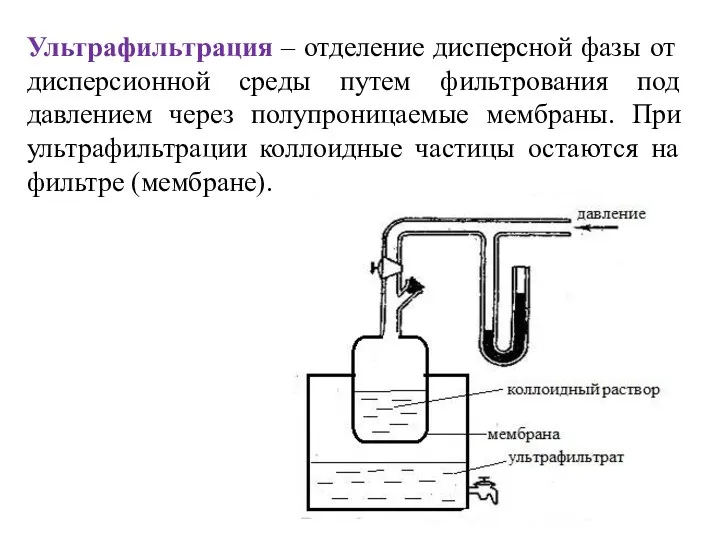
- 14. Ультрафильтрация – отделение дисперсной фазы от дисперсионной среды путем фильтрования под давлением через полупроницаемые мембраны. При
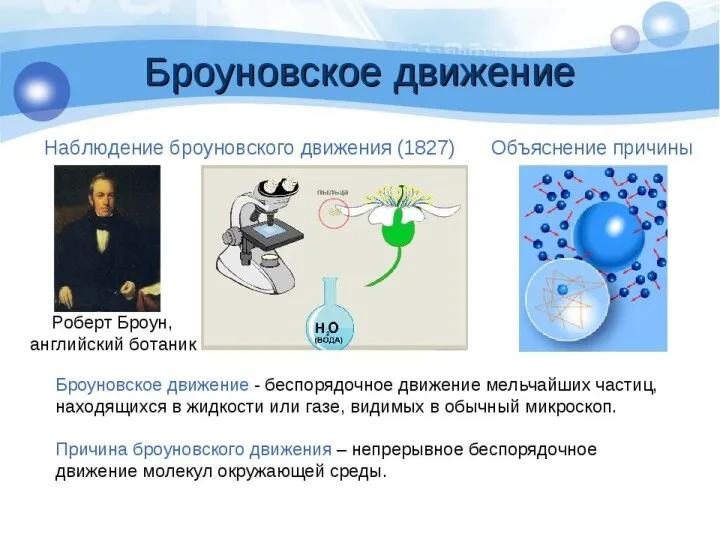
- 15. Кинетические свойства коллоидных систем Молекулярно-кинетические свойства называют свойства, обусловленные хаотическим тепловым движение частиц. Броуновское движение -
- 17. Диффузия – самопроизвольное выравнивание концентрации молекул, ионов или коллоидных частиц под влиянием их теплового движения. С
- 18. Растворы с одинаковым осмотическим давлением называются изотоническими. Если осмотическое давление выше внутриклеточного, то оно называется гипертоническим,
- 19. Седиментация Отличительной особенностью дисперсных систем является их кинетическая неустойчивость, проявляющаяся в оседании частиц дисперсной фазы под
- 20. Частицы в дисперсной системе находятся под действием сил тяжести и сил диффузии. Диффузия противодействует седиментации, стремясь
- 21. Поток диффузии iдиф и поток седиментации iсед - это количество вещества, которое под действием силы диффузии
- 22. От соотношения iдиф и iсед зависит устойчивость дисперсной системы. 1. Если iсед 2. Если iсед >>
- 23. Высокодисперсные системы подвергают седиментации, искусственно увеличивая скорость осаждения в центробежном поле. Для создания центробежного поля используют
- 24. Области применения седиментации. Очистка жидких веществ от взвешенных твердых и жидких частиц путем отстаивания (осветление воды).
- 26. Скачать презентацию
















 Металлы, их свойства и область применения
Металлы, их свойства и область применения Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Тяжелые металлы
Тяжелые металлы Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Значение пищи и ее состав
Значение пищи и ее состав Коррозия металлов
Коррозия металлов Изучение процесса коррозии железа (домашний эксперимент)
Изучение процесса коррозии железа (домашний эксперимент) Борьба с биологической коррозией
Борьба с биологической коррозией Реакции ионного обмена
Реакции ионного обмена Спирты
Спирты Газовые смеси
Газовые смеси Химический элемент, минерал, горная порода. (Лекция 6)
Химический элемент, минерал, горная порода. (Лекция 6) Титриметрический анализ. Кривые титрования
Титриметрический анализ. Кривые титрования Адсорбция
Адсорбция Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Химические реакции или химические явления
Химические реакции или химические явления Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение
Спирты. Понятия о предельных одноатомных спиртах. Химические свойства этанола и его применение Хром, марганец
Хром, марганец Химическая кинетика и катализ
Химическая кинетика и катализ Свойства фосфора
Свойства фосфора Общие сведения о полезных ископаемых. (Лекция 2)
Общие сведения о полезных ископаемых. (Лекция 2) Тұндыру әдістері
Тұндыру әдістері Термодинамика химических процессов
Термодинамика химических процессов Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Типы химических реакций на примере свойств воды
Типы химических реакций на примере свойств воды Реакции солей в растворе. Гидролиз солей. Водородный показатель рН
Реакции солей в растворе. Гидролиз солей. Водородный показатель рН