Содержание
- 2. Граф структуры
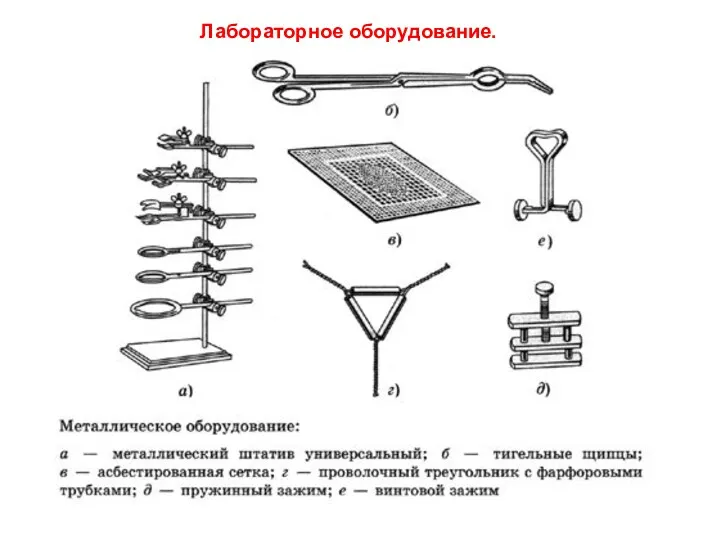
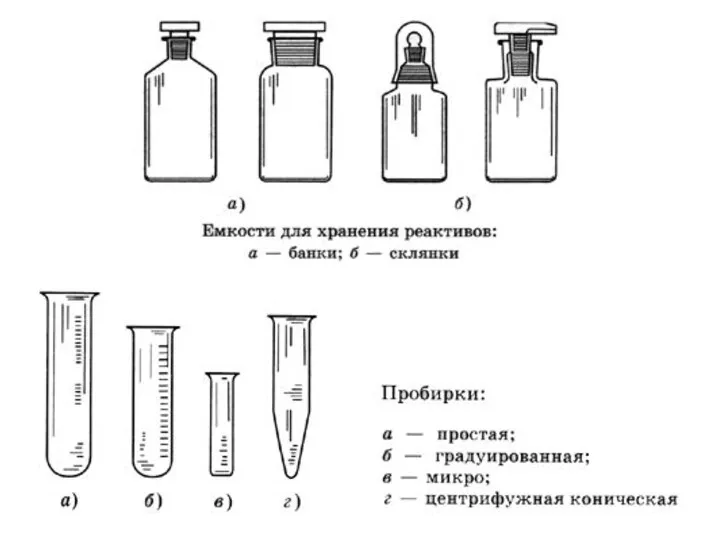
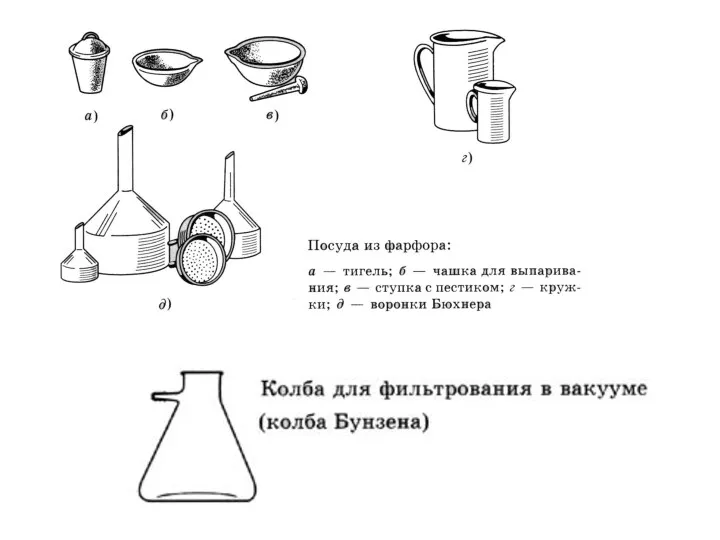
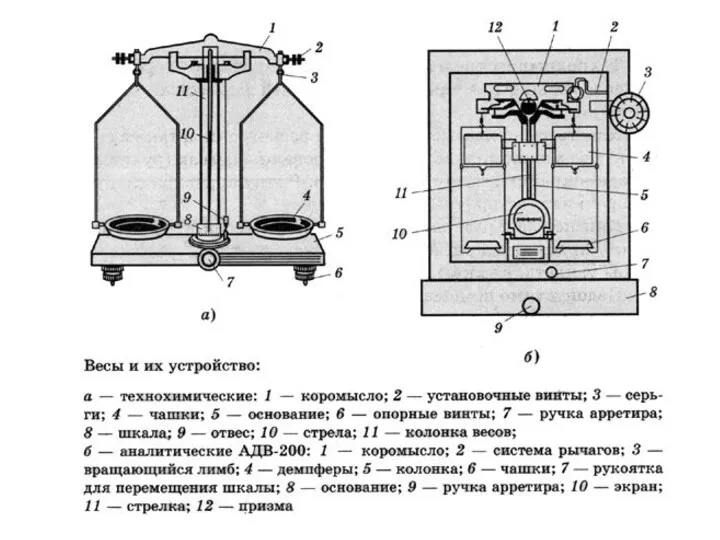
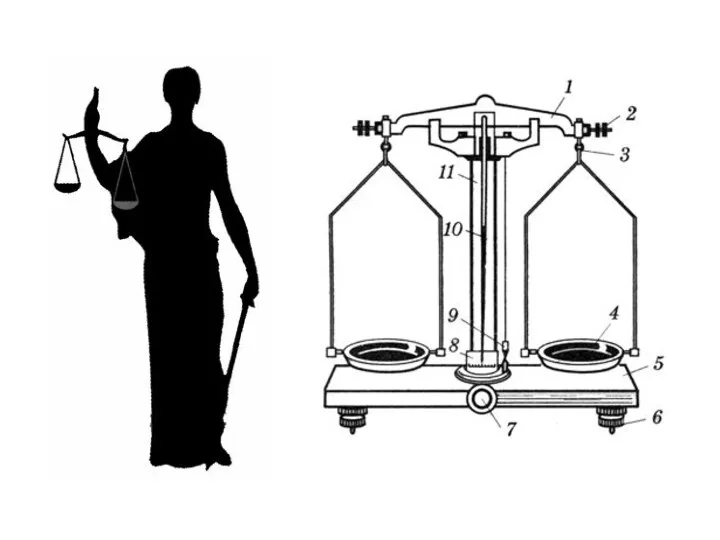
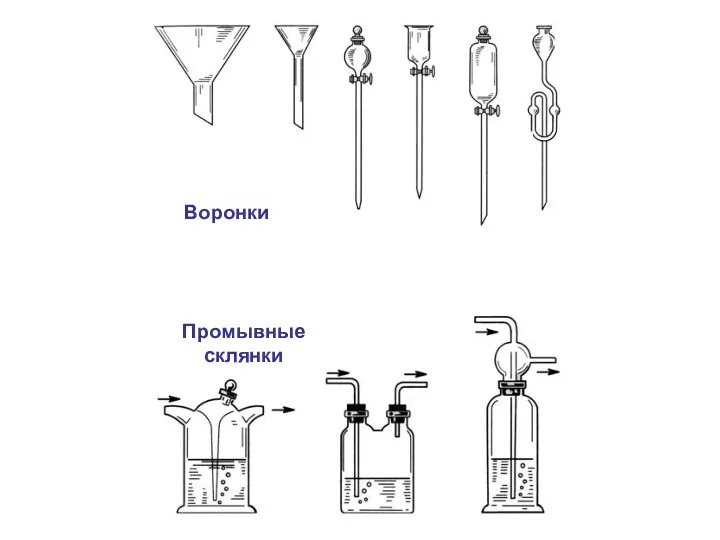
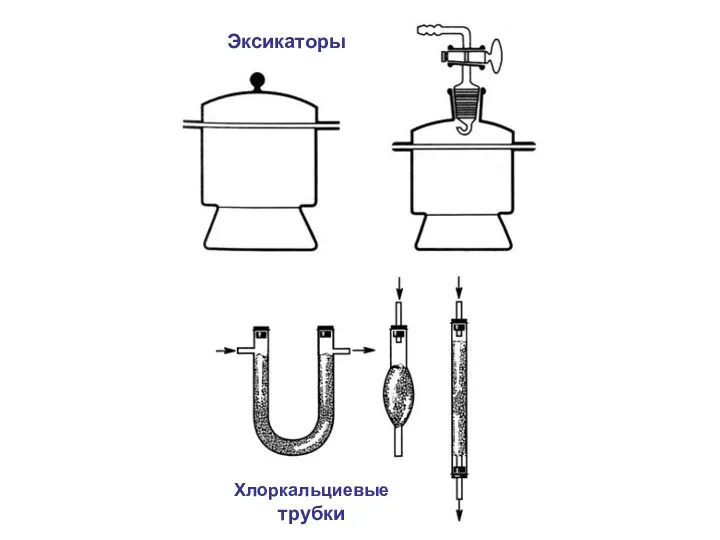
- 3. Лабораторное оборудование.
- 9. Магнитные мешалки
- 10. Устройства перемешивающие
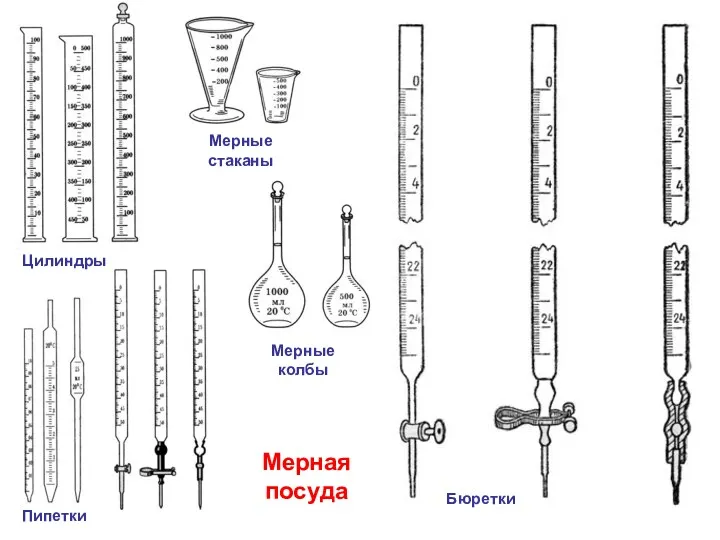
- 13. Пипетки Цилиндры Мерные колбы Мерные стаканы
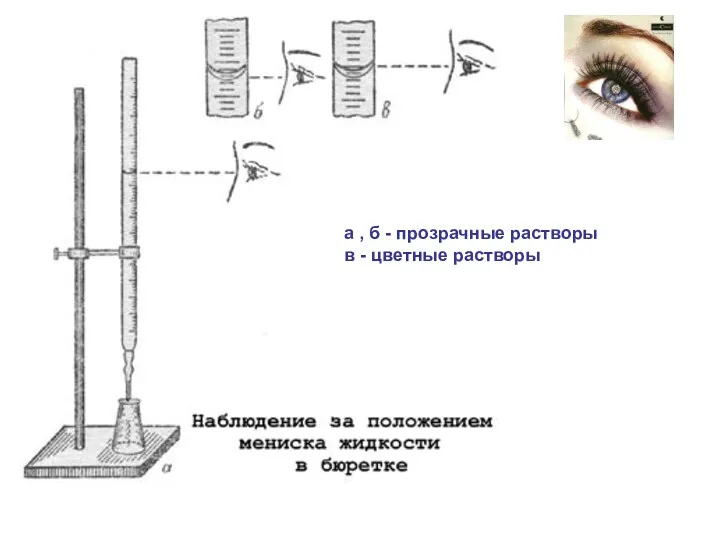
- 14. а , б - прозрачные растворы в - цветные растворы
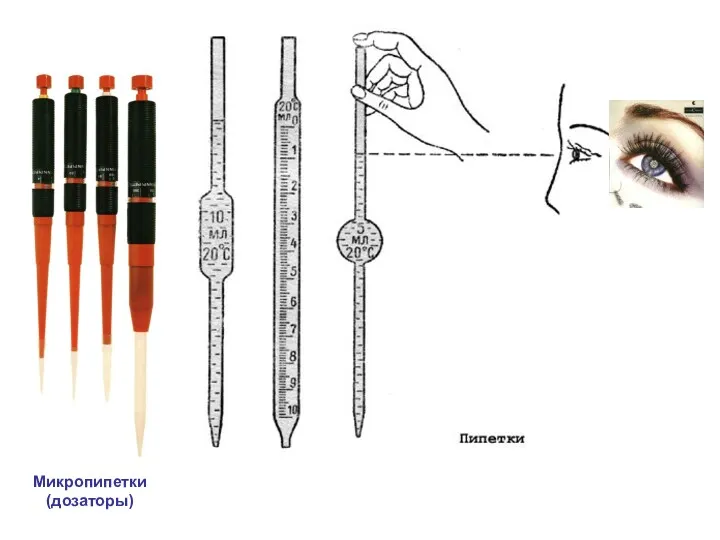
- 15. Микропипетки (дозаторы)
- 16. Титриметрический анализ. T = m/V ( г/мл ) 1. Нейтрализации Н+ + ОН- = Н2О 2.
- 17. Требования к исходным веществам: Состав вещества должен соответствовать формуле. Вещество не должно быть гигроскопичным и хорошо
- 18. Реакция должна протекать в соответствии со стехиометрическим уравнением реакции и должна быть практически необратима. 2. Результат
- 19. Если реакция не удовлетворяет хотя бы одному из этих требований, она не может быть использована в
- 20. Титрование - процесс постепенного добавления раствора с известной концентрацией к определенному объему исследуемого раствора до момента
- 21. Бюретка наполнена раствором сильной кислоты (или сильного основания) известной концентрации. Из бюретки в колбу медленно добавляют
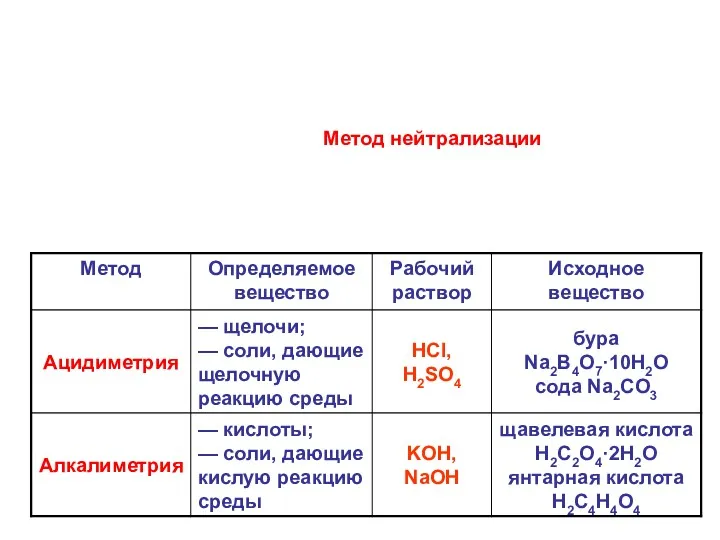
- 22. Метод нейтрализации
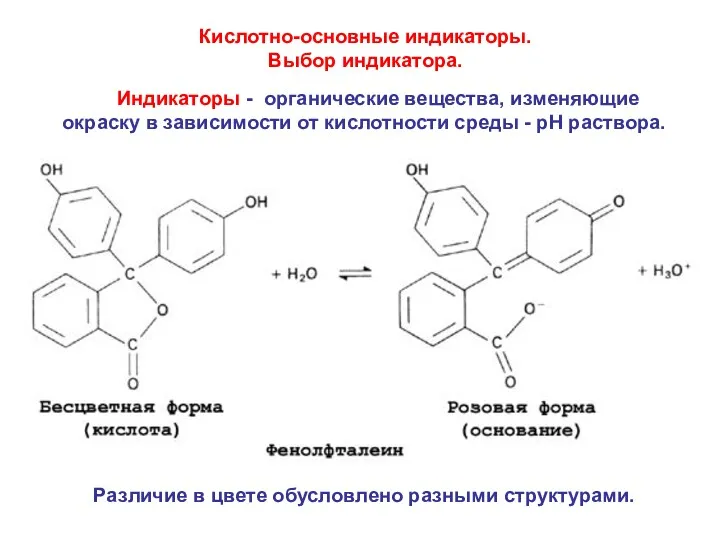
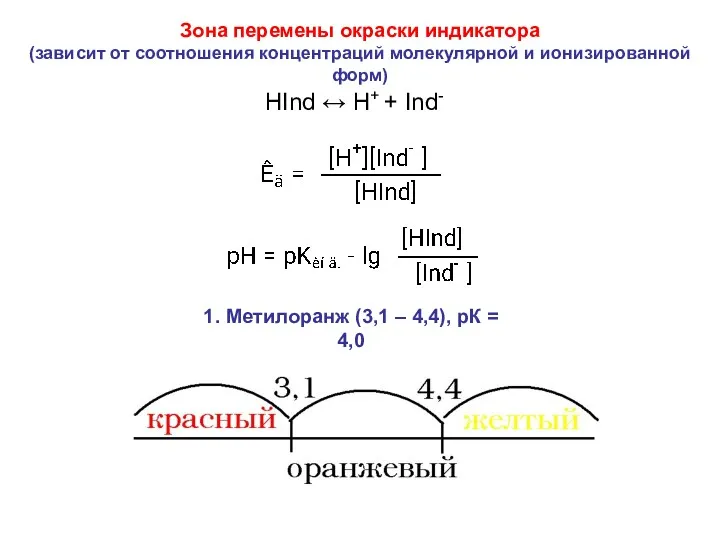
- 23. Кислотно-основные индикаторы. Выбор индикатора. Индикаторы - органические вещества, изменяющие окраску в зависимости от кислотности среды -
- 25. HInd ↔ H+ + Ind- 1. Метилоранж (3,1 – 4,4), рК = 4,0 Зона перемены окраски
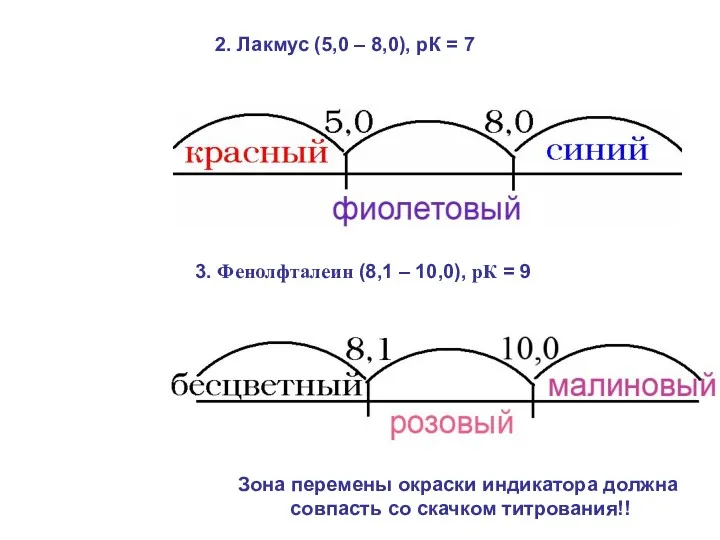
- 26. 2. Лакмус (5,0 – 8,0), рК = 7 3. Фенолфталеин (8,1 – 10,0), рК = 9
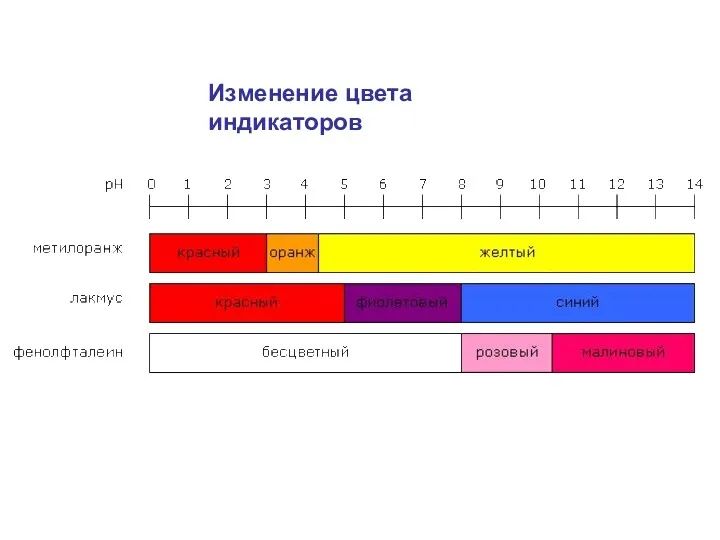
- 27. Изменение цвета индикаторов
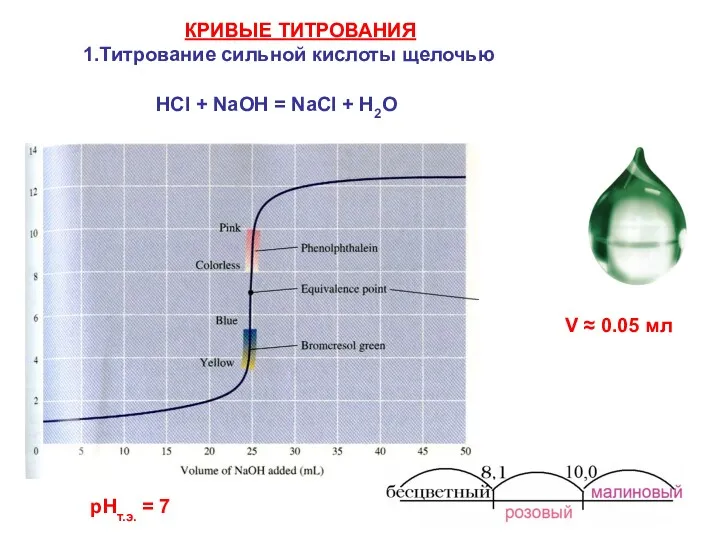
- 28. НСl + NaOH = NaCl + Н2О V ≈ 0.05 мл КРИВЫЕ ТИТРОВАНИЯ 1.Титрование сильной кислоты
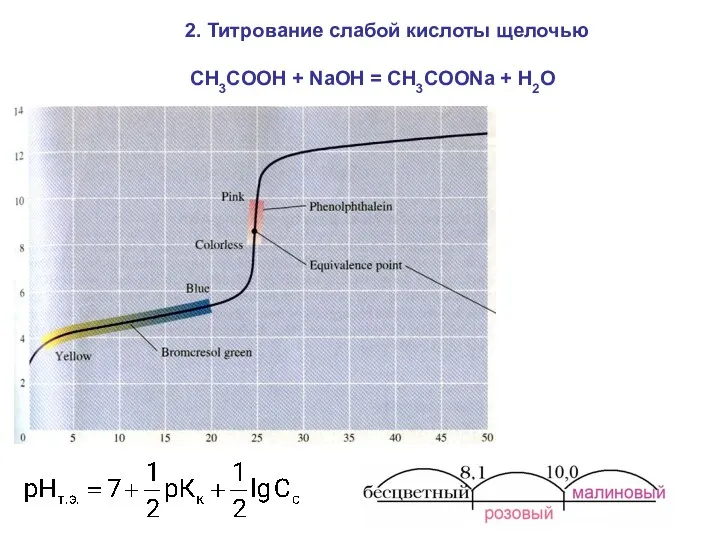
- 29. 2. Титрование слабой кислоты щелочью CH3COOH + NaOH = CH3COONa + Н2О
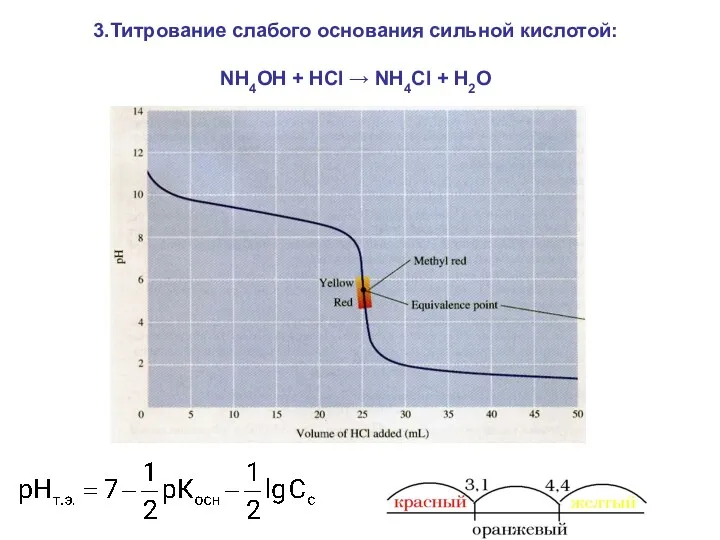
- 30. 3.Титрование слабого основания сильной кислотой: NH4OH + HCl → NH4Cl + H2O
- 31. В перманганатометрии индикатор не требуется, так как раствор Mn2+ бесцветен, а MnO4- имеет розово-фиолетовую окраску. В
- 32. Способ титрования в методе нейтрализации- прямое титрование HCI + NaOH = NaСI + H2O К 100мл
- 33. Клинический анализ желудочного содержимого. Кислотность желудочного сока – количество мл 0,1 н раствора щелочи, необходимого для
- 34. Задача. Для устранения кислого характера сточных растворов часто применяется известняковая мука. Если суточный объем очищаемой воды
- 35. Для устранения кислого характера сточных растворов часто применяется известняковая мука. Если суточный объем очищаемой воды равен
- 37. Скачать презентацию
















 Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Качественные реакции на анионы
Качественные реакции на анионы Застосування радіонуклідів у медицині, тваринництві та археології
Застосування радіонуклідів у медицині, тваринництві та археології Химическая технология. Введение
Химическая технология. Введение Загальні способи добування солей. Класифікація неорганічних речовин
Загальні способи добування солей. Класифікація неорганічних речовин Электролитическая диссоциация
Электролитическая диссоциация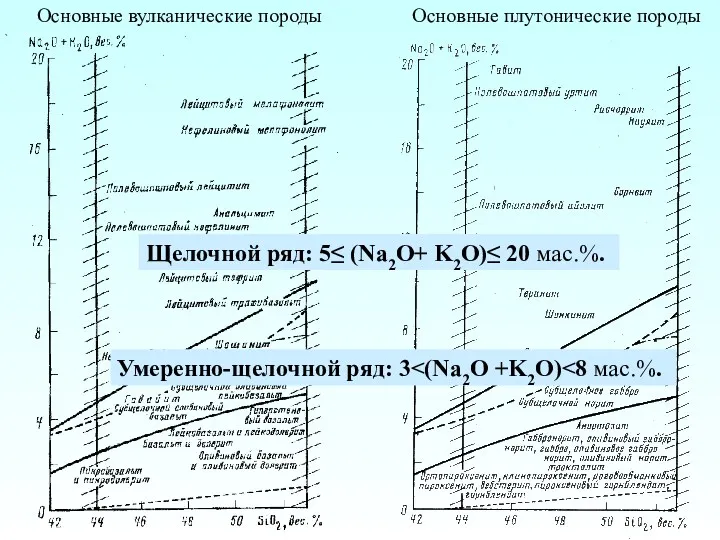 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы Метод МО
Метод МО Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Валентные возможности атомов химических элементов
Валентные возможности атомов химических элементов Аммиак. Физические и химические свойства. Получение, применение
Аммиак. Физические и химические свойства. Получение, применение Ерітінділер туралы ілім. Буферлік ерітінділер
Ерітінділер туралы ілім. Буферлік ерітінділер Гидролиз. Применение гидролиза. (11 класс)
Гидролиз. Применение гидролиза. (11 класс) Электронно-ионный баланс и Закон Авогадро. 8 класс
Электронно-ионный баланс и Закон Авогадро. 8 класс Атом. Будова атома
Атом. Будова атома Тема 1. Металлы и сплавы
Тема 1. Металлы и сплавы Алканы нефти. Содержание алканов в нефтяных фракциях
Алканы нефти. Содержание алканов в нефтяных фракциях Растворы. Лекция 7
Растворы. Лекция 7 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Виды химической связи
Виды химической связи Профілактика захворювань незбалансованого харчування. Харчові добавки
Профілактика захворювань незбалансованого харчування. Харчові добавки Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Гидролиз органических и неорганических веществ
Гидролиз органических и неорганических веществ Беттік активті заттардың беттік қасиеттері
Беттік активті заттардың беттік қасиеттері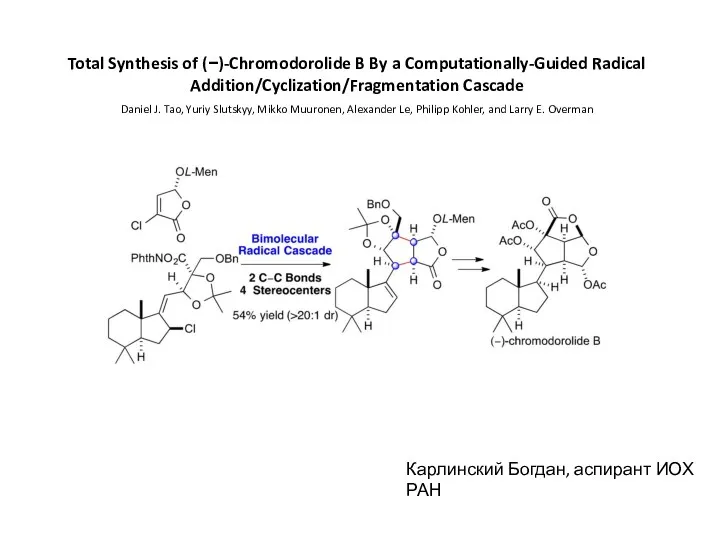 Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical
Total Synthesis of (−)-Chromodorolide B By a Computationally-Guided Radical Чистые вещества и смеси
Чистые вещества и смеси