Содержание
- 2. Найменша електронейтральна частинка хімічного елемента,яка несе усі властивості елемента. Атом
- 3. Розмір атомів Атом має дуже малі розміри 1 нм = 10-9м Наприклад, радиус атома заліза 0,13
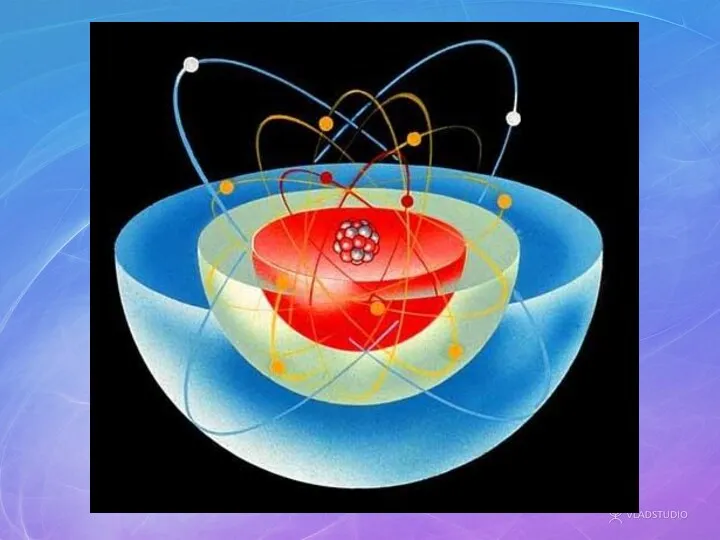
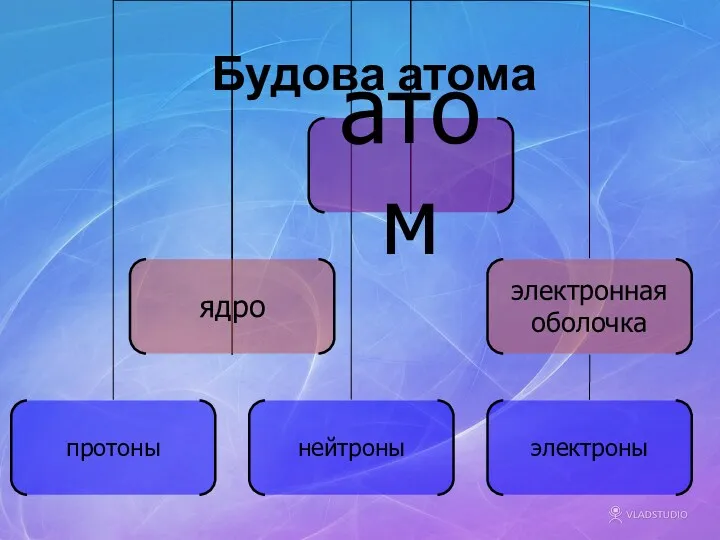
- 4. Будова атомів Атом складається з позитивно зарядженого ядра, довкола якого обертаються негативні электрони. Будову атома можна
- 7. Моделі будови атомів
- 8. Будова атома
- 9. Протони і нейтрони Основна маса атома знаходиться в ядрі, яке складається з частинок двох видів: протонів
- 10. Електроны До складув атома, окрім позитивно зарядженого ядра, входять негативно заряджені частинки – електроны. Електричний заряд
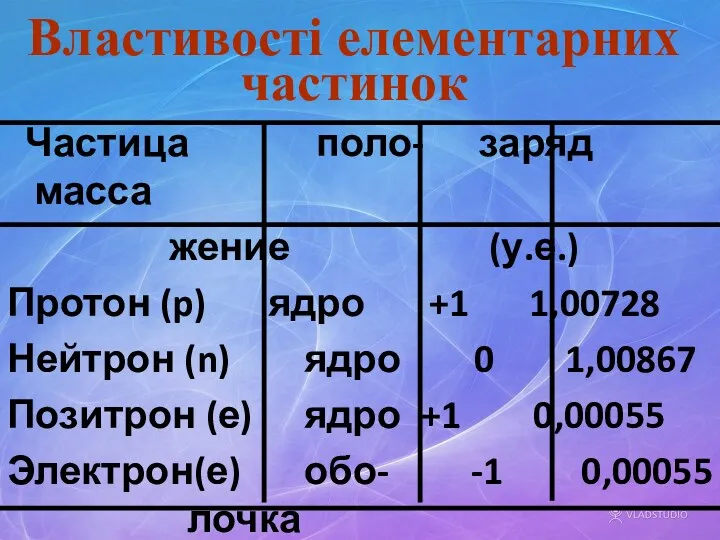
- 11. Властивості елементарних частинок Частица поло- заряд масса жение (у.е.) Протон (p) ядро +1 1,00728 Нейтрон (n)
- 12. A = Z + N A – масове число атома Z – заряд ядра (число протонів)
- 13. Масове число Сума числа протонів і нейтронів називається масовим числом. Так як атом електронейтральний, то число
- 14. Состав атома Все известные химические элементы приведены в таблице Д. И. Менделеева. В ней они располагаются
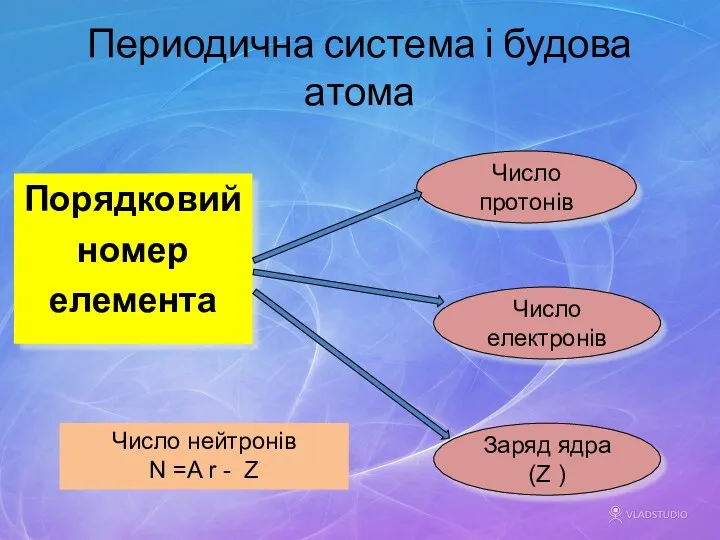
- 15. Периодична система і будова атома Порядковий номер елемента Число протонів Число електронів Заряд ядра (Z )
- 16. Ядро
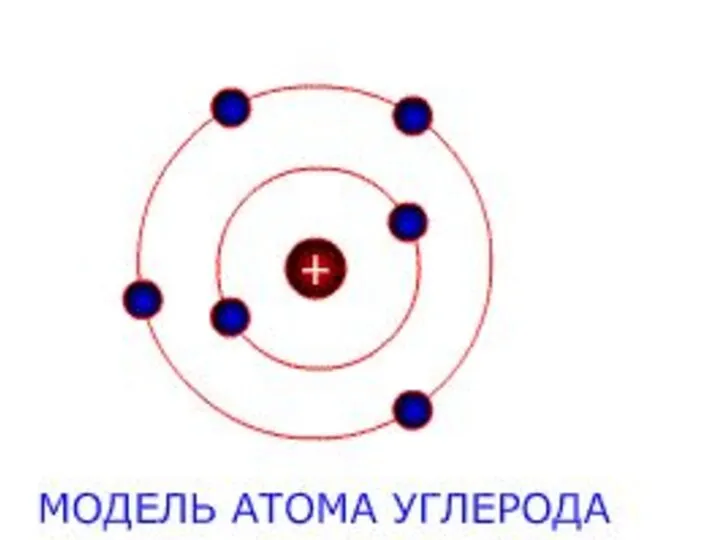
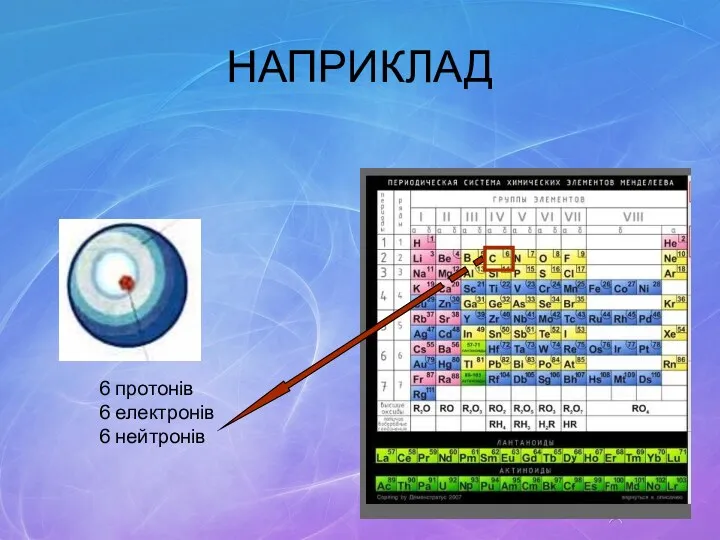
- 17. НАПРИКЛАД 6 протонів 6 електронів 6 нейтронів
- 18. Ізотопи ІЗОТОПИ – це атоми одного хімічного елемента , які мають однакове число протонів і електронів,
- 20. Скачать презентацию











 Удобрения и их классификация
Удобрения и их классификация Алюминий и его соединения
Алюминий и его соединения Композиты и композиционные материалы
Композиты и композиционные материалы Электрохимические процессы
Электрохимические процессы Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів
Основні властивості металів. Хімія металургійних процесів. Теорія сплавів. Корозія металів Характеристика металу Алюміній
Характеристика металу Алюміній Химия в повседневной жизни человека
Химия в повседневной жизни человека Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Свойства, состав и применение пластмасс
Свойства, состав и применение пластмасс Химия. ЕГЭ. Задание № 32
Химия. ЕГЭ. Задание № 32 Газовые законы для идеальных и реальных газов. Лекция 1
Газовые законы для идеальных и реальных газов. Лекция 1 Парфюмерно-косметическая продукция
Парфюмерно-косметическая продукция Сполуки неметалічних елементів з Гідрогеном
Сполуки неметалічних елементів з Гідрогеном Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс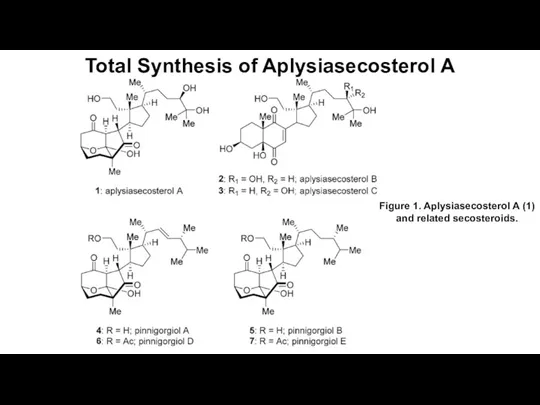 Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Химические свойства кислот
Химические свойства кислот Теория электролитической диссоциации
Теория электролитической диссоциации Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Химический элемент железо
Химический элемент железо Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау
Алкалоидтар. Химиялық жіктелуі. Коммуникативті платформада G-глобалдың мәселелерін анықтау Химическая очистка сточных вод. Окисление и восстановление
Химическая очистка сточных вод. Окисление и восстановление Алгоритм определения вида связи по формуле вещества
Алгоритм определения вида связи по формуле вещества Мило та миловаріння
Мило та миловаріння Галогены в природе. Хлор, бром, иод
Галогены в природе. Хлор, бром, иод Металлы побочных подгрупп
Металлы побочных подгрупп Коррозия металлов
Коррозия металлов