Содержание
- 2. 1) Алотропною видозміною Оксигену є озон. 2) На зовнішньому енергетичному рівні атома Нітрогену міститься 7 електронів.
- 3. «Незакінчені речення»(3б) 1. В атома Сульфуру на зовнішньому рівні міститься… 2. Явище існування хімічного елемента у
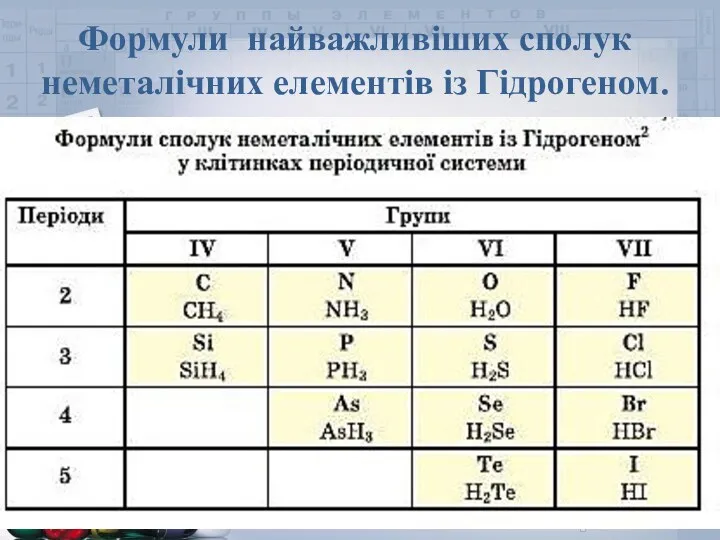
- 4. Формули найважливіших сполук неметалічних елементів із Гідрогеном.
- 5. Загальна формула сполук елементів із Гідрогеном має два варіанти написання НnЕ або ЕНn
- 6. Для сполук неметалічних елементів із Гідрогеном частіше використовують тривіальні назви : амоніак, метан, вода, хлороводень, сірководень
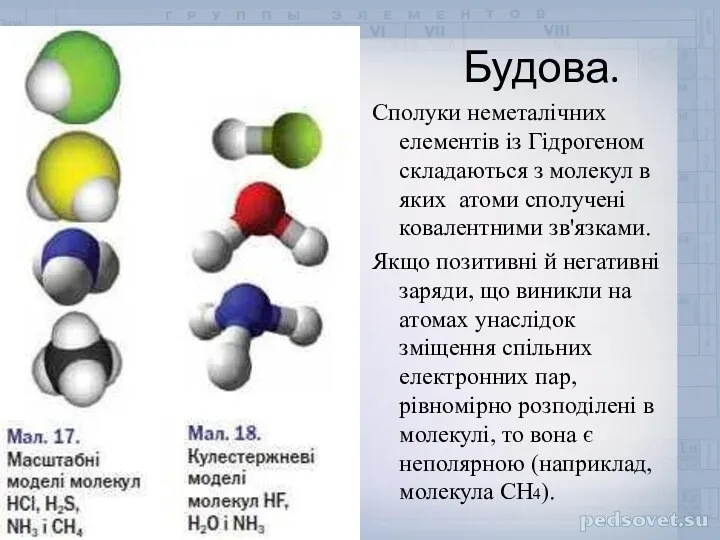
- 7. Будова. Сполуки неметалічних елементів із Гідрогеном складаються з молекул в яких атоми сполучені ковалентними зв'язками. Якщо
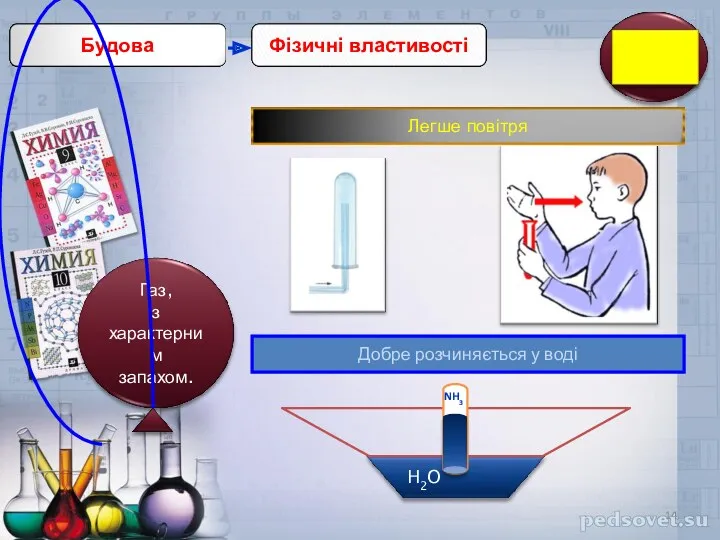
- 8. Фізичні властивості
- 9. Фізичні властивості. Більшість сполук неметалічних елементів із Гідрогеном за звичайних умов є газами, а гідроген фторид
- 10. Найбільшу розчинність у воді мають сполуки галогенів із Гідрогеном та амоніак. Наприклад, в 1 л води
- 11. Метан СН4 інертний щодо води (за звичайних умов). Водний розчин амоніаку NН3, на відміну від розчинів
- 12. Склад речовин Амоніак
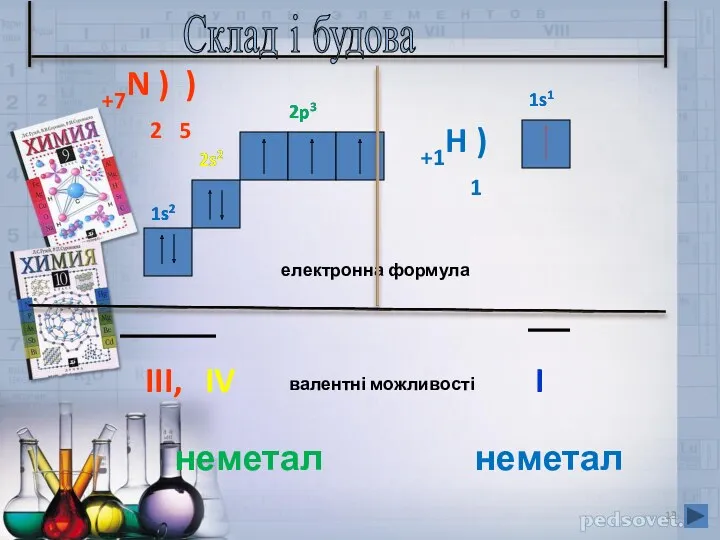
- 13. +7N ) ) 2 5 2s2 2p3 електронна формула 2s2 1s2 1s2 2p3 валентні можливості III,
- 14. Добре розчиняється у воді NH3
- 15. Амоніак – безбарвний газ з різким запахом. При температурі, нижчій за – 33,4ОС, він переходить у
- 16. 1.Взаємодіє з водою і утворює гідрати NH3•H2O, NH3+H2O=NH4OH. Лужна реакція розчину амоніаку наявністю . Водний розчин
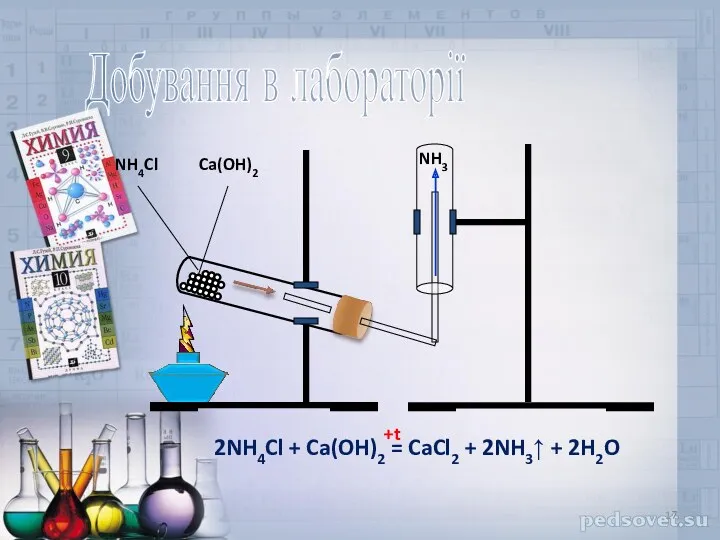
- 17. NH4Cl Ca(OH)2 NH3 Добування в лабораторії
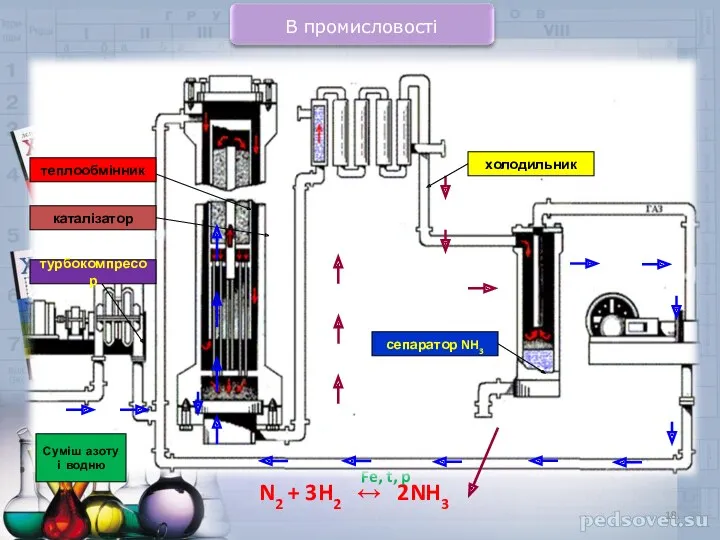
- 18. Суміш азоту і водню турбокомпресор каталізатор теплообмінник холодильник сепаратор NH3
- 19. Викортання
- 20. Хлороводень. Хлоридна кислота.
- 21. Електронна і графічна формули молекули хлороводню:
- 22. Хлороводень HCl HCl – це безбарвний газ з різким неприємним запахом, важчий за повітря. М (HCl)=
- 23. Добування HCl В лабораторії: t NaCl(тв.) + H2SO4(конц) → NaHSO4 + HCl В промисловості: H2 +
- 24. Розчин хлороводню у воді називають хлоридною, або соляною, кислотою. Поява кислотних властивостей хлороводню в розчині обумовлюється
- 25. Хімічні властивості 1. Взаємодія з металами, що стоять у ряду активності до водню : 2HCl +
- 26. Хімічні властивості 3.З гідроксидами металів: HCl + NaOH → NaCl + H2O 4.З солями (при умові,
- 28. Скачать презентацию

















 Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості
Поняття про багатоатомні спирти на прикладі гліцеролу, його хімічні властивості Строение атома. Лекция 2
Строение атома. Лекция 2 Жидкое и растворимое стекло
Жидкое и растворимое стекло Арены - ароматические соединения
Арены - ароматические соединения Камни и Скорпион
Камни и Скорпион Химия и живопись
Химия и живопись Минеральные удобрения
Минеральные удобрения Additives for Polymeric Materials
Additives for Polymeric Materials Применение водорода. Будущие водородные технологии. Урок химии в 8 классе
Применение водорода. Будущие водородные технологии. Урок химии в 8 классе Литий
Литий Химическая посуда и ее назначения (6)
Химическая посуда и ее назначения (6) Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Общая характеристика неметаллов
Общая характеристика неметаллов Methods for processing of liquid waste
Methods for processing of liquid waste Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина Химические основы жизни
Химические основы жизни Галогены
Галогены Основания. Классификация оснований
Основания. Классификация оснований Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Кислоты и их свойства
Кислоты и их свойства Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем
Класифікація дисперсних систем харчових продуктів. Характеристика колоїдних систем Кремний и его соединения
Кремний и его соединения 20231110_amfoternye_oksidy_i_gidroksidy
20231110_amfoternye_oksidy_i_gidroksidy Основные классы неорганических соединений
Основные классы неорганических соединений Химический элемент V группы: сурьма
Химический элемент V группы: сурьма Кислород. Химия. 8 класс
Кислород. Химия. 8 класс Методы анализа. Классификация методов анализа
Методы анализа. Классификация методов анализа Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение