Содержание
- 2. Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка.
- 3. Классификация кислот HF HCl HBr HI H2S HNO3 H2SO4 H2SiO3 H2CO3 H3PO4
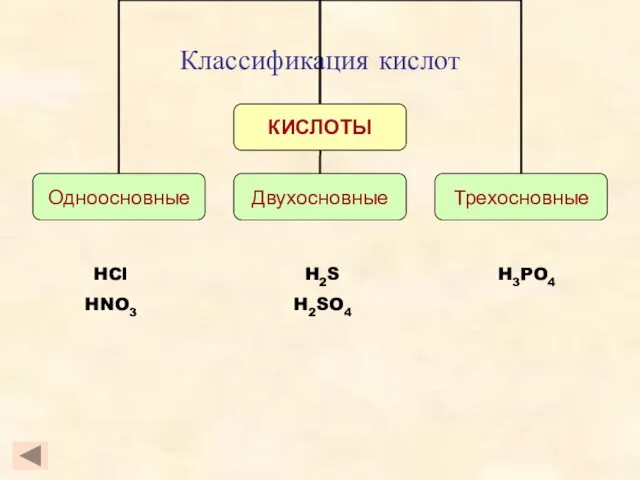
- 4. Классификация кислот HCl HNO3 H3PO4 H2S H2SO4
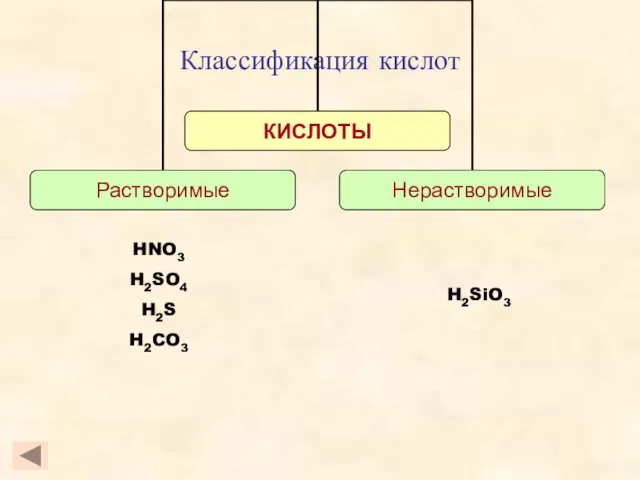
- 5. Классификация кислот H2SiO3 HNO3 H2SO4 H2S H2CO3
- 6. Классификация кислот HCl H2SO4 H3PO4 H2SO3 H2SiO3 H2CO3
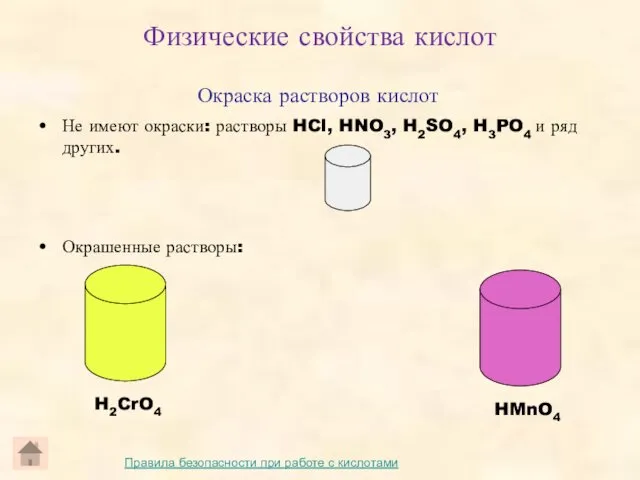
- 7. Окраска растворов кислот Не имеют окраски: растворы HCl, HNO3, H2SO4, H3PO4 и ряд других. Окрашенные растворы:
- 8. Химические свойства кислот Действие кислот на индикаторы лакмус метилоранж фенолфталеин Опыт
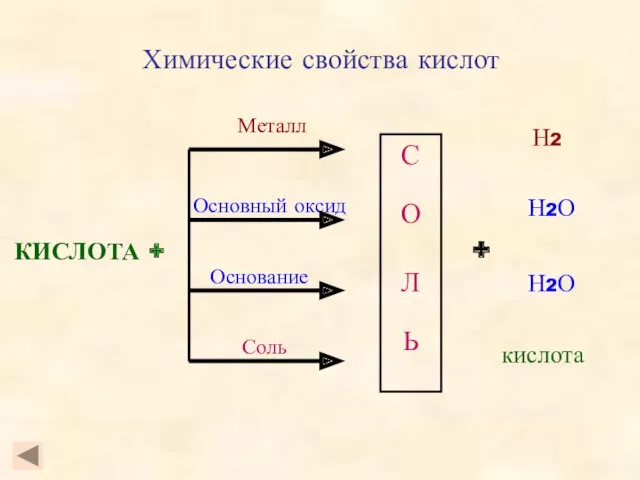
- 9. Химические свойства кислот КИСЛОТА + С О Л Ь Металл Основный оксид Основание Соль + Н2
- 10. Химические свойства кислот Кислота + металл = соль + водород Ряд активности металлов: Li K Ba
- 11. Химические свойства кислот Кислота + основный оксид = соль + вода Опыт. Взаимодействие оксида меди (Опыт.
- 12. Кислота + основание = соль + вода Химические свойства кислот HCl + NaOH = H2SO4 +
- 13. Химические свойства кислот Кислота 1 + соль 1 = соль 2 + Кислота 2 Условия реакции:
- 15. Скачать презентацию







 Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Сложные вопросы ЕГЭ по химии
Сложные вопросы ЕГЭ по химии Периодическая система Д.И. Менделеева и строение атома
Периодическая система Д.И. Менделеева и строение атома Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Теория сильных и слабых электролитов
Теория сильных и слабых электролитов Основные способы получения металлов
Основные способы получения металлов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Мұнай құрамындағы тұздың мөлшерін анықтау
Мұнай құрамындағы тұздың мөлшерін анықтау Химия и живопись
Химия и живопись Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Характеристика элементов VI группы .Кислород. Озон
Характеристика элементов VI группы .Кислород. Озон Методика “Кольоропис”
Методика “Кольоропис” Валентность и степень окисления химического элемента
Валентность и степень окисления химического элемента Nitrogen. Phosphorus
Nitrogen. Phosphorus Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар
Акарицидтер. Тетразиндер. Бензи-латтар. Сульфоқышқыл туындылары. Хина-золиндер . Пирозолдар. Пиридазипондар Вода: фізичні та хімічні властивості. Поширеність в природі
Вода: фізичні та хімічні властивості. Поширеність в природі Химия 20 века
Химия 20 века Непредельные углеводороды
Непредельные углеводороды Кислород. Химия – 8 класс
Кислород. Химия – 8 класс Фенол. Фізичні та хімічні властивості
Фенол. Фізичні та хімічні властивості Реакции при нагревании
Реакции при нагревании Тұндыру әдістері
Тұндыру әдістері Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Основания: номенклатура, классификация, применение, физические свойства. 8 класс
Основания: номенклатура, классификация, применение, физические свойства. 8 класс