Содержание
- 2. Цель: Закрепить знания о причинах изменения свойств химических элементов на основании положения в таблице Д.И. Менделеева;
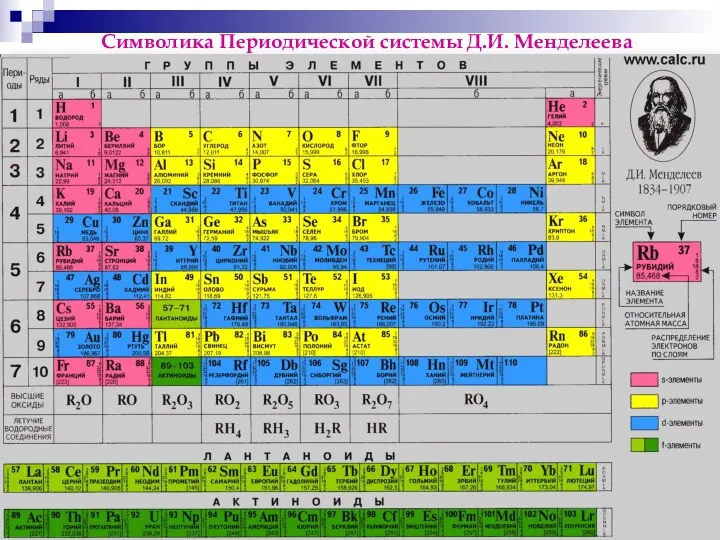
- 3. Символика Периодической системы Д.И. Менделеева
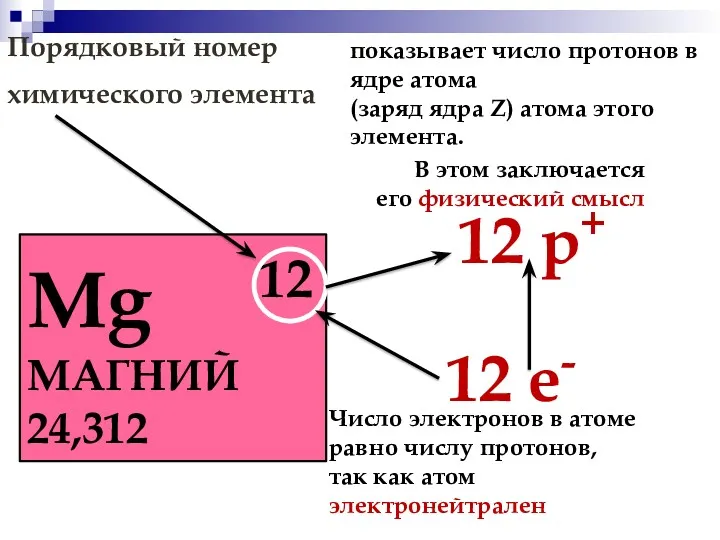
- 4. Порядковый номер химического элемента Mg 12 МАГНИЙ 24,312 12 р+ 12 е- показывает число протонов в
- 5. Закрепим! Са 20 КАЛЬЦИЙ 40,08 Z = +20 20 р+ 20 е- S S 32 СЕРА
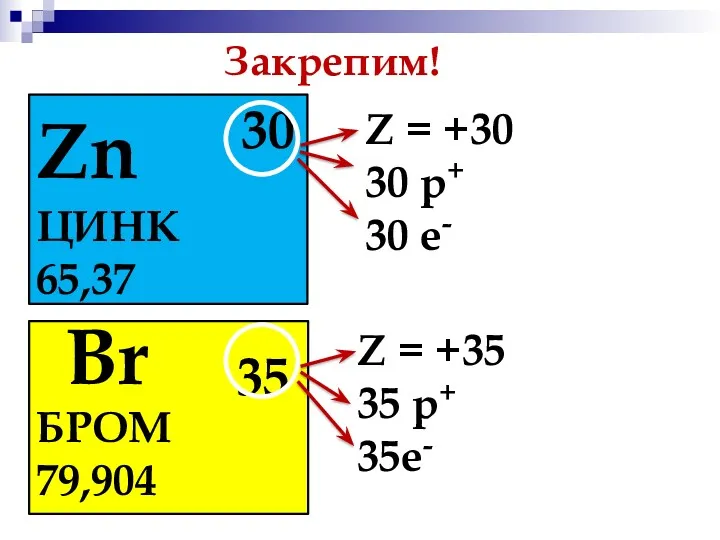
- 6. Закрепим! Zn 30 ЦИНК 65,37 Z = +30 30 р+ 30 е- S Br 35 БРОМ
- 7. Горизонтальные строки химических элементов - периоды малые большие незавершенный
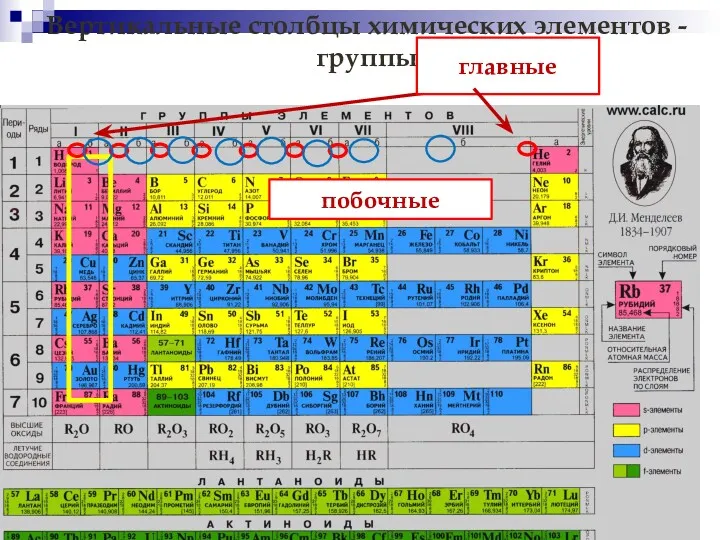
- 8. Вертикальные столбцы химических элементов - группы главные побочные
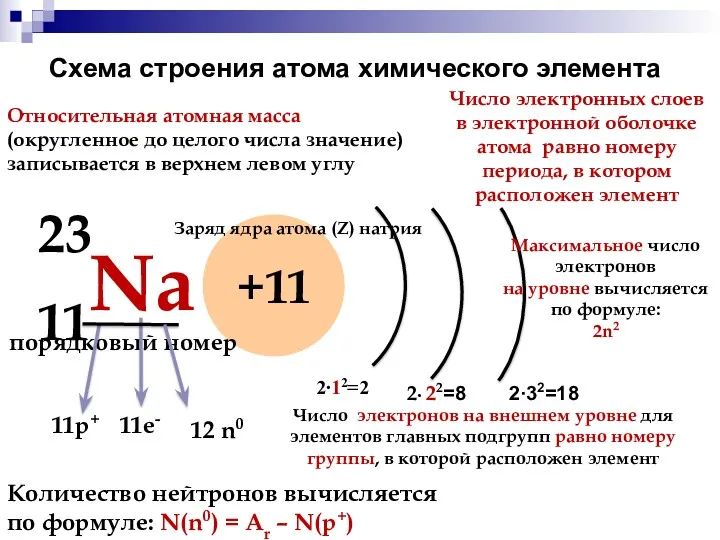
- 9. Схема строения атома химического элемента 11Na 23 +11 Число электронных слоев в электронной оболочке атома равно
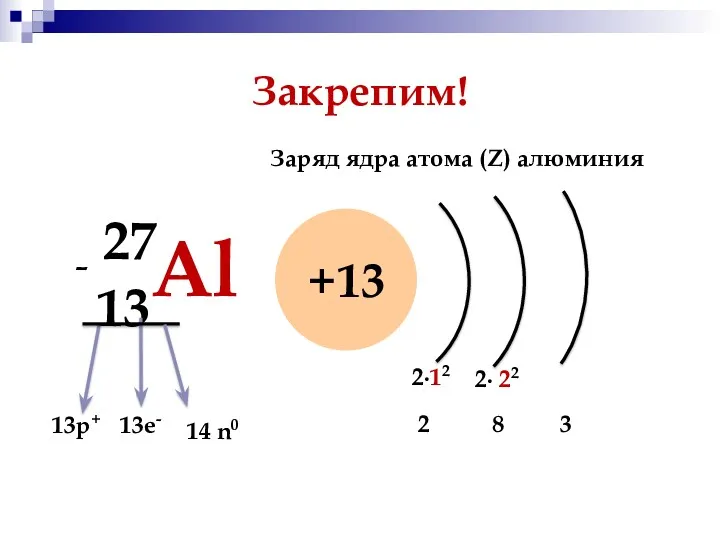
- 10. Закрепим! 13Al 27 +13 13р+ 13е- - 14 n0 Заряд ядра атома (Z) алюминия 3 2∙12
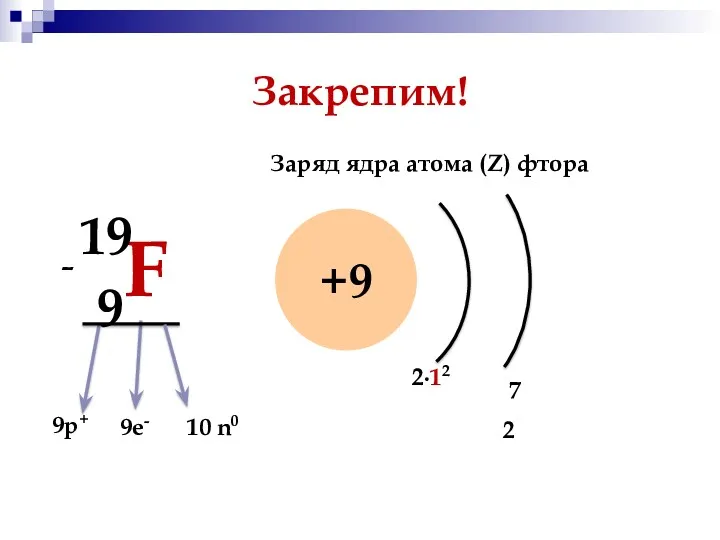
- 11. Закрепим! 9F 19 +9 9р+ 9е- - 10 n0 Заряд ядра атома (Z) фтора 7 2∙12
- 12. ЗАКОНОМЕРНОСТИ ИЗМЕНЕНИЯ СВОЙСТВ ЭЛЕМЕНТОВ И ИХ СОЕДИНЕНИЙ
- 13. В пределах одного периода Возрастают: I II III IV V VI VII VIII Li Be B
- 14. В пределах одного периода 2. Уменьшаются: I II III IV V VI VII VIII Li Be
- 15. В пределах одного периода 3. Не изменяется: I II III IV V VI VII VIII Li
- 16. Закрепим! В периодах слева направо заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем
- 17. Закрепим! В периодах справа налево число энергетических уровней Увеличивается Уменьшается Не изменяется Сначала увеличивается, а затем
- 18. Закрепим! В периодах слева направо восстановительные свойства элемента Усиливаются Ослабевают Не изменяются Сначала ослабевают, а затем
- 19. Закрепим! Атомы химических элементов алюминия и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на
- 20. Закрепим! Атомы химических элементов серы и хлора имеют различное: Значение зарядов ядер атомов; Число электронов на
- 21. В пределах одной А группы 1. Возрастают: I А Li +3 Na +11 K +19 Rb
- 22. В пределах одной А группы 2. Уменьшаются: VII А F +9 Cl +17 Br +35 I
- 23. В пределах одной А группы 3. Не изменяются: II А Be +4 Mg +12 Ca +20
- 24. Закрепим! В главных подгруппах снизу вверх заряд ядра атома Увеличивается Уменьшается Не изменяется Сначала увеличивается, а
- 25. Закрепим! В главных подгруппах снизу вверх число электронов на внешнем уровне Увеличивается Уменьшается Не изменяется Сначала
- 26. Закрепим! В главных подгруппах снизу вверх окислительные свойства элемента Усиливаются Ослабевают Не изменяется Сначала увеличивается, а
- 27. Закрепим! Атомы химических элементов углерода и кремния имеют одинаковое: Значение зарядов ядер атомов; Число электронов на
- 29. Скачать презентацию



















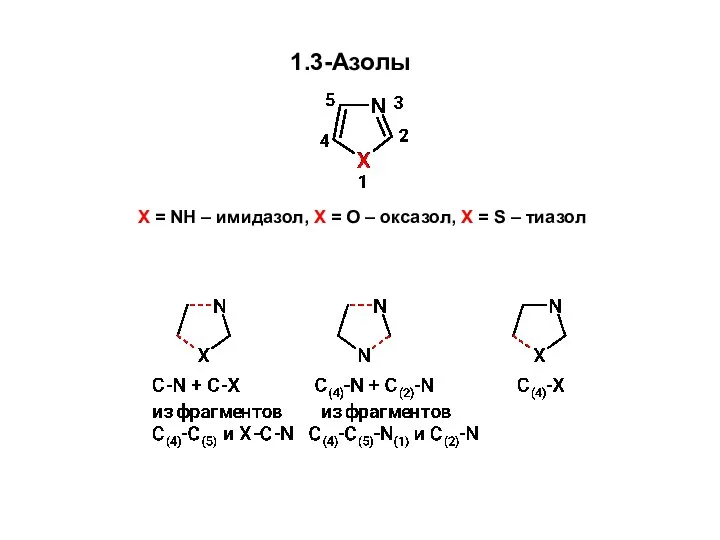 Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N
Образование связей C-N и C-X Синтез 1,3-азолов из углеродного фрагмента С(4)-С(5) и фрагмента X-C-N Элементы термодинамики. Кинетика химических реакций
Элементы термодинамики. Кинетика химических реакций Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) Электролиз кезіндегі химиялық процестер
Электролиз кезіндегі химиялық процестер Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Химия и производство
Химия и производство Вуглеводи
Вуглеводи Жасыл химия
Жасыл химия Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства
Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства Виды камней
Виды камней Теории химической кинетики. Лекция 4
Теории химической кинетики. Лекция 4 Роль хімії в природі
Роль хімії в природі Introduction to Biochemistry
Introduction to Biochemistry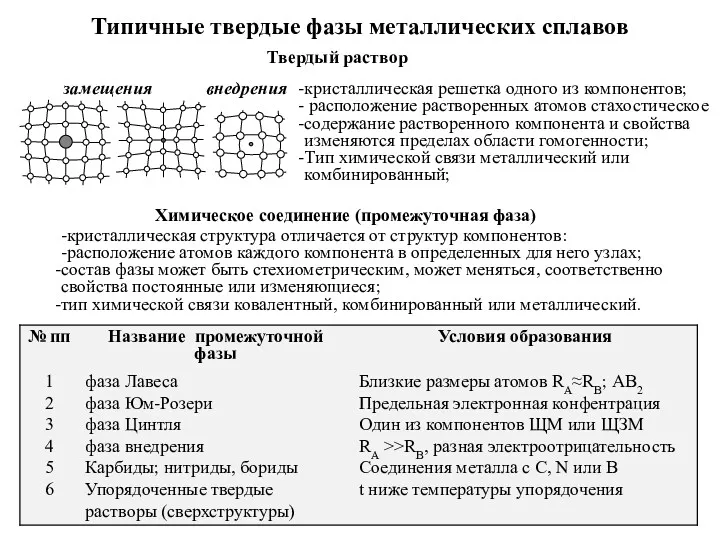 Типичные твердые фазы металлических сплавов
Типичные твердые фазы металлических сплавов Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Рождение органической химии
Рождение органической химии Электрохимические системы
Электрохимические системы Адсорбция
Адсорбция Метаболизм жирных кислот
Метаболизм жирных кислот Соли аммония
Соли аммония Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Металлы, их положение в ПСХЭ, физические и химические свойства
Металлы, их положение в ПСХЭ, физические и химические свойства Резина. Свойства резины
Резина. Свойства резины Строение и свойства циклоалканов
Строение и свойства циклоалканов Спирти. Хімічні властивості
Спирти. Хімічні властивості Вода - основа жизни
Вода - основа жизни Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Общая характеристика неметаллов
Общая характеристика неметаллов