Содержание
- 2. Кислотно-основное титрование Метод определения концентрации кислот или оснований, основанный на реакции нейтрализации. В теплоэнергетике методом кислотно-основного
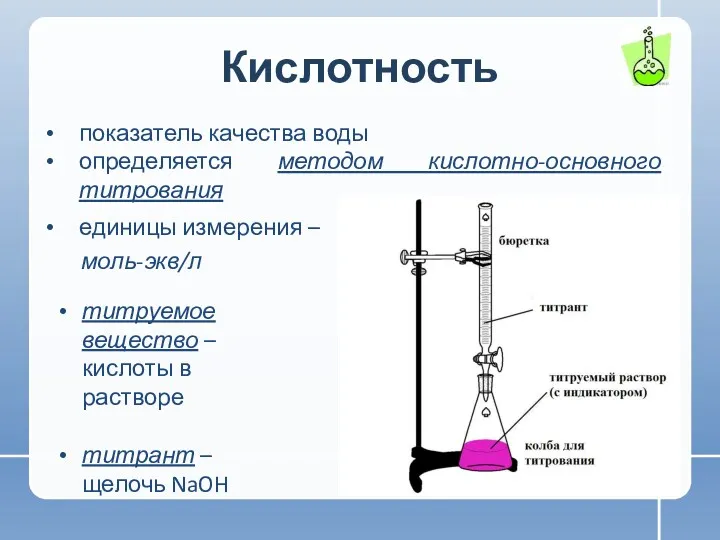
- 3. Кислотность единицы измерения – моль-экв/л показатель качества воды определяется методом кислотно-основного титрования титруемое вещество – кислоты
- 4. Кислотность Индикаторы – фенолфталеин (рН=8,0-10,0) метилоранж (рН=3,1-4,4)
- 5. Кислотность Кривая титрования смеси кислот (НСl и СН3СООН) раствором NaOH 1 точка эквивалентности – сильные кислоты:
- 6. Кислотность Чтобы узнать концентрацию угольной кислоты по II ступени и фосфорной по III используется метод обратного
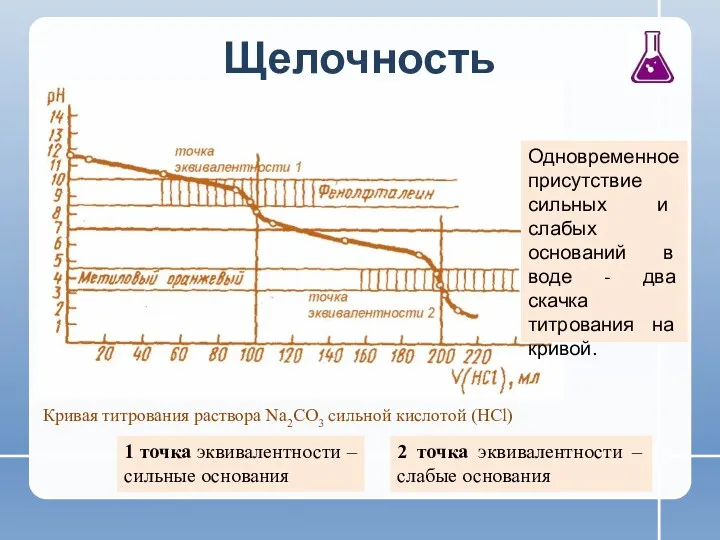
- 7. Щелочность показатель качества воды определяется методом кислотно-основного титрования единицы измерения – моль-экв/л
- 8. Щелочность Виды щелочности
- 9. Щелочность 1 точка эквивалентности – сильные основания Одновременное присутствие сильных и слабых оснований в воде -
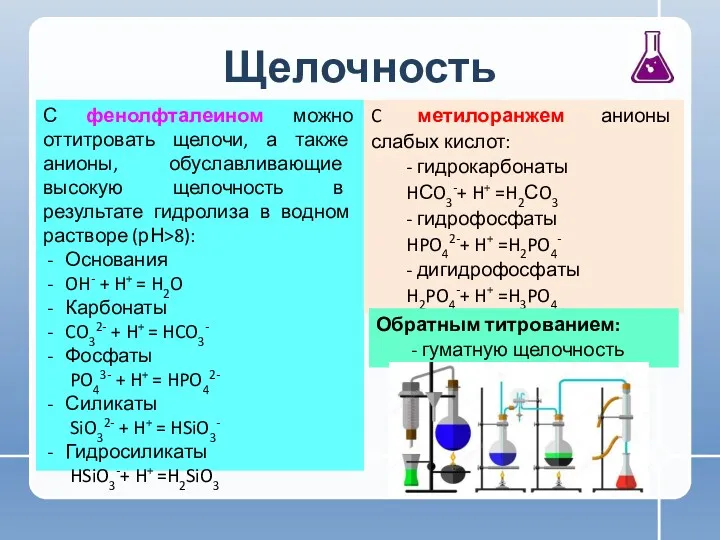
- 10. Щелочность С фенолфталеином можно оттитровать щелочи, а также анионы, обуславливающие высокую щелочность в результате гидролиза в
- 11. Жесткость Для определения общей жесткости воды используется метод комплексонометрического титрования Комплексонометрическое титрование – титриметрический метод количественного
- 12. Жесткость Хелатные (клешневидные) полидентантные комплексные соединения – это те, в которых лиганды при взаимодействии с комплексообразователем
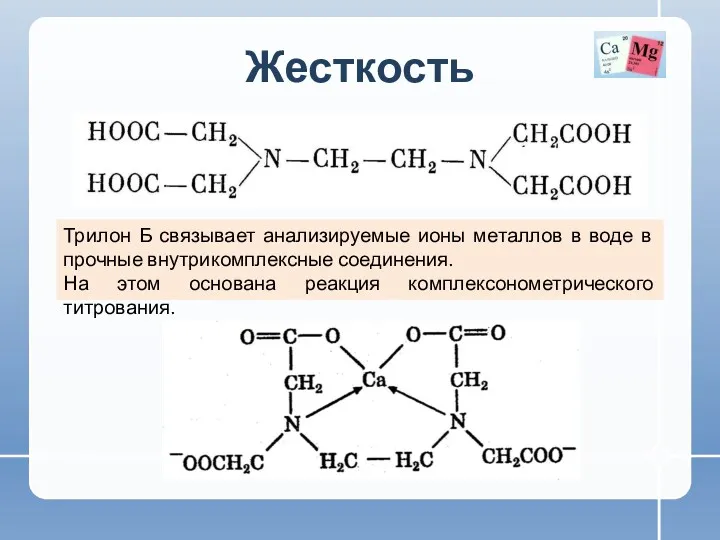
- 13. Жесткость Трилон Б связывает анализируемые ионы металлов в воде в прочные внутрикомплексные соединения. На этом основана
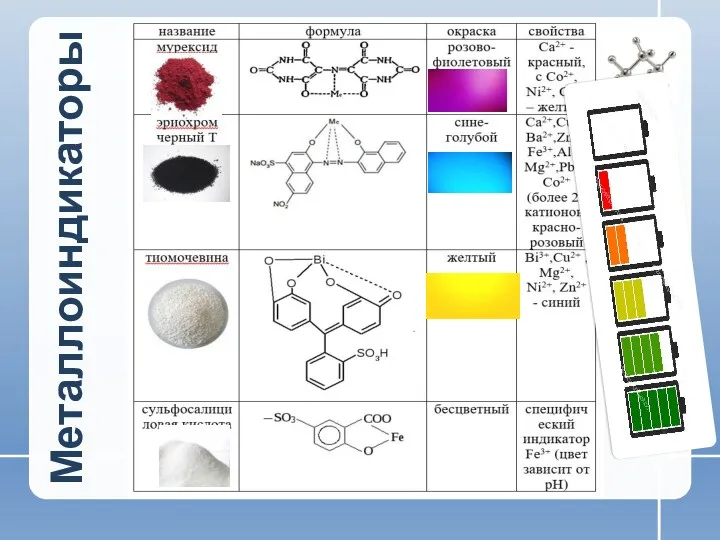
- 14. Металлоиндикаторы Для обнаружения конечной точки титрования обычно используют металлоиндикаторы – вещества, которые образуют с ионами металлов
- 15. Металлоиндикаторы При последующем титровании полученного раствора MeInd трилоном Б комплекс индикатора с металлом полностью разрушается, замещаясь
- 16. Для успешного обнаружения конечной точки титрования с помощью металлохромного индикатора необходимы условия: комплекс MеInd должен быть
- 17. Металлоиндикаторы
- 18. Окисляемость
- 19. Окисляемость Бихроматная окисляемость показатель более правильный, так как при взаимодействии с бихроматом окисляется около 90% органических
- 20. Окисляемость Бихроматная окисляемость: Все органические примеси в воде окисляют избытком бихромата калия в кислой среде: CqHmOnNjSp
- 21. Окисляемость Перманганатная окисляемость: Все органические примеси в воде окисляют избытком перманганата калия в кислой среде: CqHmOnNjSp
- 23. Скачать презентацию














 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Кремний и его соединения
Кремний и его соединения Водородная связь
Водородная связь Природные источники углеводородов, их переработка, применение и экологические проблемы
Природные источники углеводородов, их переработка, применение и экологические проблемы Металлы и их свойства. Способы получения
Металлы и их свойства. Способы получения Органическая химия. Вещества
Органическая химия. Вещества Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Кислород
Кислород Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Прочность полимеров
Прочность полимеров Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Буферные растворы
Буферные растворы Місце хімії серед наук про природу
Місце хімії серед наук про природу Химические волокна
Химические волокна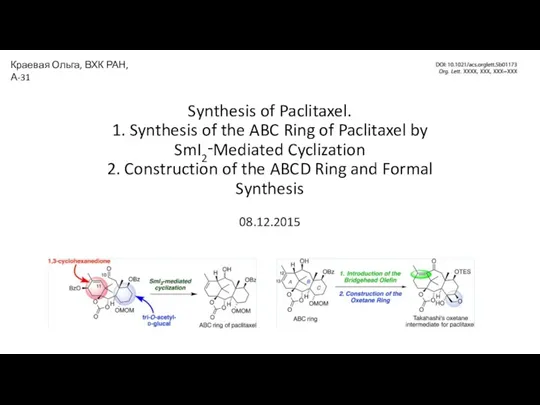 Synthesis of Paclitaxel
Synthesis of Paclitaxel Строение атома. 8 класс
Строение атома. 8 класс Лекция 3. Разновидности химических связей
Лекция 3. Разновидности химических связей Витамины. Ашылу тарихы
Витамины. Ашылу тарихы ГИА-9 Химия. А4
ГИА-9 Химия. А4 Массовая и объемная доли компонентов смеси (раствора)
Массовая и объемная доли компонентов смеси (раствора) Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Рідкі кристали
Рідкі кристали Спирты
Спирты Химические уравнения
Химические уравнения Вещества молекулярного и немолекулярного строения
Вещества молекулярного и немолекулярного строения Применение алюминия и его сплава в машиностроении
Применение алюминия и его сплава в машиностроении Химическая связь. 8 класс
Химическая связь. 8 класс