Содержание
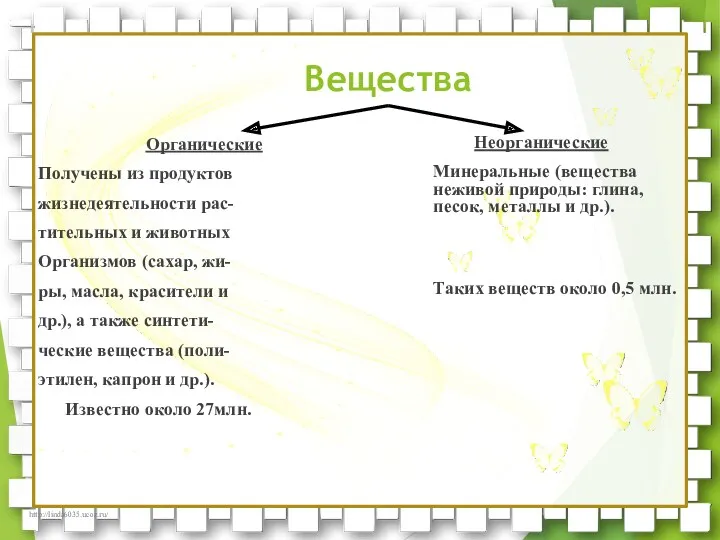
- 2. Вещества Органические Получены из продуктов жизнедеятельности рас- тительных и животных Организмов (сахар, жи- ры, масла, красители
- 3. Раздел химии, который изучает органические вещества, стали называть «органической химией» Так как в состав каждого органического
- 4. Органические вещества имеют ряд особенностей: их гораздо больше, чем неорганических веществ; орг. вещества имеют более сложное
- 5. Теория химического строения Для органической химии основополагающей стала теория химического строения (ТХС) органических веществ А.М. Бутлерова,
- 6. Основное положение ТХС: Порядок соединения атомов химических элементов в молекуле согласно их валентности называется химическим строением.
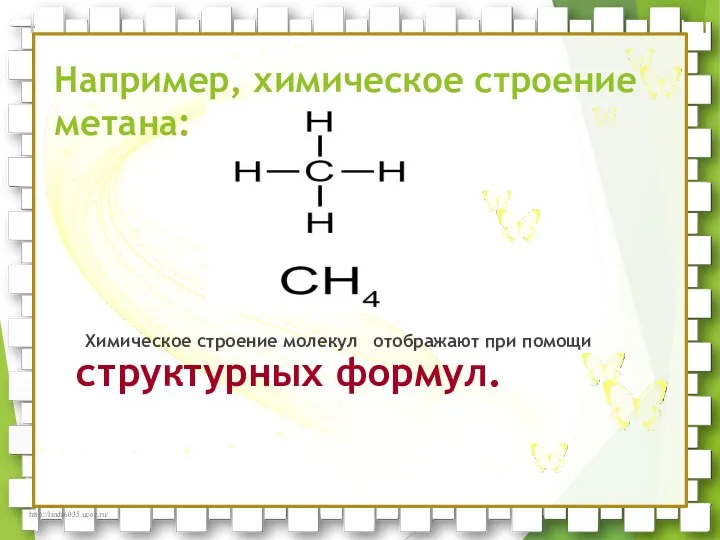
- 7. Например, химическое строение метана: Химическое строение молекул отображают при помощи структурных формул.
- 8. Как показывают формулы пропана, атомы углерода в этом веществе соединены не только с атомами водорода, но
- 9. Основное положение ТХС: Изомерия – явление существования разных веществ с одинаковым качественным и количественным составом, но
- 10. Основное положение ТХС: Вывод: свойства вещества определяются химическим, пространственным и электрическим строением. 3. Атомы или группы
- 11. Алканы Алканы – предельные углеводороды, в молекулах которых все атомы связаны одинарными связями. CnH2n + 2
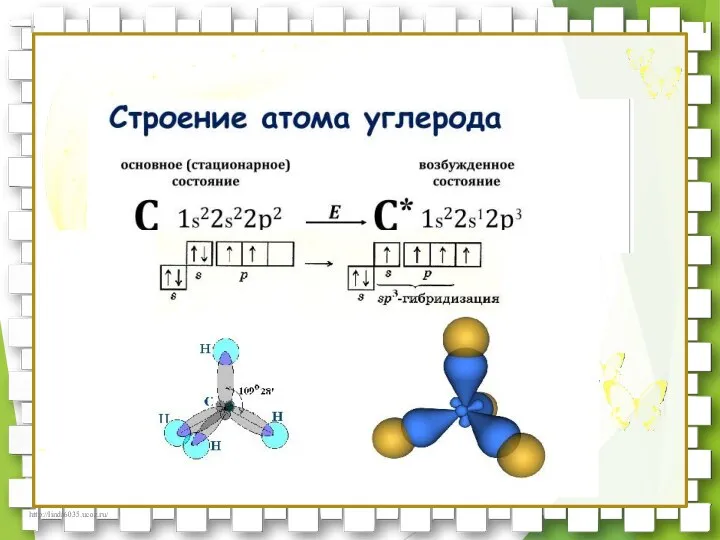
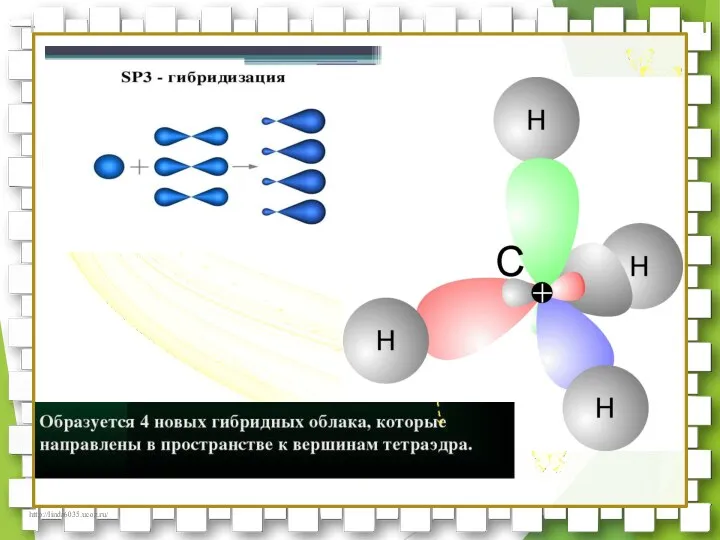
- 14. Для атомов углерода в насыщенных углеводородах (алканах) характерна sp3- гибридизация. Атом углерода в молекуле метана расположен
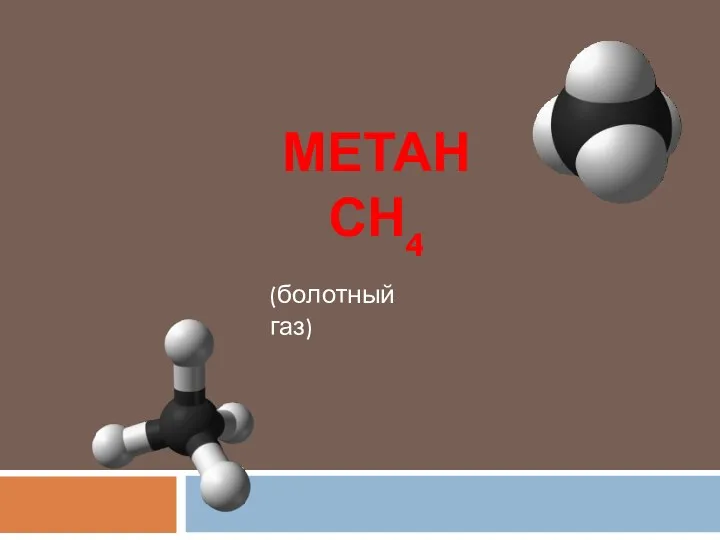
- 15. МЕТАН СН4 (болотный газ)
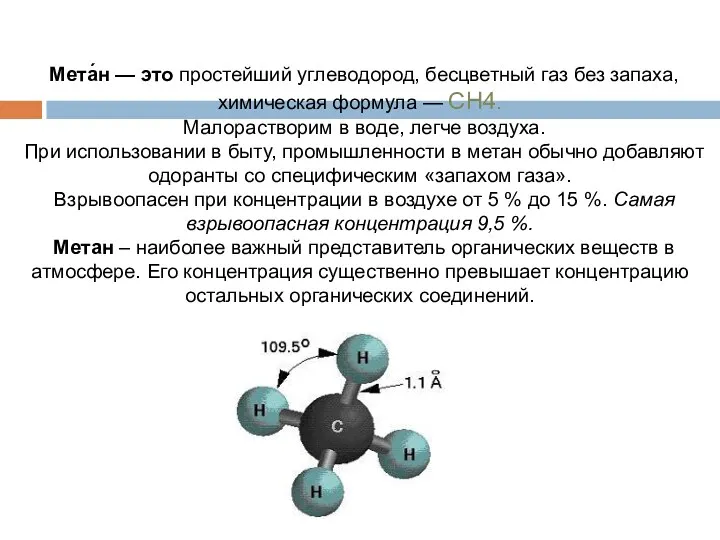
- 16. Мета́н — это простейший углеводород, бесцветный газ без запаха, химическая формула — CH4. Малорастворим в воде,
- 17. Часто этот взрывоопасный газ называют «болотным». Всем известен его специфический запах, но на самом деле это
- 18. Основной компонент природных (77—99 %), попутных нефтяных (31—90 %), рудничного и болотного газов (отсюда другие названия
- 19. абиогенный — образован как результат химических реакций неорганических соединений; биогенный — образован как результат химической трансформации
- 20. В лаборатории получают нагреванием натронной извести (смесь гидроксидов натрия и кальция) или безводного гидроксида натрия с
- 21. Применение метана - Топливо. - Сырьё в органическом синтезе.
- 22. Физиологическое действие Метан является самым физиологически безвредным газом в гомологическом ряду парафиновых углеводородов. Физиологическое действие метан
- 23. Хроническое действие метана У людей, работающих в шахтах или на производствах, где в воздухе присутствуют в
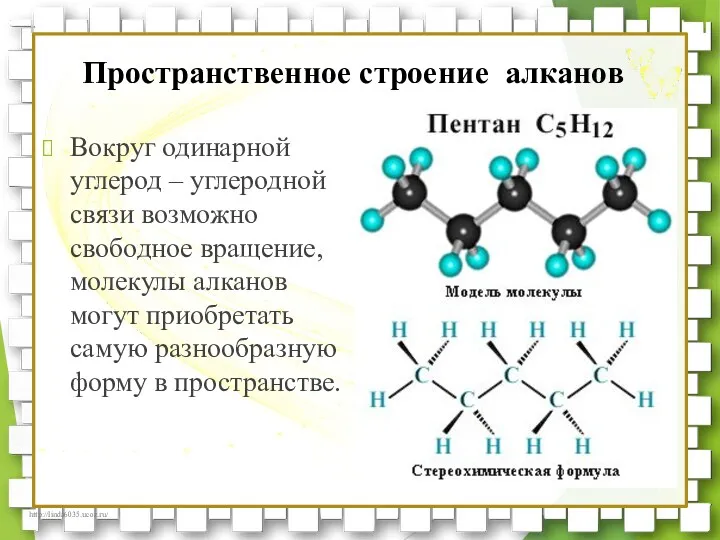
- 24. Вокруг одинарной углерод – углеродной связи возможно свободное вращение, молекулы алканов могут приобретать самую разнообразную форму
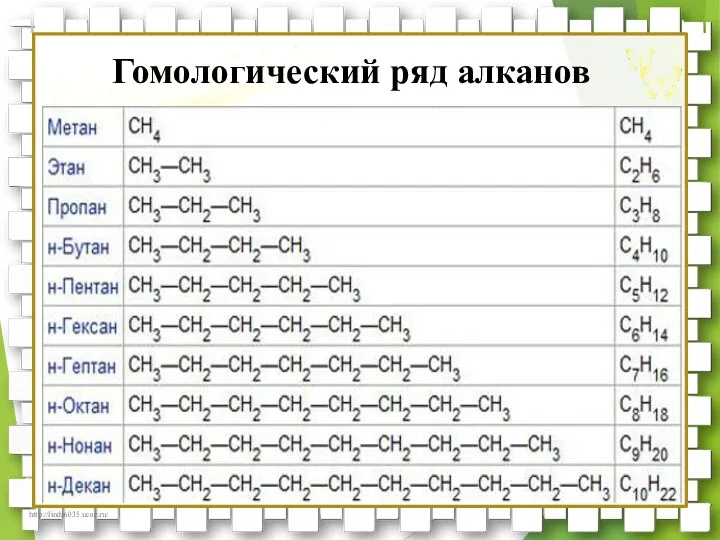
- 25. Гомологи – сходное строение и свойства, отличающиеся на одну или несколько СН2 Гомологический ряд – ряд
- 26. Гомологический ряд алканов
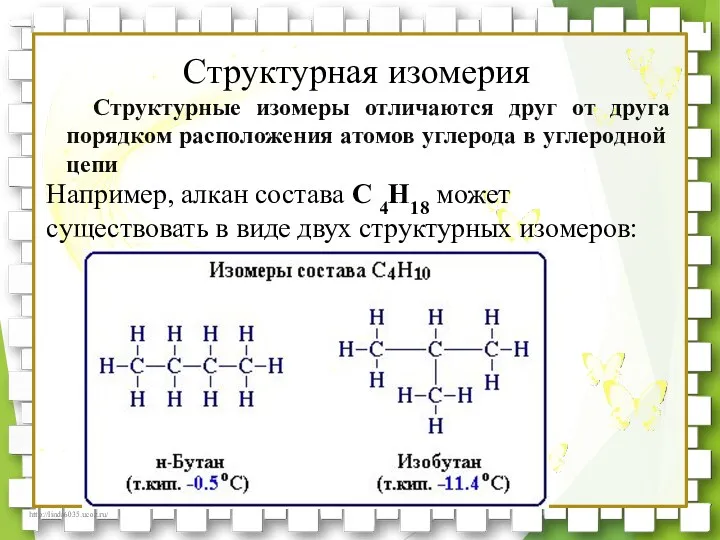
- 27. Структурные изомеры отличаются друг от друга порядком расположения атомов углерода в углеродной цепи Структурная изомерия Например,
- 28. Номенклатура органических соединений – система правил, позволяющих дать однозначное название каждому индивидуальному веществу. Это язык химии,
- 29. Правила построения названий алканов по систематической международной номенклатуре ИЮПАК
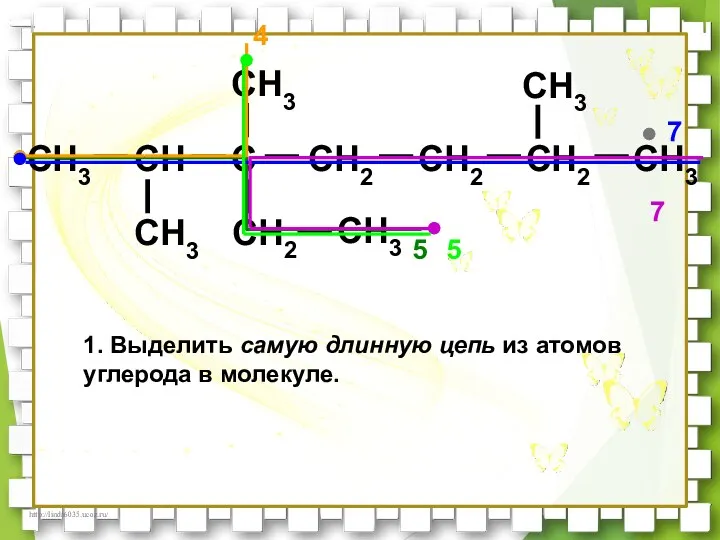
- 30. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 5 4 7 7
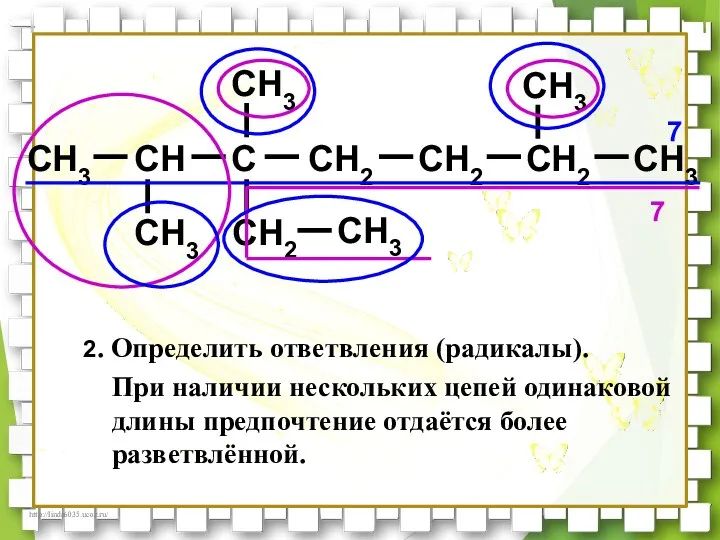
- 31. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 7 2. Определить
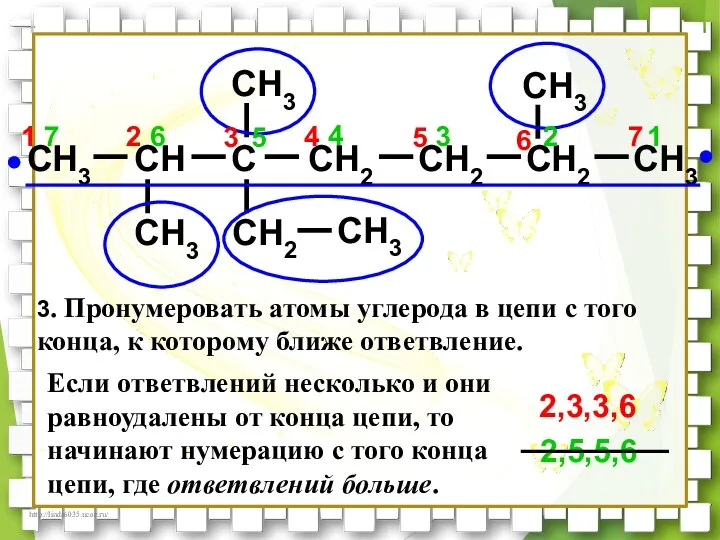
- 32. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 2 3 1
- 33. CH3 CH C CH2 CH2 CH3 CH3 CH3 CH2 CH3 CH3 CH2 7 6 5 4
- 35. Скачать презентацию



















 Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи
Общая характеристика липидов. Строение. Классификация. Функции. Переваривание и всасывание липидов в ЖКТ Роль желчи Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас
Взаємодія кисню зі складними та простими речовинами. Урок 31. 7 клас Двовимірний ямр. Приклади
Двовимірний ямр. Приклади Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Методы количественного определения металлических ядов в минерализате (деструктате)
Методы количественного определения металлических ядов в минерализате (деструктате) Углеводы: классификация, строение и физико-химические свойства
Углеводы: классификация, строение и физико-химические свойства Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева
Особенность, или Закономерность в строении атомов элементов. Периодическая система химических элементов Д.И. Менделеева Озон
Озон Пряности глазами химика
Пряности глазами химика Степень окисления химических элементов
Степень окисления химических элементов Металлы побочных подгрупп
Металлы побочных подгрупп Интересные факты о химических веществах
Интересные факты о химических веществах Спирты. Состав, строение спиртов
Спирты. Состав, строение спиртов Растворы. Электролитическая диссоциация
Растворы. Электролитическая диссоциация Химическая очистка воды
Химическая очистка воды Фосфор и его соединения
Фосфор и его соединения Хром. Физические свойства и применение
Хром. Физические свойства и применение Общая характеристика углеводов: глюкоза
Общая характеристика углеводов: глюкоза Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН)
Диссоциация воды. Водородный и гидроксильный показатели (рН и рОН) Основные сведения о строении атома
Основные сведения о строении атома Лекарственные средства, производные барбитуровой кислоты
Лекарственные средства, производные барбитуровой кислоты Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Устойчивость дисперсных систем
Устойчивость дисперсных систем Уход за волосами
Уход за волосами Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) Аминокислоты и белки. 9 класс
Аминокислоты и белки. 9 класс