Содержание
- 2. Свойства воды Вода – универсальный растворитель
- 3. Растворимость - - способность вещества образовывать с другими веществами (растворителями) однородные системы – растворы
- 4. Процесс растворения Физический : Диффузия, перемешивание Химический: Выделение или поглощение тепла, изменение цвета
- 5. Современное представление о процессе растворения: Растворение - это физико-химический процесс. При физическом явлении разрушается кристаллическая решетка
- 6. Факторы влияющие на растворимость веществ природа растворенного вещества природа растворителя температура масса растворенного вещества
- 7. Природа растворенного вещества Вещества хорошо растворимые (в 100г H2O больше 1г вещества) нерастворимые (в 100г H2O
- 8. Зависимость растворимости веществ от природы растворителя Растворение медного купороса в воде Растворение медного купороса в спирте
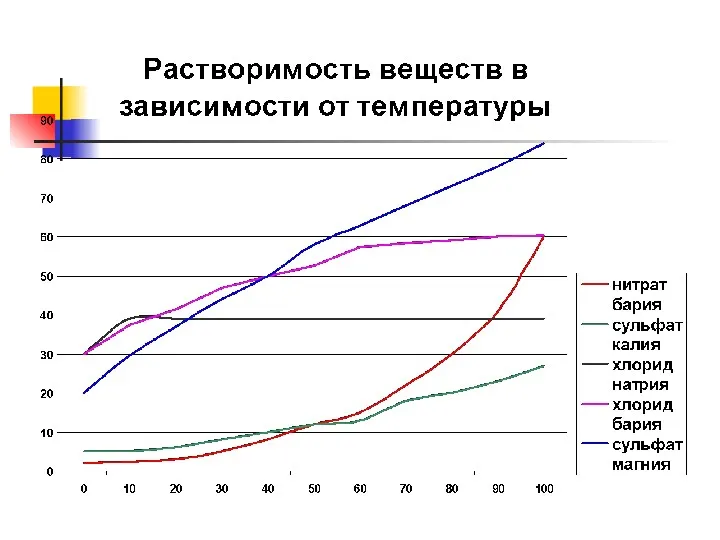
- 9. Зависимость растворимости от температуры
- 11. Классификация растворов по признаку растворимости Ненасыщенный раствор: при данной температуре находится меньше растворяемого вещества, чем в
- 12. Ответьте на вопросы: 1. От чего не зависит растворимость твердых веществ? А) от природы растворителя Б)
- 13. Применение растворов в промышленности
- 14. Применение растворов в сельском хозяйстве
- 15. Применение растворов в быту и медицине
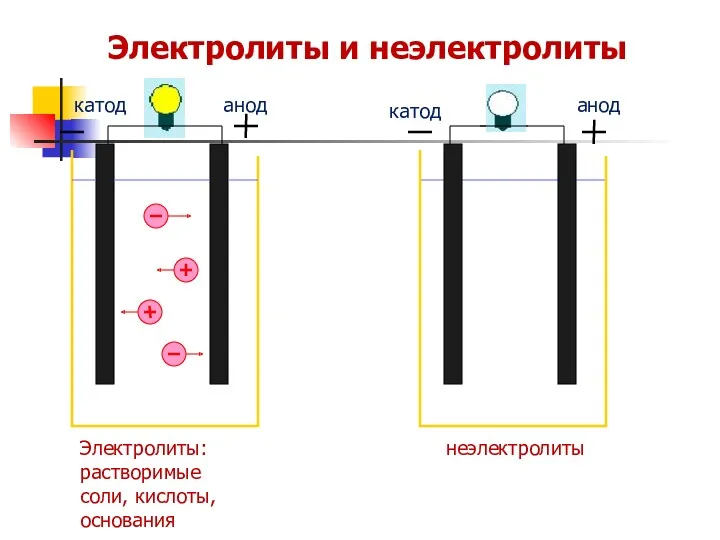
- 16. По способности водного раствора проводить электрический ток: электролиты неэлектролиты
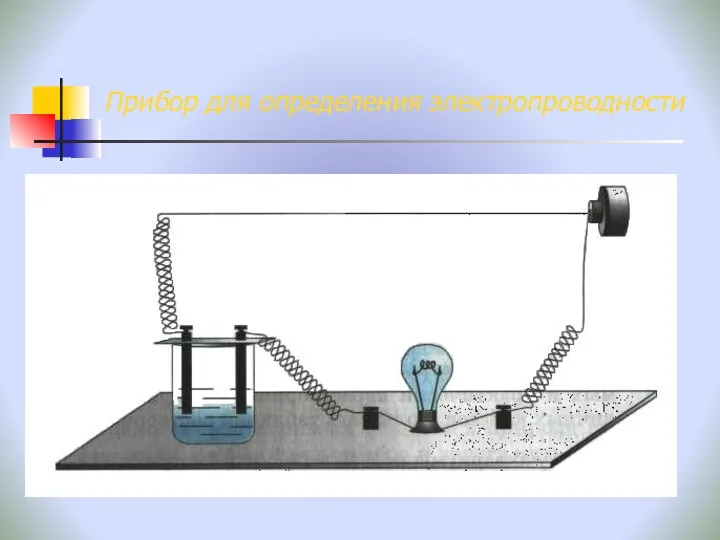
- 17. Прибор для определения электропроводности
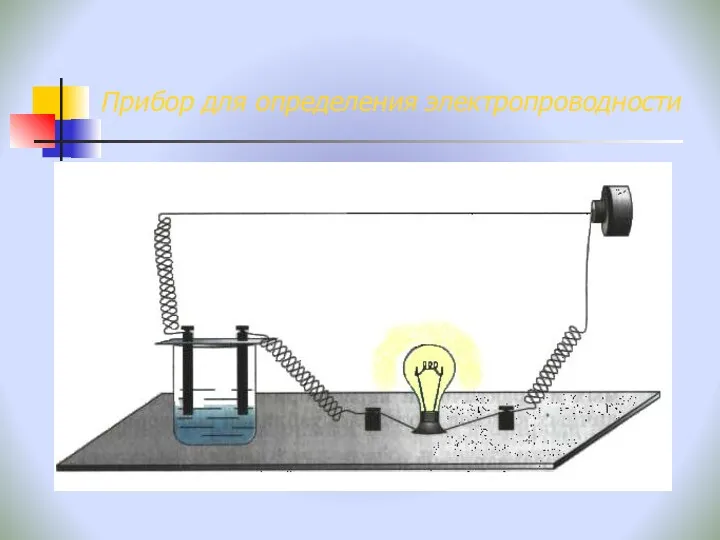
- 18. Прибор для определения электропроводности
- 19. Запомните! Вещества, растворы которых проводят электрический ток, называются электролитами. Вещества, растворы которых не проводят электрический ток,
- 20. Электролиты и неэлектролиты анод анод катод катод
- 21. Сванте Аррениус, 1887г.: причина электропроводности ─ наличие в растворе ионов, которые образуются при растворении электролита в
- 22. Процесс распада электролита на ионы в растворе называется электролитической диссоциацией (от лат. dissociatio – «разделение»
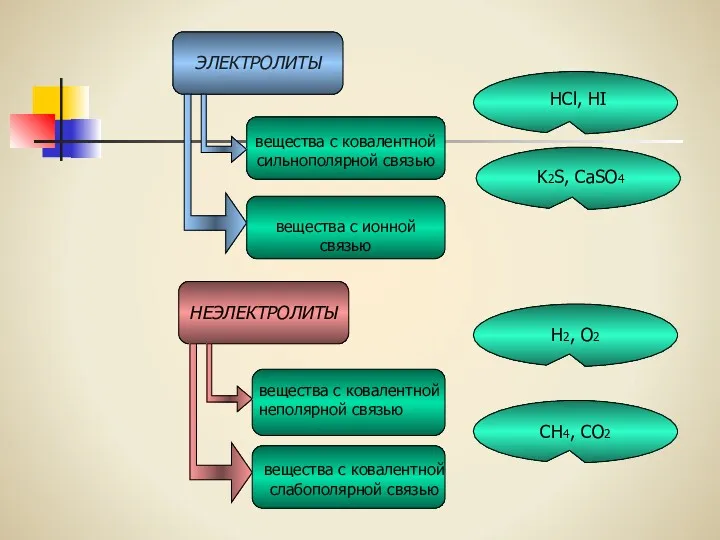
- 23. ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ вещества с ковалентной сильнополярной связью вещества с ионной связью вещества с ковалентной неполярной связью
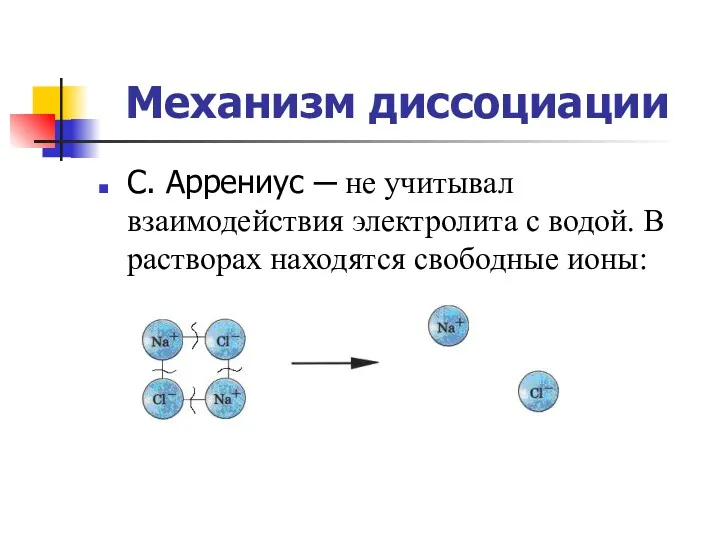
- 24. Механизм диссоциации С. Аррениус ─ не учитывал взаимодействия электролита с водой. В растворах находятся свободные ионы:
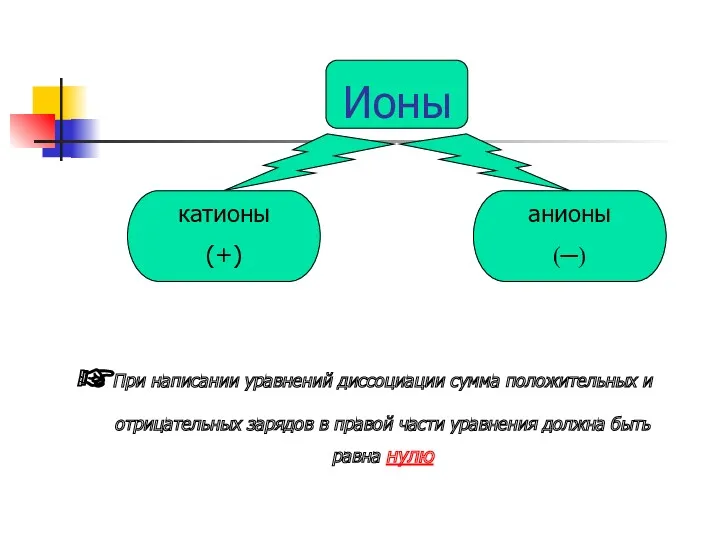
- 25. Ионы катионы (+) анионы (─) При написании уравнений диссоциации сумма положительных и отрицательных зарядов в правой
- 26. Заметка о диссоциации растворенных веществ (1889 г.) Д.И. Менделеева «Сохраняя все то, что приобретено в отношении
- 27. Механизм диссоциации И.А. Каблуков, В.А. Кистяковский ─ при растворении электролита происходит химическое взаимодействие растворенного вещества с
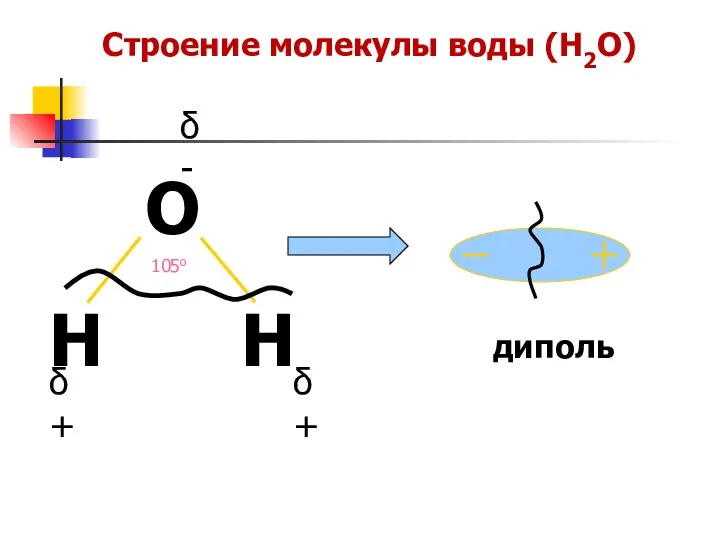
- 28. Строение молекулы воды (H2O) δ- δ+ δ+
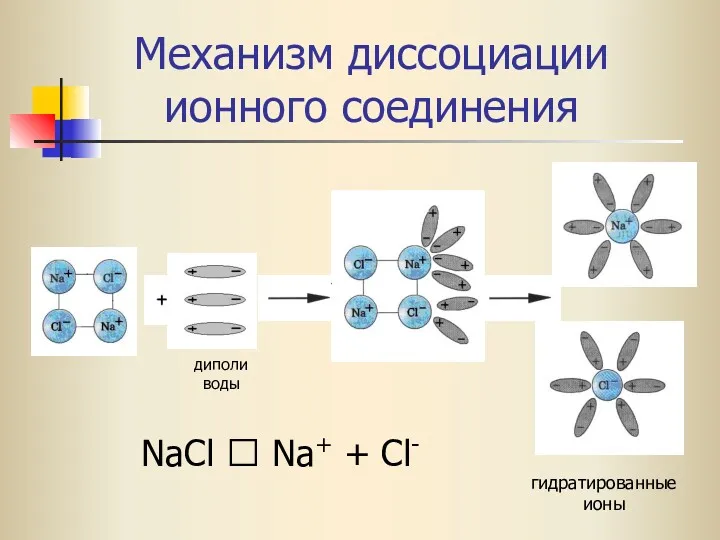
- 29. Механизм диссоциации ионного соединения NaCl ⮀ Na+ + Cl- гидратированные ионы диполи воды
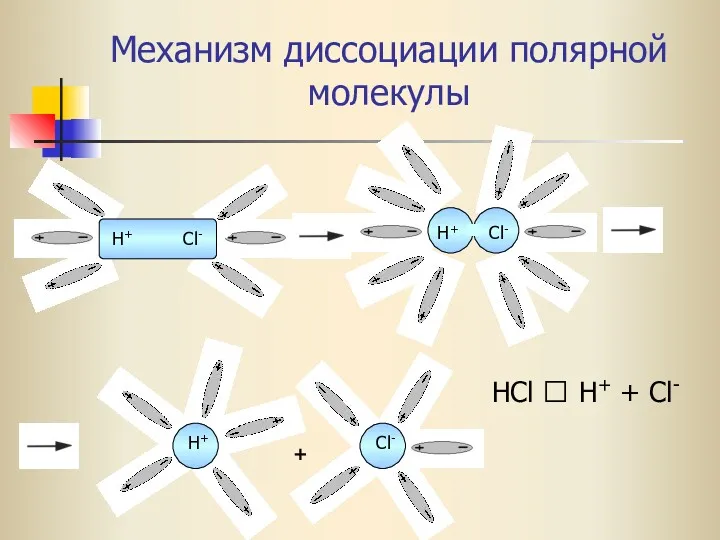
- 30. Механизм диссоциации полярной молекулы H+ Cl- H+ Cl- H+ Cl- + HCl ⮀ H+ + Cl-
- 31. Запомните! Процесс, обратный диссоциации, когда движущиеся гидратированные ионы сталкиваются и вновь объединяются между собой в молекулы,
- 32. Степень диссоциации (α)
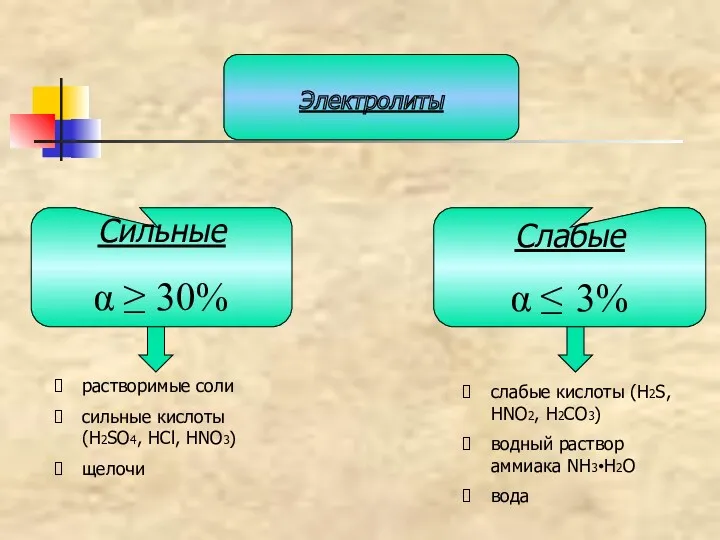
- 33. Сильные α ≥ 30% Слабые α ≤ 3% Электролиты растворимые соли сильные кислоты (H2SO4, HCl, HNO3)
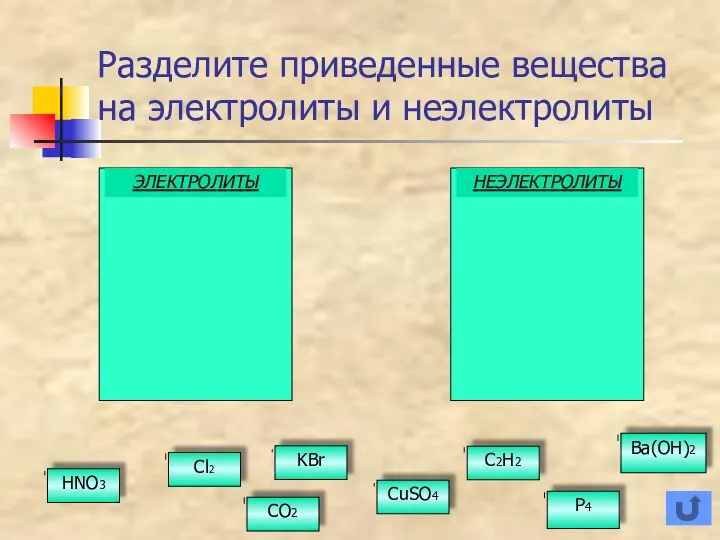
- 34. Разделите приведенные вещества на электролиты и неэлектролиты ЭЛЕКТРОЛИТЫ НЕЭЛЕКТРОЛИТЫ Cl2 HNO3 CO2 KBr CuSO4 C2H2 Ba(OH)2
- 35. Домашнее задание § § 35, 36. РТ стр. 162-165 №№ 1,4,5,7,8 Подготовить сообщения, по выбору, о
- 37. Скачать презентацию






















 Геохимия литосферы
Геохимия литосферы Диффузия вокруг нас
Диффузия вокруг нас Материаловедение. Диаграммы состояния
Материаловедение. Диаграммы состояния Hydrochloric acid HCl
Hydrochloric acid HCl Основные положения теории электролитической диссоциации
Основные положения теории электролитической диссоциации Волшебные кристалы
Волшебные кристалы Строение атома
Строение атома Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі
Көмірсу. Көмірсулардың қасиеттері. Көмірсудың метаболизмі Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Металлы, их положение в ПСХЭ, физические и химические свойства
Металлы, их положение в ПСХЭ, физические и химические свойства Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ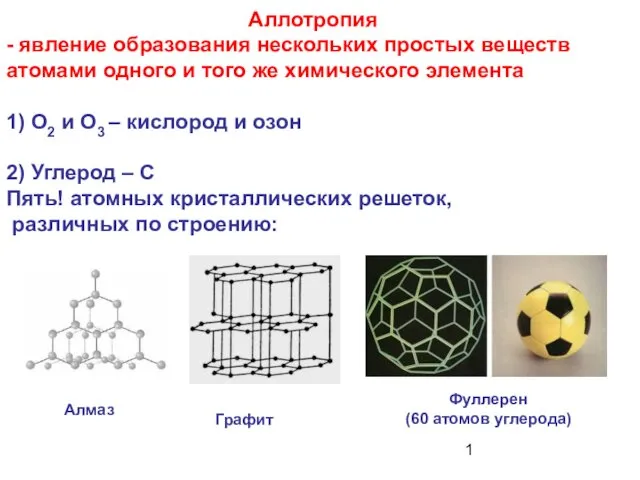 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Дистилляция в химической промышленности
Дистилляция в химической промышленности Растительные индикаторы
Растительные индикаторы Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ
Мини-проект по дисциплине: Физико-химические методы исследования и техника лабораторных работ Гетерофункциональные соединения
Гетерофункциональные соединения Фосфор и его соединения
Фосфор и его соединения Альдегиды и кетоны
Альдегиды и кетоны Поверхневі явища в дисперсних системах. Поверхнева енергія
Поверхневі явища в дисперсних системах. Поверхнева енергія Золь-гель технология. Прорыв XXI века
Золь-гель технология. Прорыв XXI века Непредельные углеводороды
Непредельные углеводороды Альтернативная бытовая химия
Альтернативная бытовая химия Простые вещества — металлы и неметаллы
Простые вещества — металлы и неметаллы Металлы и Неметаллы
Металлы и Неметаллы Коллигативные свойства растворов
Коллигативные свойства растворов Лабораторная №5. Карбоновые кислоты
Лабораторная №5. Карбоновые кислоты Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья
Важнейшие промышленные синтезы на основе переработки нефти и другого углеводородного сырья Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии