Содержание
- 2. Цели урока Обобщить сведения об ионах Закрепить умение записывать процесс диссоциации при помощи химических знаков и
- 3. ПРОВЕРЬ СВОИ ЗНАНИЯ Вещества, растворы которых проводят электрический ток, называют ……… Процесс распада электролита на ионы
- 4. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните схему) ЭЛЕКТРОЛИТЫ (по степени электролитической диссоциации )
- 5. ПРОВЕРЬ СВОИ ЗНАНИЯ (дополните таблицу)
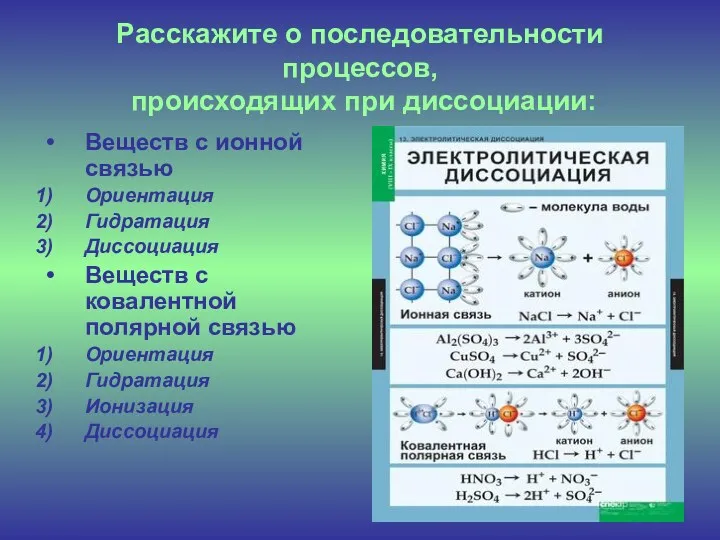
- 6. Расскажите о последовательности процессов, происходящих при диссоциации: Веществ с ионной связью Ориентация Гидратация Диссоциация Веществ с
- 7. История открытия теории электролитической диссоциации В 1887 году шведский химик Сванте Аррениус сформулировал основные положения теории
- 8. Основные положения ТЭД При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. NaCl
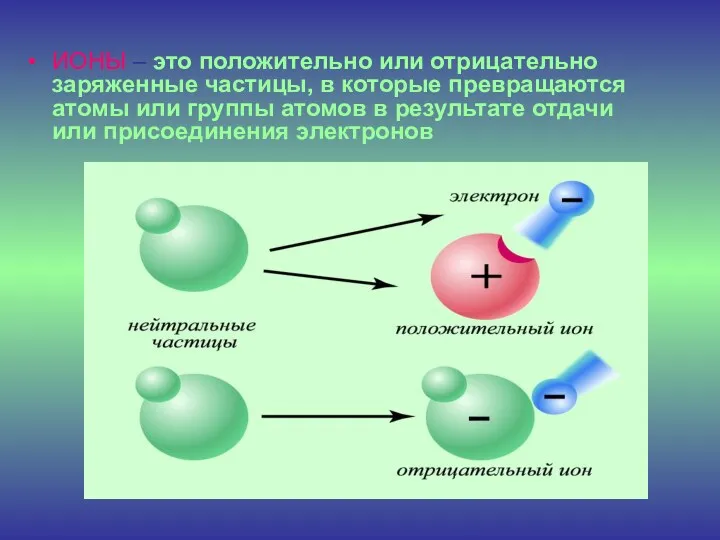
- 9. ИОНЫ – это положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в
- 10. ЭЛЕКТРОННЫЕ ФОРМУЛЫ +11Na0 2ē 8ē 1ē +11Na+ 2ē 8ē атом ион +17Cl0 2ē 8ē 7ē +17Cl-
- 11. ИОНЫ (по составу) ПРОСТЫЕ Например: Cl- K+ СЛОЖНЫЕ Например: NO3- SO42-
- 12. Основные положения ТЭД 2. Причиной диссоциации электролита в водном растворе является его гидратация, т.е. взаимодействие электролита
- 13. ИОНЫ (по наличию водной оболочки) ГИДРАТИРОВАННЫЕ Например: В растворах и кристаллогидратах CuSO4 * 5H2O Na2SO4* 10H2O
- 14. Основные положения ТЭД 3. Под действием электрического тока положительно заряженные ионы движутся к отрицательному полюсу источника
- 15. ИОНЫ (по знаку заряда) КАТИОНЫ положительно заряженные частицы АНИОН отрицательно заряженные частицы
- 16. Основные положения ТЭД 4. Электролитическая диссоциация – процесс обратимый для слабых электролитов. Наряду с процессом диссоциации
- 17. Основные положения ТЭД 5. Не все электролиты в одинаковой мере диссоциируют на ионы.
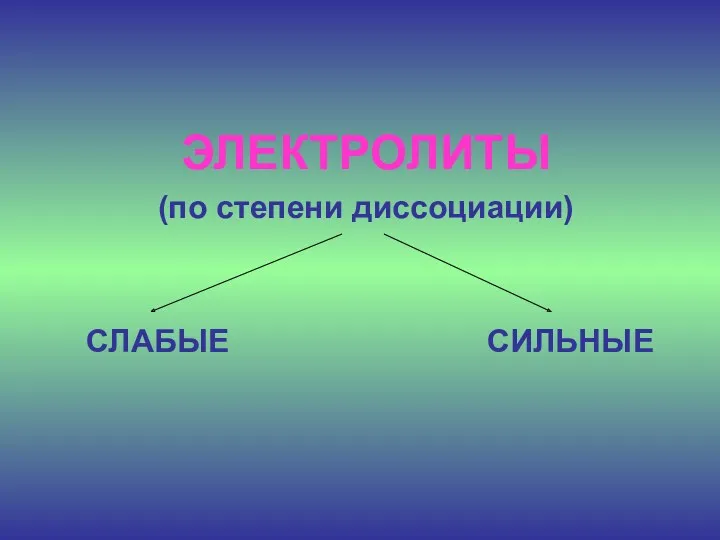
- 18. ЭЛЕКТРОЛИТЫ (по степени диссоциации) СЛАБЫЕ СИЛЬНЫЕ
- 19. Основные положения ТЭД 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при
- 20. ЭЛЕКТРОЛИТЫ (по характеру образующихся ионов) КИСЛОТЫ ОСНОВАНИЯ СОЛИ
- 21. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) HCl 2) HNO3 3) Н2SiO3
- 22. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Кислоты – это электролиты, которые диссоциируют на катионы и анионы
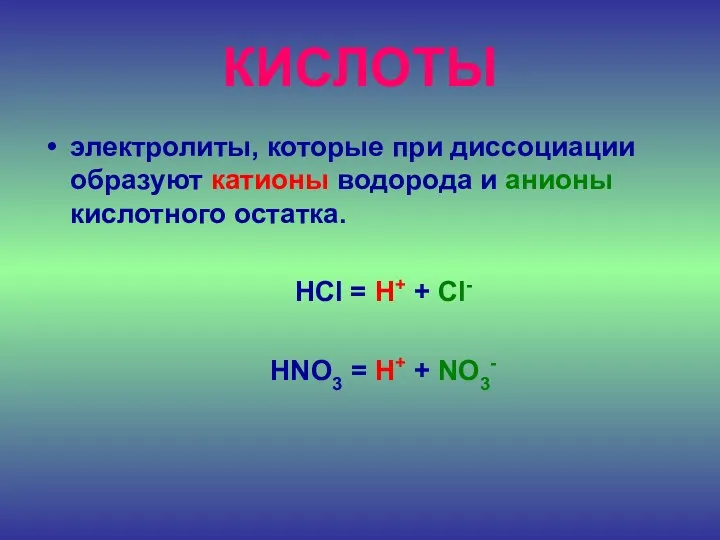
- 23. КИСЛОТЫ электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HCl = H+ +
- 24. Многоосновные кислоты диссоциируют ступенчато H3PO4 (фосфорная кислота) 1) Образование дигидрофосфат-ионов H3PO4 ↔ H+ + H2PO4- 2)
- 25. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaOH 2) KOH 3) Fe(OH)2
- 26. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Основания – это электролиты, которые диссоциируют на катионы и анионы
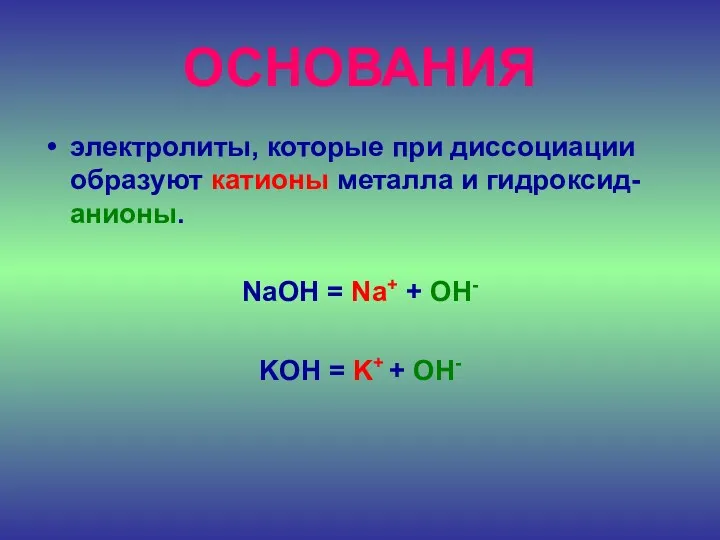
- 27. ОСНОВАНИЯ электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. NaOH = Na+ + OH- KOH
- 28. Многокислотные основания диссоциируют ступенчато Ba(OH)2 (гидроксид бария) 1) Образование гидроксо-ионов бария Ba(OH)2 ↔ OH- + BaOH+
- 29. ЗАДАНИЕ Составьте возможные уравнения электролитической диссоциации веществ в водных растворах. 1) NaCl 2) KNO3 3) BaSO4
- 30. ДОПИШИТЕ ОПРЕДЕЛЕНИЕ Cоли – это электролиты, которые диссоциируют на катионы и анионы
- 31. СОЛИ электролиты, которые при диссоциации образуют катионы металла (или аммония NH4) и анионы кислотных остатков. K3PO4
- 32. ПРОВЕРЬ СВОИ ЗНАНИЯ Пользуясь таблицей растворимости, приведите примеры трех веществ, которые в растворах образуют сульфат-ионы. Запишите
- 34. Скачать презентацию
























 Предельные углеводороды. Алканы
Предельные углеводороды. Алканы Гетерофункциональные соединения, участвующие в процессах жизнедеятельности
Гетерофункциональные соединения, участвующие в процессах жизнедеятельности Галогены (солеобразующие)
Галогены (солеобразующие) Общая характеристика неметаллов
Общая характеристика неметаллов Спирттер мен фенолдар
Спирттер мен фенолдар Химия вокруг нас
Химия вокруг нас Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот Пневмовакуум-формование
Пневмовакуум-формование Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Бордың адам ағзасына әсері. Бор дегеніміз не?
Бордың адам ағзасына әсері. Бор дегеніміз не? Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Жёсткость воды
Жёсткость воды Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis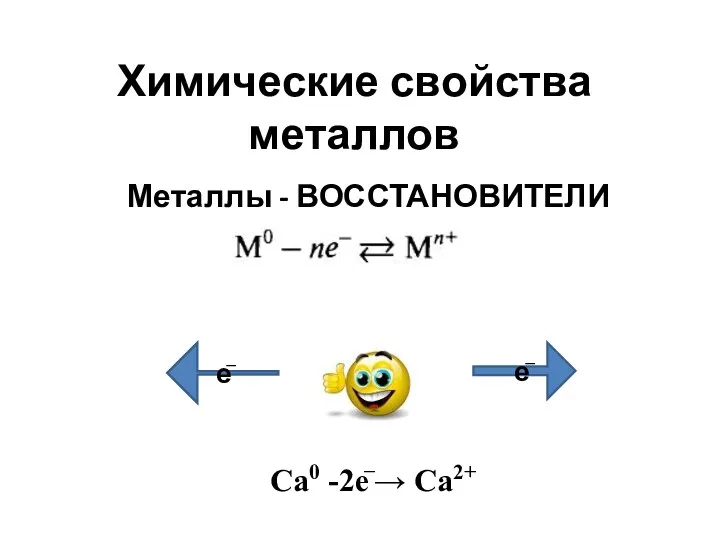 Химические свойства металлов
Химические свойства металлов Биологическая роль макро и микроэлементов. (Лекция 17)
Биологическая роль макро и микроэлементов. (Лекция 17) Химическая связь и ее типы. (11 класс)
Химическая связь и ее типы. (11 класс) Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25)
Биологически важные 5-ти и 6-ти членные гетероциклические соединения. (Лекция 25) Анализ проб воды
Анализ проб воды Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал
Мини-тақталарда немесе дәптерде қатты, сұйық және газтектес заттардың құрылысын сал Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда Минеральные удобрения
Минеральные удобрения Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Preparation for COP
Preparation for COP Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Периодические системы химических элементов
Периодические системы химических элементов