Содержание
- 2. Гидролиз по аниону Na2SiO3 + H2O → Молекулярный вид: Гидролиз по катиону не идет: Гидролиз по
- 3. Гидролиз по катиону CuSO4 + H2O → Молекулярный вид: Гидролиз по аниону не идет: Гидролиз по
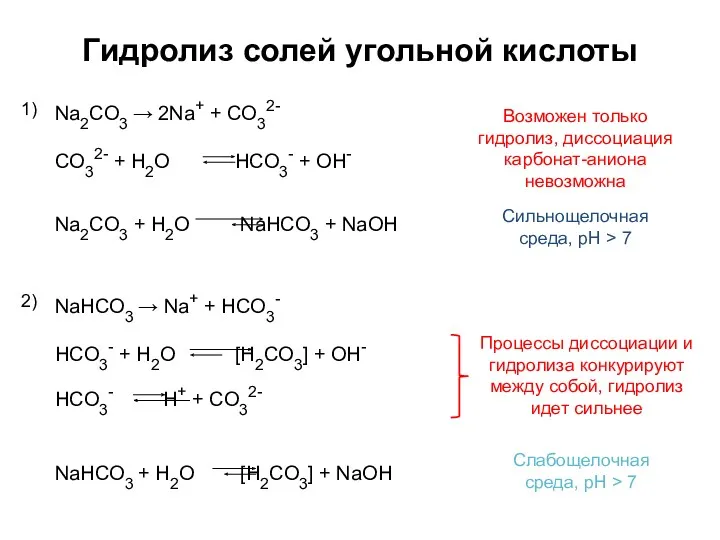
- 4. Гидролиз солей угольной кислоты Na2СO3 → 2Na+ + СO32- 1) Сильнощелочная среда, pH > 7 NaHСO3
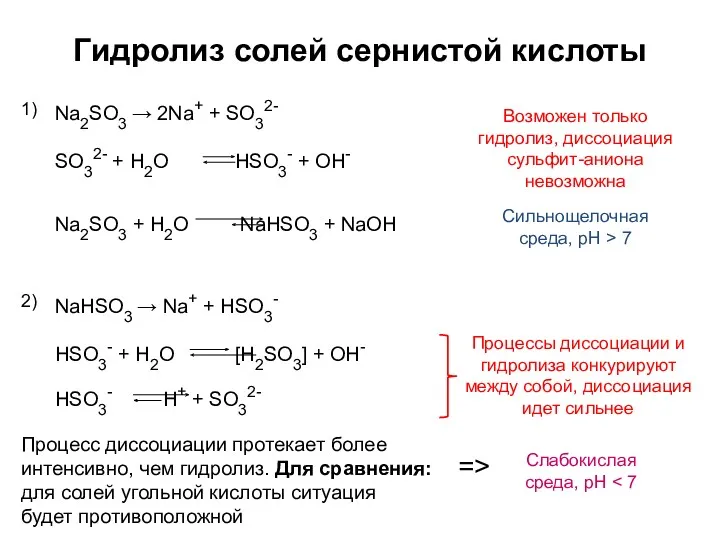
- 5. Гидролиз солей сернистой кислоты Na2SO3 → 2Na+ + SO32- 1) Сильнощелочная среда, pH > 7 NaHSO3
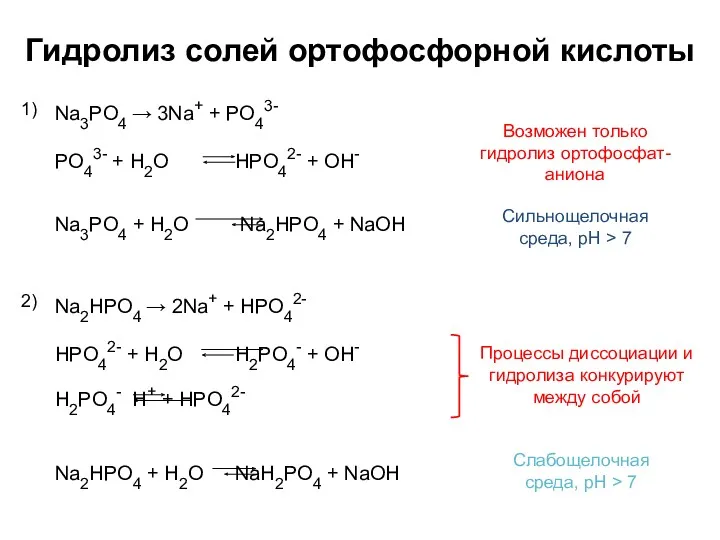
- 6. Гидролиз солей ортофосфорной кислоты Na3PO4 → 3Na+ + PO43- 1) Сильнощелочная среда, pH > 7 Na2HPO4
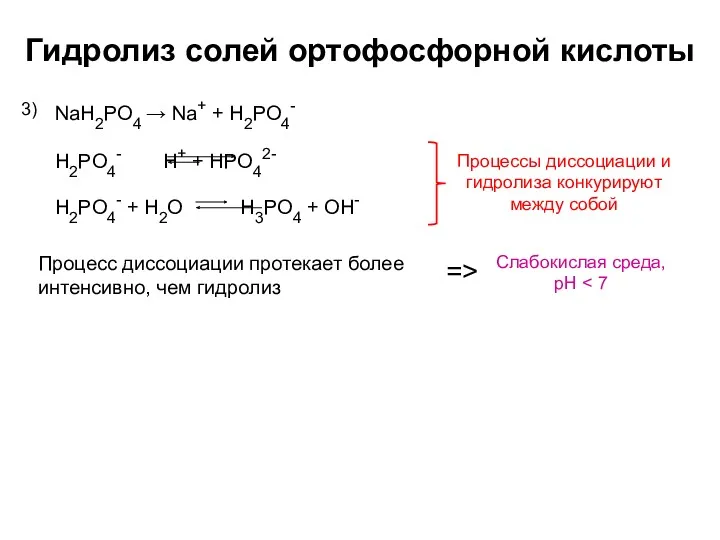
- 7. Гидролиз солей ортофосфорной кислоты NaH2PO4 → Na+ + H2PO4- 3) Слабокислая среда, pH Процесс диссоциации протекает
- 8. Необратимый гидролиз Необратимый гидролиз протекает в пяти случаях: 2) Когда протекает ОВР сопропорционирования водорода H+1 из
- 9. Гидролиз по одному иону при нагревании 1) При нагревании растворов солей, гидролизующихся по одному иону, гидролиз
- 10. Гидролиз гидридов металлов 2) При гидролизе гидридов металлов образуется молекулярный водород и соединение металла, устойчивое в
- 11. Гидролиз «солей» очень слабых кислот 3) Гидролизуются солеообразные соединения, образованные кислотами, гораздо более слабыми, чем вода
- 12. Гидролиз «солей» очень слабых кислот 3) Гидролизуются солеообразные соединения, образованные кислотами, гораздо более слабыми, чем вода
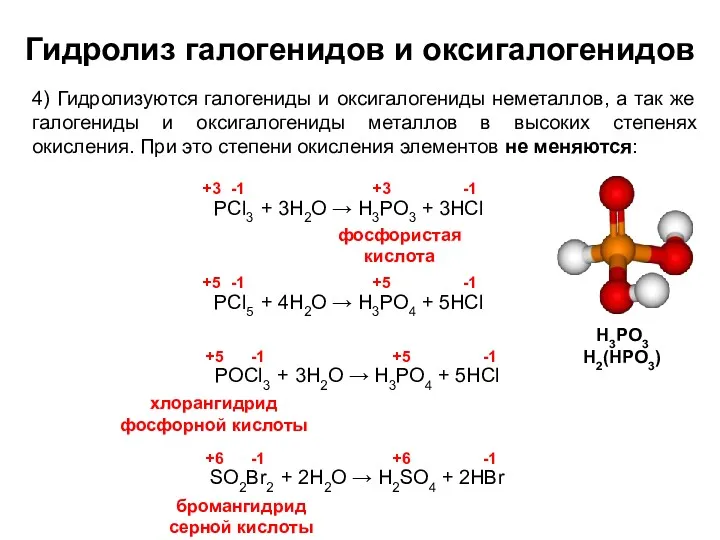
- 13. Гидролиз галогенидов и оксигалогенидов 4) Гидролизуются галогениды и оксигалогениды неметаллов, а так же галогениды и оксигалогениды
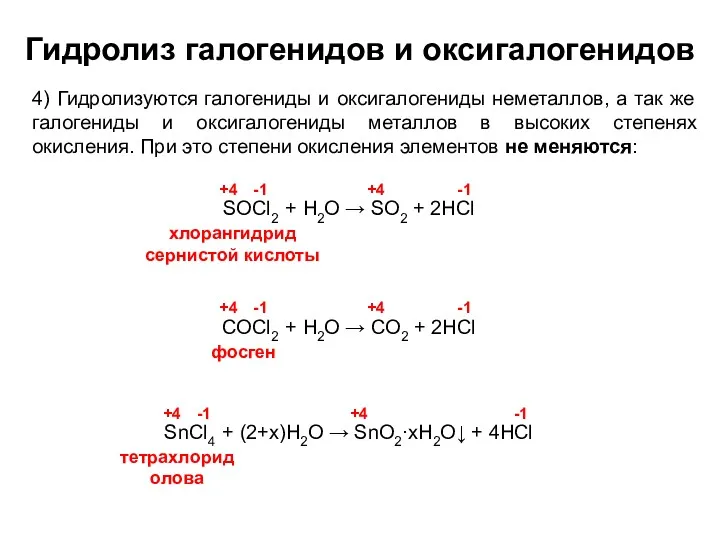
- 14. Гидролиз галогенидов и оксигалогенидов 4) Гидролизуются галогениды и оксигалогениды неметаллов, а так же галогениды и оксигалогениды
- 15. Двойной гидролиз K2S + AlCl3 + H2O → 3K2S + 2AlCl3 + 6H2O → 2Al(OH)3↓ +
- 16. Двойной гидролиз – особый случай CuCl2 + Na2CO3 + H2O → Катионы гидроксомеди (II) связываются карбонат-анионами
- 17. Двойной гидролиз – особый случай CuCl2 + Na2CO3 + H2O → 2CuCl2 + 2Na2CO3 + H2O
- 18. Двойной гидролиз – определение итоговой среды раствора CH3COONH4 Kа(CH3COOH) = 1,75·10-5 Kb(NH3·H2O) = 6,3·10-5
- 19. «Неорганический сад» Выпадают продукты совместного гидролиза солей по катиону по силикат-аниону
- 20. «Неорганический сад»
- 21. Сравнение силы кислот и оснований Чем сильнее кислота, тем его сопряженное основание слабее. Сильная кислота –
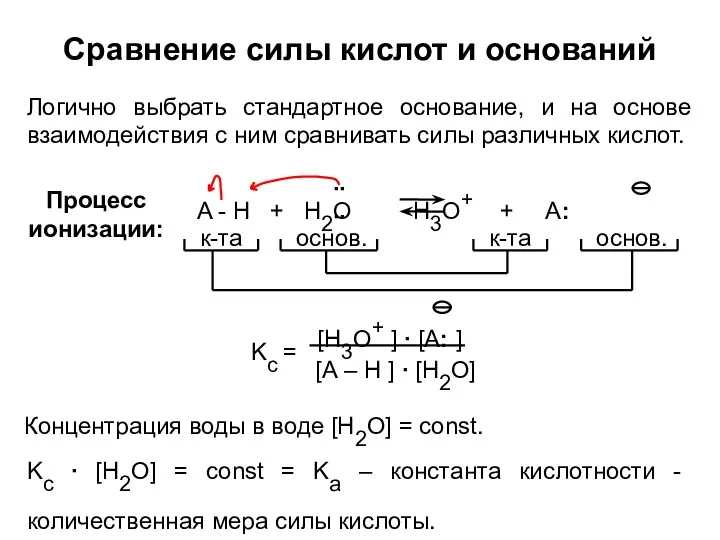
- 22. Сравнение силы кислот и оснований Логично выбрать стандартное основание, и на основе взаимодействия с ним сравнивать
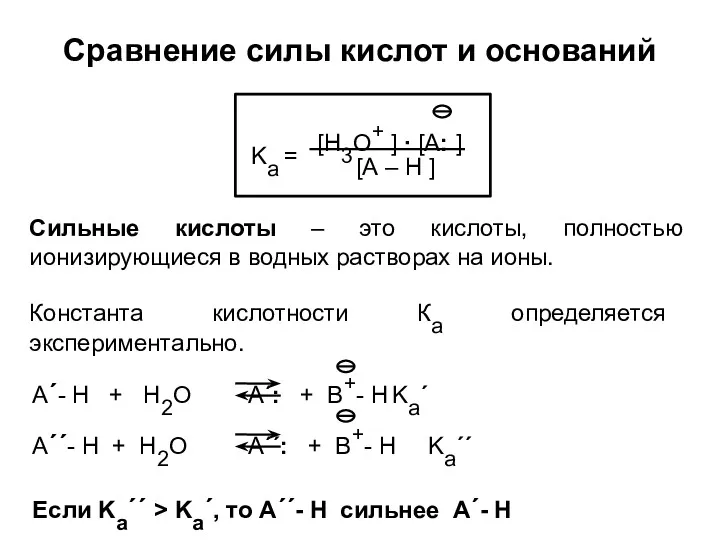
- 23. Сравнение силы кислот и оснований Сильные кислоты – это кислоты, полностью ионизирующиеся в водных растворах на
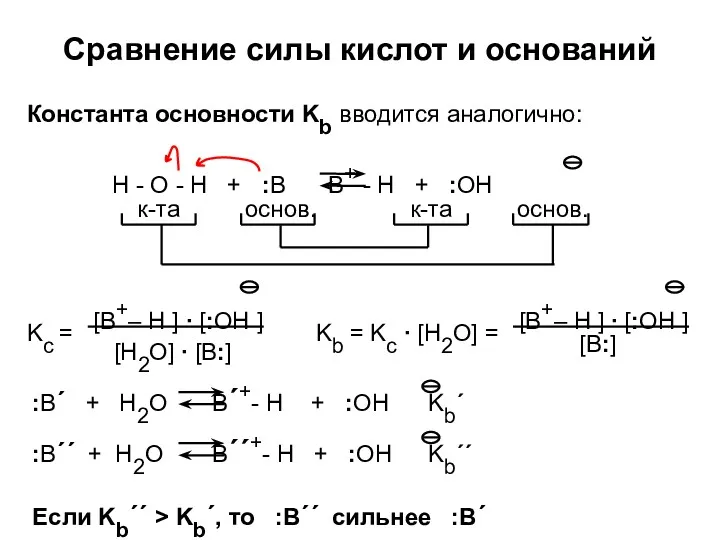
- 24. Сравнение силы кислот и оснований Константа основности Kb вводится аналогично: Если Kb´´ > Kb´, то :B´´
- 25. Двойной гидролиз – определение итоговой среды раствора CH3COONH4 Kа(CH3COOH) = 1,75·10-5 Kb(NH3·H2O) = 6,3·10-5 Среда слабощелочная,
- 27. Скачать презентацию















 Carbohydrates (sugars)
Carbohydrates (sugars) Дисперсные системы в атмосфере
Дисперсные системы в атмосфере Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева
Свинец — простое вещество, металл, химический элемент IV группы таблицы Менделеева Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение
Фенолы: понятие, классификация, номенклатура, изомерия, получение, физические свойства, химические свойства, применение Физические и химические явления. Условия течения и признаки химических реакций
Физические и химические явления. Условия течения и признаки химических реакций Алюминий. Строение
Алюминий. Строение Етери та естери. Хімічні властивості
Етери та естери. Хімічні властивості Азотовмисні та елементоорганічні сполуки
Азотовмисні та елементоорганічні сполуки Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Коллигативные свойства растворов
Коллигативные свойства растворов Элементы теории горения
Элементы теории горения Physiology lab
Physiology lab Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ
Особенности выбора связующих и наполнителей для производства деталей машин из ПКМ Высокомолекулярные соединения
Высокомолекулярные соединения Сахароза
Сахароза Физико-химия дисперсных систем. Физико-химия поверхностных явлений
Физико-химия дисперсных систем. Физико-химия поверхностных явлений Соединения железа
Соединения железа Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Значение органической химии в жизни человека
Значение органической химии в жизни человека Степень окисления в органической химии
Степень окисления в органической химии Скорость химических реакций. Катализ. Химическое равновесие
Скорость химических реакций. Катализ. Химическое равновесие Ионная связь
Ионная связь Строение атома
Строение атома Ферменттер. Зерттелу тарихы
Ферменттер. Зерттелу тарихы Химиялық реакциялардың жылдамдығы
Химиялық реакциялардың жылдамдығы Происхождение рибосомы, белкового синтеза и генетического кода
Происхождение рибосомы, белкового синтеза и генетического кода Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Химический элемент титан
Химический элемент титан