Содержание
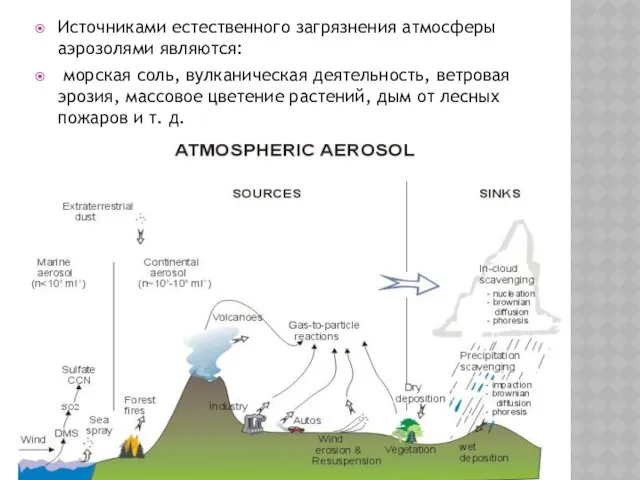
- 2. Источниками естественного загрязнения атмосферы аэрозолями являются: морская соль, вулканическая деятельность, ветровая эрозия, массовое цветение растений, дым
- 3. Морская соль. Источником неорганических солей в атмосфере являются морские брызги, переносимые ветром. Частицы соли из океанов
- 4. Объемы поступления в атмосферу морской соли в виде аэрозольных частиц составляют 1500 х109 тонн в год
- 5. ВУЛКАНИЧЕСКИЕ ВЫБРОСЫ. Источник — действующие вулканы. Загрязнения вулканического происхождения отличаются высокой активностью и влияют на химические
- 6. Вредное действие вулканических выбросов обусловлено наличием различных газов, а также вулканической пыли, количество которой достигает 50
- 7. Пыль. Источником пыли являются почвы аридных зон — полупустынь и пустынь. Общее количество поступления в атмосферу
- 8. Лесные пожары. Крупными источниками аэрозольных частиц (сажи) являются лесные пожары, за счет которых в атмосферу поступает
- 9. Метеоритная пыль. В верхние слои атмосферы поступает ~ 1 Гт/год метеоритной пыли. Металлы, привносимые метеоритами, могут
- 11. ОСНОВНЫЕ КРИТЕРИИ УСТОЙЧИВОСТИ АЭРОЗОЛЕЙ Для существования устойчивого аэрозоля необходимо выполнение следующих критериев (условий): 1) низкая скорость
- 12. Первый критерий. Согласно уравнению Стокса, скорость седиментации Wg прямо пропорциональна квадрату радиуса частицы r, плотности частицы
- 13. Второй критерий связан с броуновским движением аэрозольных частиц. Броуновское движение наблюдается для частиц радиусом меньше 0,5
- 14. Важным следствием броуновского движения является столкновение частиц и их последующая коагуляция.
- 15. Скорость коагуляции пропорциональна коэффициенту диффузии частиц и квадрату концентрации частиц. Поэтому броуновское движение способствует процессу укрупнения
- 16. Третий критерий выполняется, если в численном выражении площадь поверхности частицы превосходит объем этой частицы, по крайней
- 17. Четвертый критерий. Выполнимость этого критерия определяется величиной гидродинамического критерия Рейнольдса: W d ρ/μ где W —
- 18. ОБЛАСТЬ МАСШТАБОВ РАЗМЕРОВ ДИСПЕРСНЫХ ЧАСТИЦ В АЭРОЗОЛЯХ ДОСТИГАЕТ 6–7 ПОРЯДКОВ. Размер 1 см — это размер,
- 19. Размер 10−2 см (100 мкм) — это размер капель измороси (скорость седиментации 100 см/с). Частицы таких
- 20. Частицы размером 10−3 см (10 мкм) формируют важную группу атмосферных аэрозолей, образующих, в частности, облака. Скорость
- 21. Частицы размером 10−4 см (1 мкм) на жаргоне специалистов по атмосферным аэрозолям называются «гигантскими». Скорость падения
- 22. Нижним пределом размера аэрозольной частицы считается величина порядка 1 нм = 10−7 см. Частицы таких размеров
- 23. ВЫВОДЫ Для существования аэрозоля необходимо выполнение ряда критериев Устойчивые дисперсные системы характеризуются определенным распределением частиц по
- 24. ХИМИЯ ОКРУЖАЮЩЕЙ СРЕДЫ 10 февраля 2010 г. ООС-337
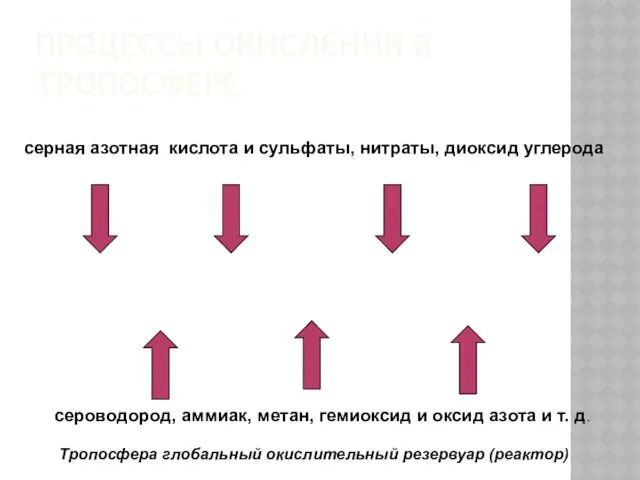
- 25. ПРОЦЕССЫ ОКИСЛЕНИЯ В ТРОПОСФЕРЕ сероводород, аммиак, метан, гемиоксид и оксид азота и т. д. серная азотная
- 26. ПРОЦЕССЫ ОКИСЛЕНИЯ ПРИМЕСЕЙ В ТРОПОСФЕРЕ Непосредственно в газовой фазе; В растворе, когда окислению предшествует абсорбция частицами
- 27. МЕХАНИЗМ ОБРАЗОВАНИЯ РАДИКАЛОВ В АТМОСФЕРЕ В тропосфере свободные радикалы образуются при химических превращениях с участием синглетно
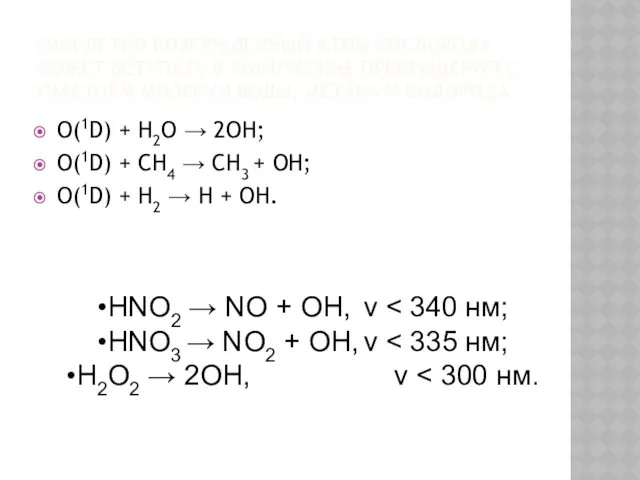
- 28. СИНГЛЕТНО ВОЗБУЖДЕННЫЙ АТОМ КИСЛОРОДА МОЖЕТ ВСТУПАТЬ В ХИМИЧЕСКИЕ ПРЕВРАЩЕНИЯ С УЧАСТИЕМ МОЛЕКУЛ ВОДЫ, МЕТАНА И ВОДОРОДА:
- 29. ОСНОВНЫЕ РЕАКЦИИ ГИДРОКСИДНОГО РАДИКАЛА И ОБРАЗОВАНИЕ ГИДРОПЕРОКСИДНОГО РАДИКАЛА CO + OH → CO2 + H; CH4
- 30. РЕГЕНЕРАЦИЯ ГИДРОКСИДНОГО РАДИКАЛА В результате реакции гидроксидного радикала с оксидом азота или озоном вновь получаем гидроксидный
- 31. Химические превращения органических соединений в тропосфере Превращение метана и его гомологов протекает по радикальному механизму. На
- 32. РЕАКЦИИ С УЧАСТИЕМ МЕТИЛПЕРОКСИДНОГО РАДИКАЛА 2CH3OO → O2 + 2CH3O. CH3 OO + NO → CH3O
- 33. УСТОЙЧИВЫЕ ПРОДУКТЫ ОКИСЛЕНИЯ МЕТАНА- ОКСИД УГЛЕРОДА И ДИОКСИД УГЛЕРОДА ФОРМАЛЬДЕГИД Формильный радикал (НСО) образуется также при
- 35. Скачать презентацию





























 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)