Содержание
- 2. Цель: закрепить навык составления уравнений реакций в ионном виде
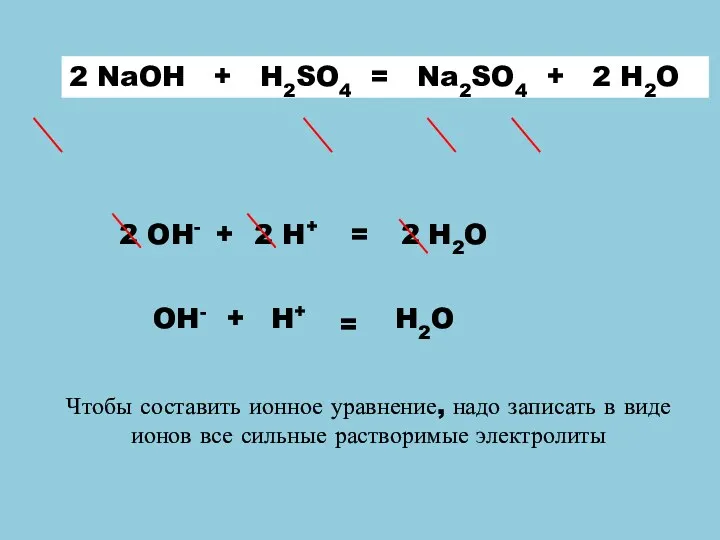
- 3. Вставьте пропущенные слова: Уравнения реакций, в которых вещества записаны в форме молекул, называются _________________. Уравнения реакций,
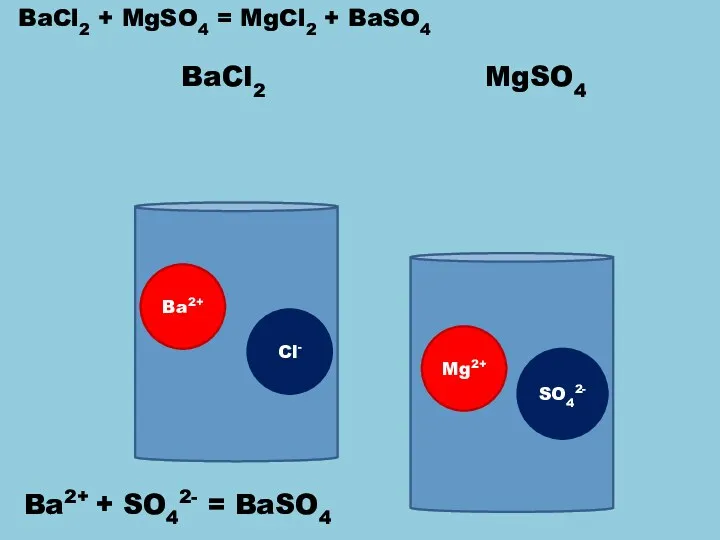
- 4. BaCl2 Ba2+ Cl- Mg2+ SO42- MgSO4 BaCl2 + MgSO4 = MgCl2 + BaSO4 Ba2+ + SO42-
- 5. + 2 H2O = 2 Na++ SO42- 2 H++SO42- + 2 OH- + 2 Na+ 2
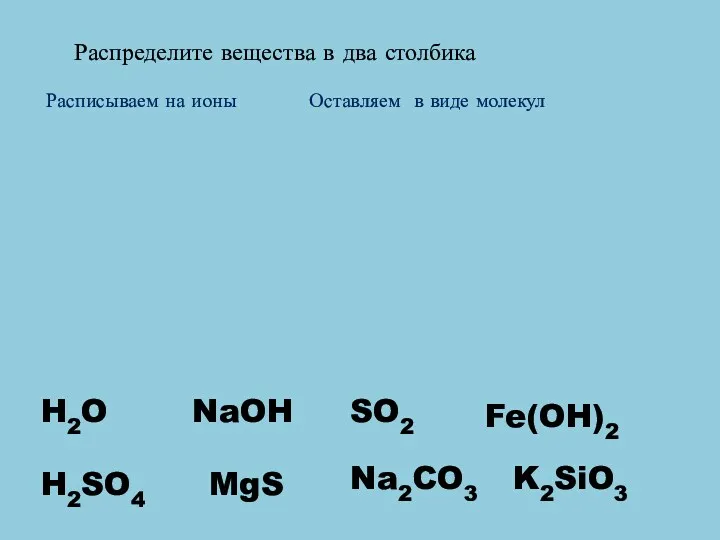
- 6. Распределите вещества в два столбика Расписываем на ионы Оставляем в виде молекул H2O H2SO4 MgS Na2CO3
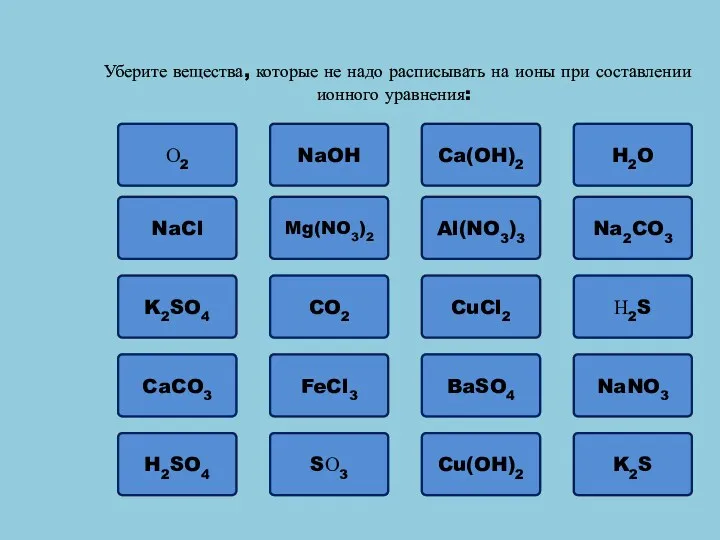
- 7. Ошибка Уберите вещества, которые не надо расписывать на ионы при составлении ионного уравнения: О2 NaOH Ошибка
- 8. Ученик составил полные ионные уравнения для данных молекулярных. Исправьте ошибки. Составьте сокращенные ионные уравнения. Fe (OH)3
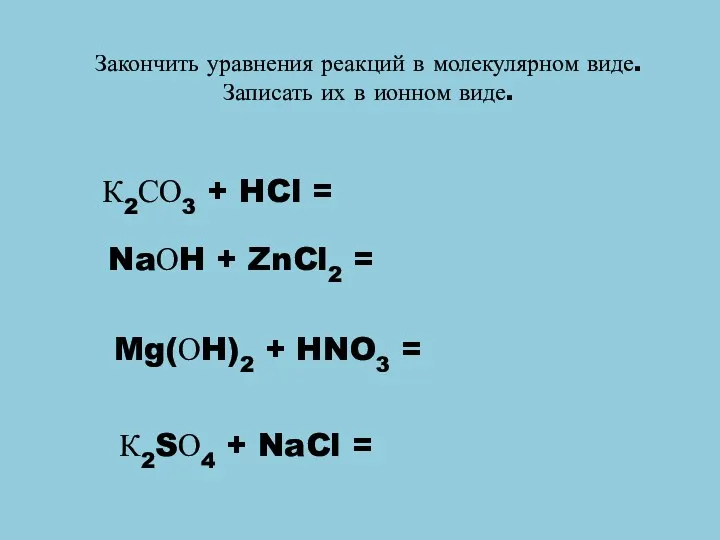
- 9. Закончить уравнения реакций в молекулярном виде. Записать их в ионном виде. К2СО3 + HCl = NaОH
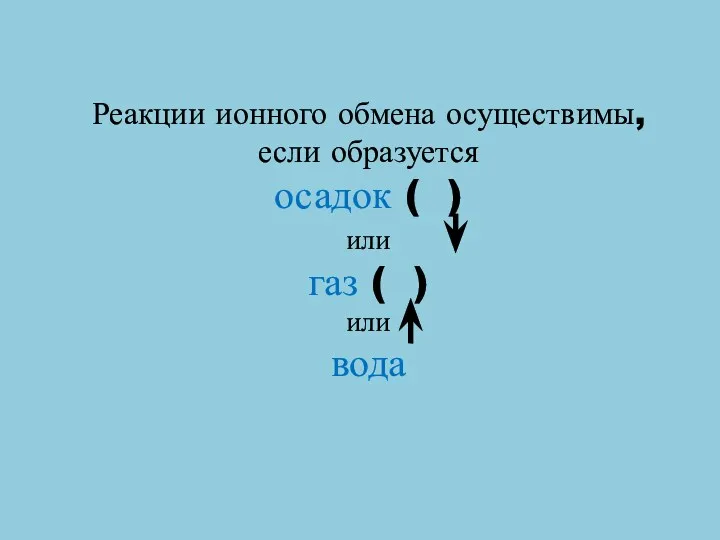
- 10. Реакции ионного обмена осуществимы, если образуется осадок ( ) или газ ( ) или вода
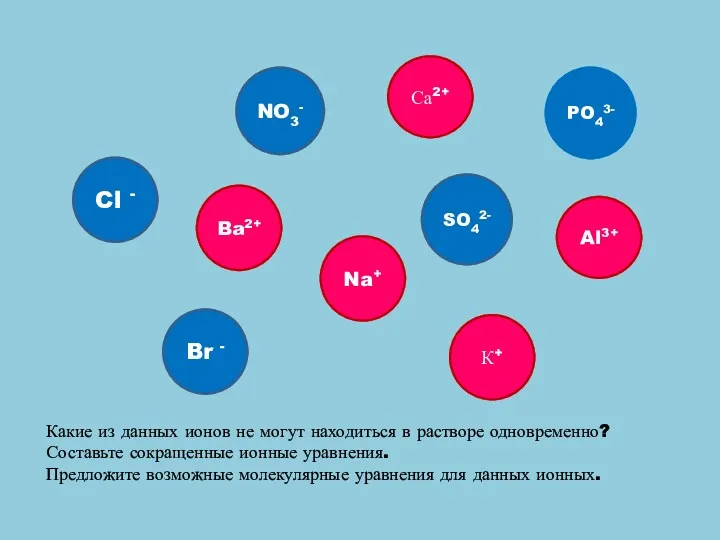
- 11. Br - Cl - SO42- NO3- Ba2+ PO43- Na+ Са2+ К+ Al3+ Какие из данных ионов
- 12. Самостоятельная работа Составьте уравнения реакций в молекулярной, ионной и сокращенной ионной формах Вариант 1 Вариант 2
- 13. Проверь себя: Вариант 1 3 CaCl2 + 2 K3PO4 = Ca3 (PO4)2 + 6 KCl 3
- 15. Скачать презентацию





 Химический элемент хлор
Химический элемент хлор Металдардыњ механикалыќ ќасиеттері-алюминий
Металдардыњ механикалыќ ќасиеттері-алюминий Введение в минералогию. Генезис минералов
Введение в минералогию. Генезис минералов Якісні реакції на деякі йони
Якісні реакції на деякі йони Массовая доля вещества в растворе
Массовая доля вещества в растворе Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Основні класи неорганічних сполук
Основні класи неорганічних сполук Алкадиены
Алкадиены Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Жидкие кристаллы
Жидкие кристаллы Генетическая связь неорганических соединений
Генетическая связь неорганических соединений Биохимия
Биохимия Хімічні сполуки у побуті
Хімічні сполуки у побуті Электроотрицательность химических элементов
Электроотрицательность химических элементов Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями
Научно-исследовательская работа Вся правда о продуктах с сахарозаменителями Алкины. Непредельные углеводороды
Алкины. Непредельные углеводороды Природний газ
Природний газ Амины. Номенклатура аминов
Амины. Номенклатура аминов La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Химическая организация клетки. Неорганические вещества, входящие в состав клетки
Химическая организация клетки. Неорганические вещества, входящие в состав клетки Фолий қышқылы (B9 дәрумені)
Фолий қышқылы (B9 дәрумені) Неон. Получение
Неон. Получение Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Химический элемент сера
Химический элемент сера Валентность. Определение валентности по формулам. Химия. 8 класс
Валентность. Определение валентности по формулам. Химия. 8 класс Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Азотсодержащие соединения
Азотсодержащие соединения Спирты и фенолы
Спирты и фенолы