Содержание
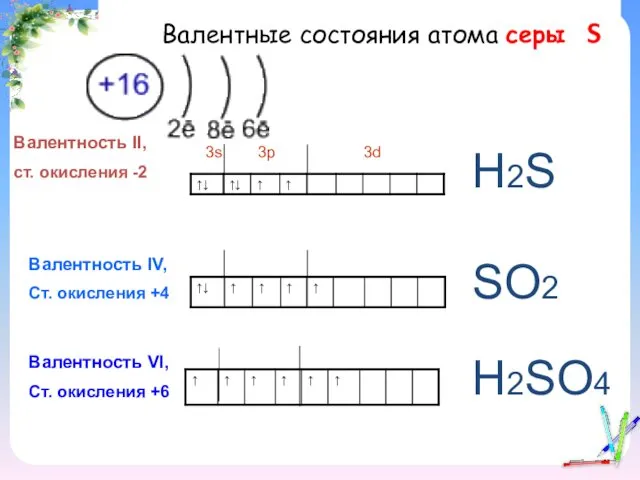
- 2. Валентные состояния атома серы S Валентность II, ст. окисления -2 3s 3p 3d Валентность IV, Ст.
- 3. Физические свойства серы Твёрдое кристаллическое вещество желтого цвета, без запаха Плохо проводит теплоту и не проводит
- 4. Нахождение серы в природе Сера является на 16-м месте по распространённости в земной коре. Встречается в
- 5. Сера также встречается в виде сульфатов - солей серной кислоты - мирабилит
- 6. Пирит – «огненный камень» (соединение серы в природе)
- 7. В древности и в средние века серу добывали, вкапывая в землю большой глиняный горшок, на который
- 8. Сера входит в состав белков. Особенно много серы в белках волос, рогов, шерсти. Кроме этого сера
- 9. Серой богаты бобовые растения (горох, чечевица), овсяные хлопья, яйца
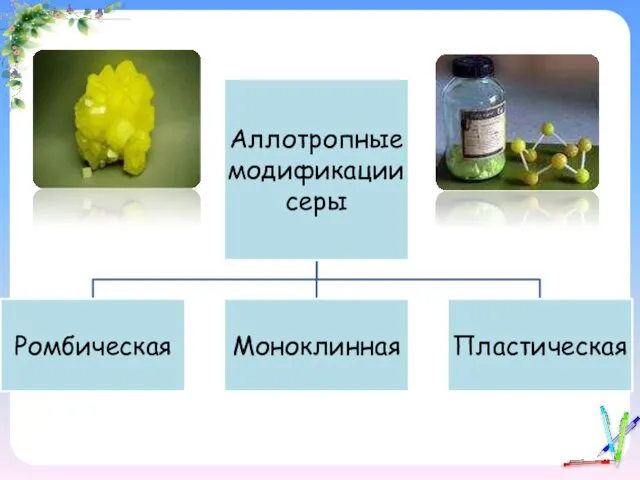
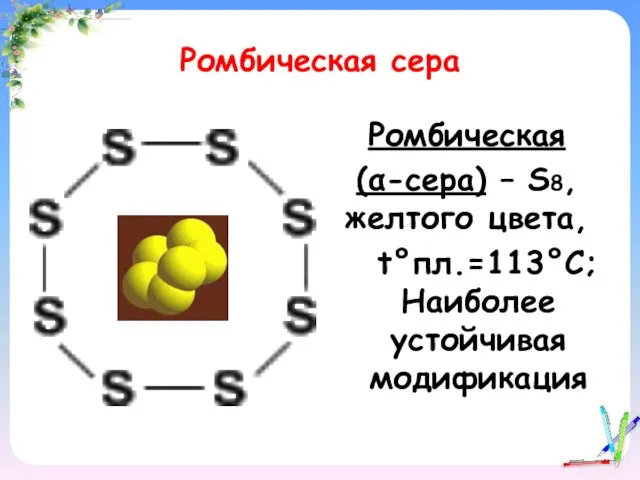
- 11. Ромбическая сера Ромбическая (α-сера) – S8, желтого цвета, t°пл.=113°C; Наиболее устойчивая модификация
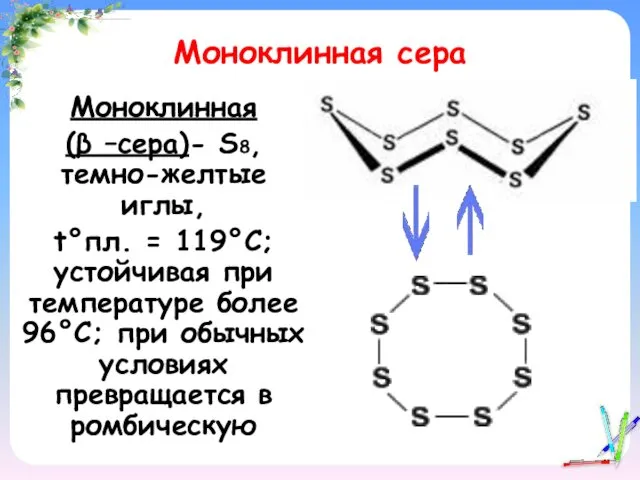
- 12. Моноклинная сера Моноклинная (β –сера)- S8, темно-желтые иглы, t°пл. = 119°C; устойчивая при температуре более 96°С;
- 13. Пластическая сера Пластическая сера- коричневая резиноподобная (аморфная) масса. Она неустойчива и через некоторое время становится хрупкой,
- 14. Химические свойства серы (восстановительные) Сера проявляет в реакциях с сильными окислителями: S - 2ē → S+2;
- 15. Химические свойства серы (окислительные) S0 + 2ē → S-2 4) Сера реагирует со щелочными металлами без
- 17. Скачать презентацию










 Материаловедение и технология обработки материалов
Материаловедение и технология обработки материалов Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 c0198e3edf1db804a5527004a7864ed1
c0198e3edf1db804a5527004a7864ed1 Процессы сульфирования в промышленности
Процессы сульфирования в промышленности Химические реакции. Реакции обмена
Химические реакции. Реакции обмена Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Знакомство с образцами химических средств санитарии и гигиены
Знакомство с образцами химических средств санитарии и гигиены Минералы и Близнецы
Минералы и Близнецы Серная кислота H2SO4
Серная кислота H2SO4 Химический состав воздуха
Химический состав воздуха Дисперсные системы
Дисперсные системы Жир жиру рознь. Супер омега 3
Жир жиру рознь. Супер омега 3 Важнейшие оксиды в природе и жизни человека
Важнейшие оксиды в природе и жизни человека Электронное и пространственное строение молекул органических соединений – основа их биологической активности
Электронное и пространственное строение молекул органических соединений – основа их биологической активности Виды камней
Виды камней Лекция 5. Коллигативные свойства растворов
Лекция 5. Коллигативные свойства растворов 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Автомобильные бензины
Автомобильные бензины Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Природные источники углеводородов. 10 класс
Природные источники углеводородов. 10 класс Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1
Растворы. Способы выражения концентраций. Сильные и слабые электролиты. Закон разведения Оствальда. Лекция 02-1 Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Строение атомов. Понятие о квантовой механике
Строение атомов. Понятие о квантовой механике Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты
Серная кислота. Свойства разбавленной серной кислоты, соли серной кислоты Химикаты для сельского хозяйства
Химикаты для сельского хозяйства ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ
ПРОСТЫЕ ВЕЩЕСТВА -НЕМЕТАЛЛЫ