Содержание
- 2. Три идеи квантовой механики принцип дискретности или квантования корпускулярно-волновой дуализм вероятностный характер движения объектов микромира
- 3. Квантование энергии электрона в атоме Физические величины, относящиеся к микрообъектам, изменяются не непрерывно, а скачкообразно –
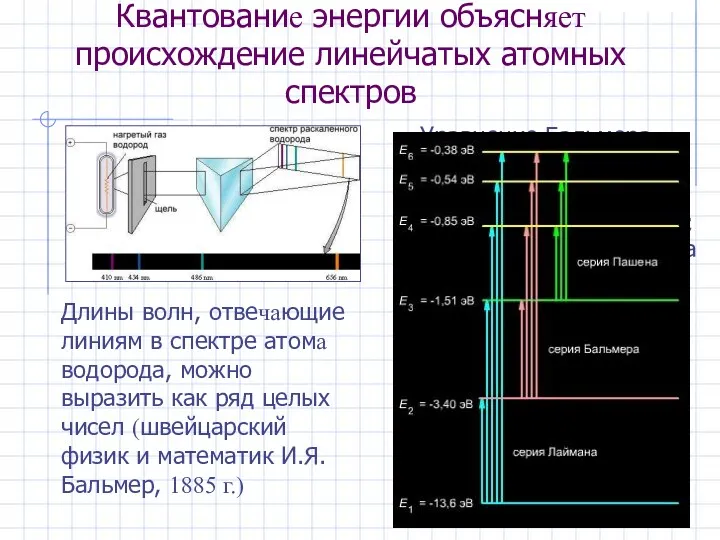
- 4. Квантование энергии объясняет происхождение линейчатых атомных спектров Уравнение Бальмера – Ридберга*: 1/λ =R (1/n12 – 1/n22),
- 5. Постулаты Н.Бора В изолированном атоме электроны движутся по круговым стационарным орбитам, не излучая и не поглощая
- 6. Корпускулярно-волновой дуализм Микрочастицы (обладающие массой, размерами и зарядом) одновременно проявляют свойства волны (способность к дифракции, интерференции
- 7. Гипотеза де Бройля (1924 г.) Корпускулярно-волновыми свойствами обладает любая частица, движущаяся со скоростью v. Уравнение де
- 8. Волновые свойства макро- и микрообъектов Тело массой 1 г, летящее со скоростью 1 м/с, характеризуется длиной
- 9. Принцип неопределенности Гейзенберга (1927 г.) Для микрочастицы нельзя одновременно точно определить положение в пространстве и импульс
- 10. Вероятностный характер явлений микромира Чем точнее определена скорость, тем меньше известно о местоположении частицы, и наоборот.
- 11. Волновое уравнение Шрёдингера (1926 г.) Волновое уравнение описывает состояние электрона в атоме. Оно объединяет математические выражения
- 12. Уравнение Шрёдингера где ψ – волновая функция (аналог амплитуды для волнового движения в классической механике), которая
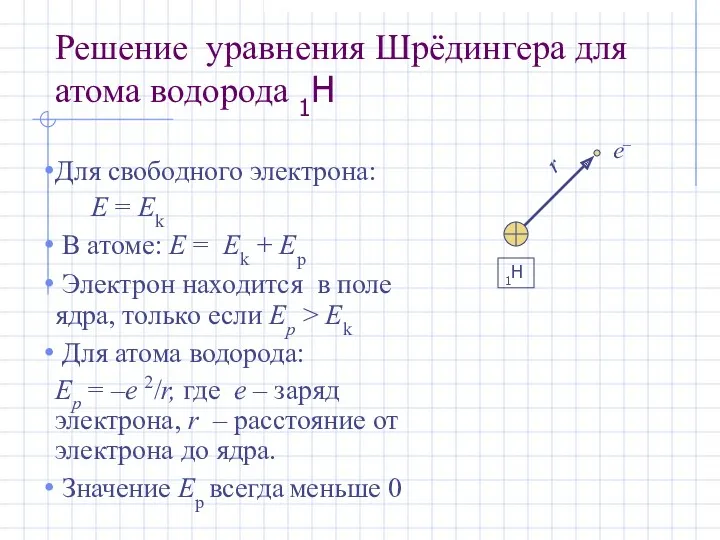
- 13. Решение уравнения Шрёдингера для атома водорода 1H Для свободного электрона: Е = Еk В атоме: Е
- 14. Уравнение Шрёдингера в операторной форме Оператор Лапласа Волновое уравнение в операторной форме
- 15. Свойства волновой функции Волновая функция ψ характеризует вероятность нахождения электрона в атоме. Волновая функция ψ имеет
- 16. Разделение переменных – переход от декартовых координат к сферическим Переходим от декартовых координат x, y, z
- 17. Квантовые числа R(r) Θ(θ) Φ(φ) n, l l, ml ml Целые положительные числа Каждая атомная орбиталь
- 18. Атомная орбиталь Геометрический образ одноэлектронной волновой функции – атомная орбиталь – область пространства вокруг ядра атома,
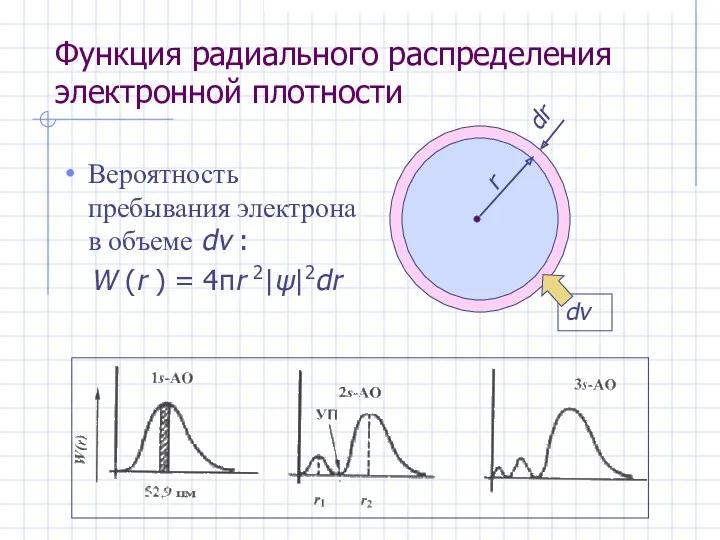
- 19. Функция радиального распределения электронной плотности Вероятность пребывания электрона в объеме dv : W (r ) =
- 20. Главное квантовое число n n характеризует энергию атомной орбитали. n может принимать положительные целочисленные значения (1,
- 21. E Е1 = –1312,1 n = 1 Е2 = –328,0 n = 2 Е3 = –145,8
- 22. Орбитальное квантовое число l Орбитальное квантовое число l характеризует энергетический подуровень. Атомные орбитали с разными орбитальными
- 23. Магнитное квантовое число ml Магнитное квантовое число ml отвечает за ориентацию атомных орбиталей в пространстве. Для
- 24. Магнитное спиновое квантовое число ms Электрон, занимающий АО, характеризуется спиновым квантовым числом ms. Спин - собственный
- 25. Форма электронных облаков (атомных орбиталей s-, p- и d-подуровня)
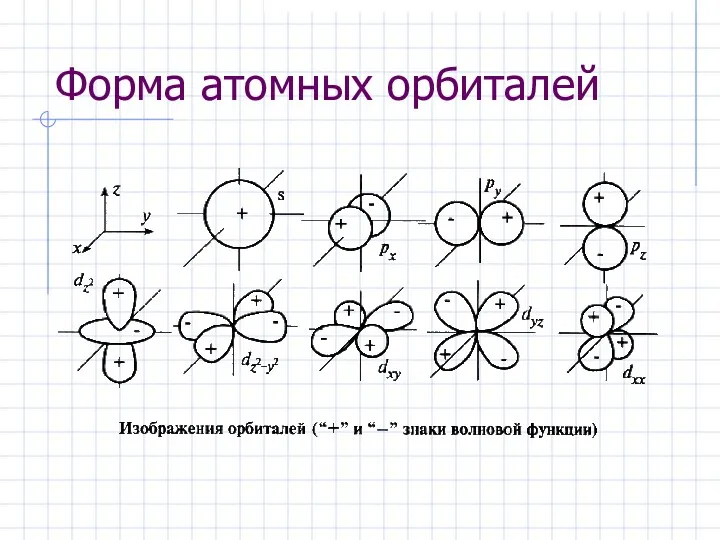
- 26. Форма атомных орбиталей
- 27. Форма электронных облаков (атомных орбиталей f-подуровня)
- 28. Энергетическая диаграмма 1s 2s 3s 2p 3p 3d E Энергетические уровни и подуровни для одноэлектронного атома
- 29. Уравнение Шрёдингера для многоэлектронного атома (водородоподобная модель) Притяжение к ядру: Отталкивание электронов:
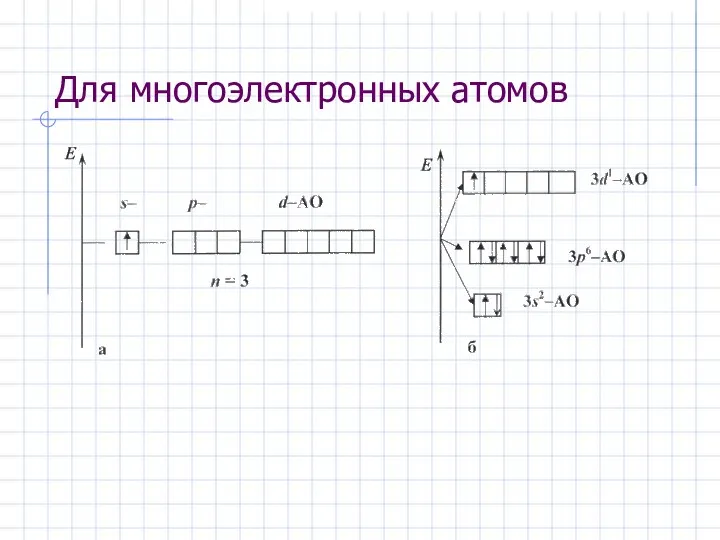
- 30. Для многоэлектронных атомов
- 32. Скачать презентацию
























 Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Производные бис-(β-хлорэтил)-амина, препараты для лечения онкозаболеваний
Производные бис-(β-хлорэтил)-амина, препараты для лечения онкозаболеваний Основы химмотологии моторных топлив. Тема 3
Основы химмотологии моторных топлив. Тема 3 Властивості елементів IІВ групи та їх сполук
Властивості елементів IІВ групи та їх сполук Искусственные каменные материалы
Искусственные каменные материалы Металлы применяемые в строительстве
Металлы применяемые в строительстве Век пластмасс
Век пластмасс Органикалық қосылыстар. Көмірсутектерден жасалған
Органикалық қосылыстар. Көмірсутектерден жасалған Химический элемент алюминий
Химический элемент алюминий Задачи на избыток-недостаток
Задачи на избыток-недостаток Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Процессы алкилирования
Процессы алкилирования Карбонові кислоти
Карбонові кислоти Алкадиены
Алкадиены Количественная характеристика растворов, растворение, растворимость
Количественная характеристика растворов, растворение, растворимость Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Чисті речовини і суміші
Чисті речовини і суміші Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття
Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Аналитическая химия. Общие понятия
Аналитическая химия. Общие понятия Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Химическая промышленность
Химическая промышленность Классификация химических реакций
Классификация химических реакций Строение вещества. Химические элементы
Строение вещества. Химические элементы Аналитическая химия. Количественный анализ
Аналитическая химия. Количественный анализ Титриметрический метод анализа
Титриметрический метод анализа