Содержание
- 2. Карбонові кислоти — органічні сполуки, що мають у складі своїх молекул одну або кілька карбоксильних груп
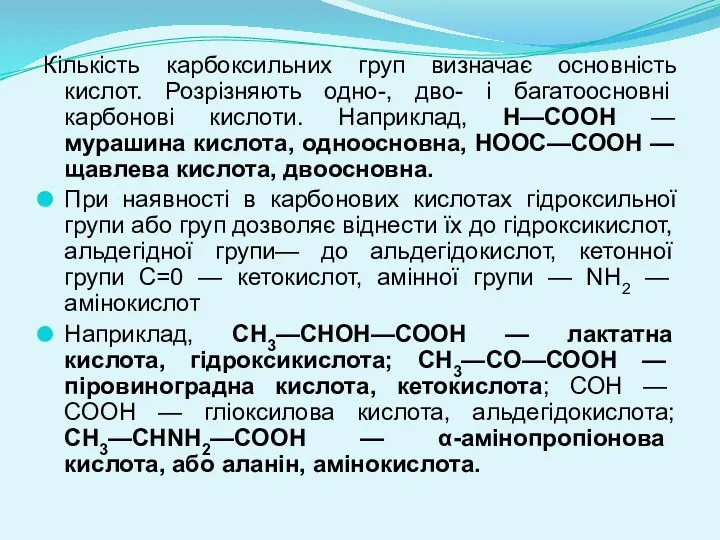
- 3. Кількість карбоксильних груп визначає основність кислот. Розрізняють одно-, дво- і багатоосновні карбонові кислоти. Наприклад, Н—СООН —
- 4. Одноосновні насичені кислоти Одноосновні насичені кислоти — похідні алканів, у молекулі яких атом Гідрогену заміщений на
- 5. Способи одержання. Карбонові кислоти в природі знаходяться у вільному (наприклад, мурашина — у виділеннях мурашок, у
- 7. Оксосинтез кислот з ненасичених вуглеводнів. Алкени і алкіни утворюються при крекінгу нафти і є дешевою сировиною
- 8. 4Гідроліз тригалогенопохідних алканів 5.Синтез Гріньяра:
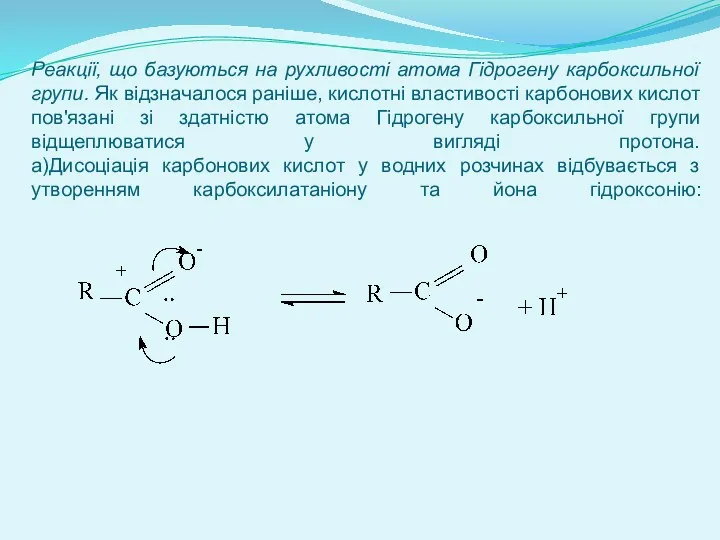
- 9. Реакції, що базуються на рухливості атома Гідрогену карбоксильної групи. Як відзначалося раніше, кислотні властивості карбонових кислот
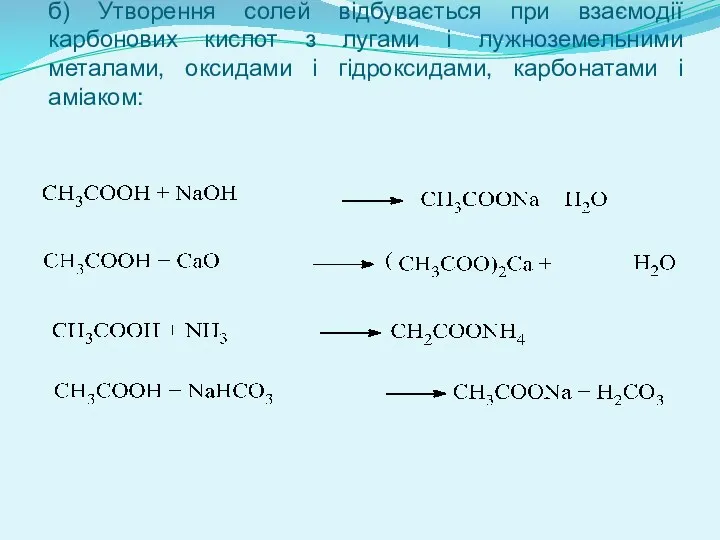
- 10. б) Утворення солей відбувається при взаємодії карбонових кислот з лугами і лужноземельними металами, оксидами і гідроксидами,
- 11. 2. Реакції заміщення гідроксилу карбоксильної групи на атоми і атомні групи приводять до утворення функціональних похідних
- 12. б) Утворення галогенангідридів відбувається при дії на карбонові кислоти хлоридів фосфору (III) і (V), тіонілхлориду
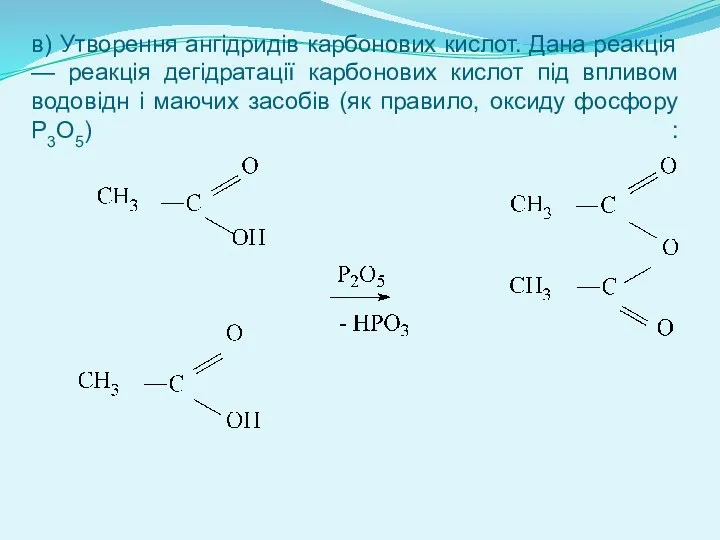
- 13. в) Утворення ангідридів карбонових кислот. Дана реакція — реакція дегідратації карбонових кислот під впливом водовідн і
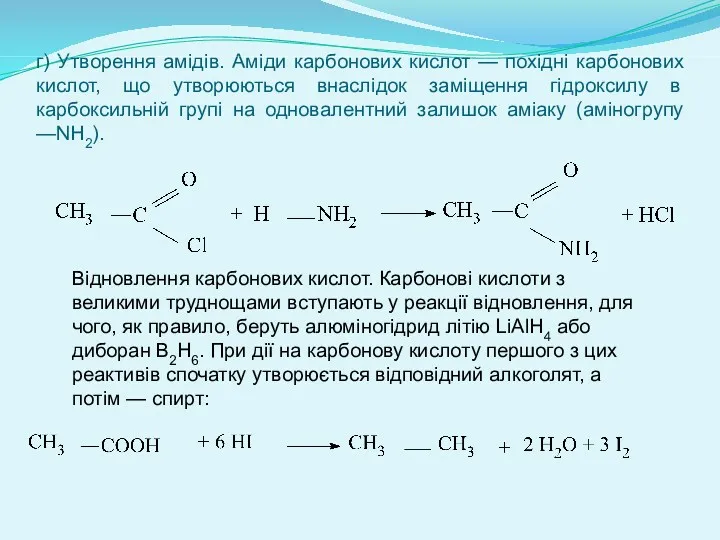
- 14. г) Утворення амідів. Аміди карбонових кислот — похідні карбонових кислот, що утворюються внаслідок заміщення гідроксилу в
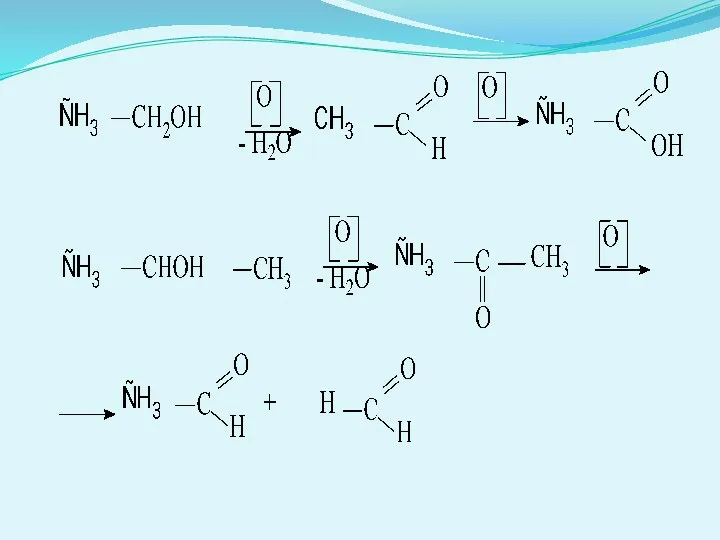
- 15. . Реакції за участю радикалів. Алкільний радикал карбонов кислоти може вступати в реакції вільнорадикального галогенування, типового
- 16. Реакції окиснення. Карбонові кислоти мають певну стійкість до дії окиснювачів. Наприклад, це дозволяє ацетатну кислоту використовувати
- 17. При дії на карбонові кислоти пероксиду гідрогену утворюються β-гідроксикислоти:
- 19. Скачать презентацию










 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов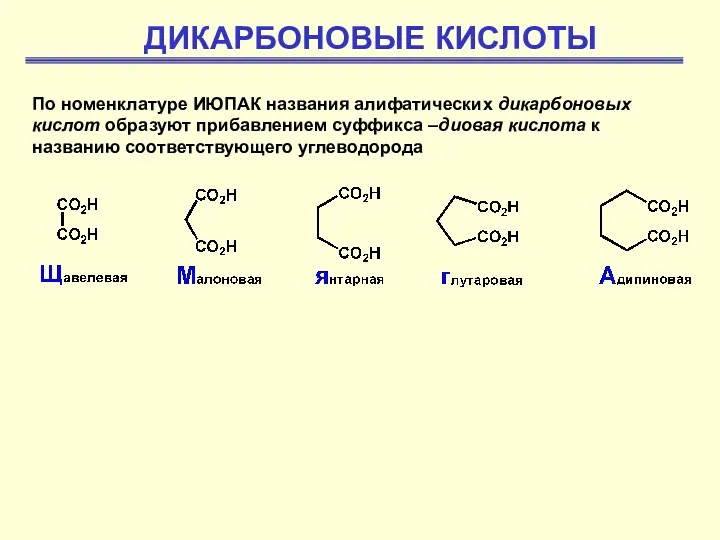 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка