Слайд 2

Определение
Ами́ны — органические соединения, являющиеся производными аммиака, в молекуле которого один,
два или три атома водорода замещены на углеводородные радикалы .
Общая формула R – ( NH 2 )n
Слайд 3

Номенклатура
1) Название радикала + амин
CH 3 – NH 2
– Метиламин
CH 3 – NH – C2H5 – Метилэтиламин
2) Амино- + название углеводорода
CH 3 – CH – CH 3 2 – Аминопропан
NH 2
Слайд 4
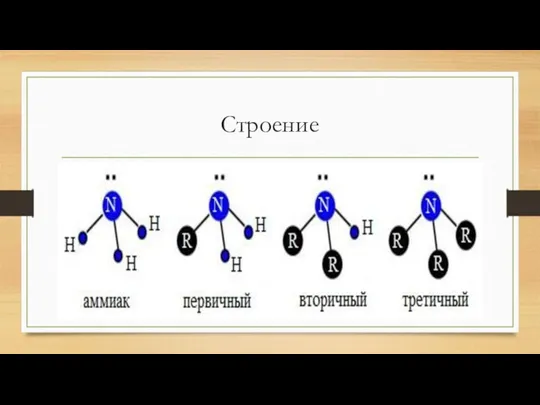
Слайд 5

Классификация
По числу замещённых атомов H
Первичные CH 3 – NH
2 – Метиламин
Вторичные CH 3 CH 2 – NH – CH 2 – CH 3 – Диэтиламин
Третичный H 3 CH 2 C – N – CH 2 CH 3 – Триэтиламин
CH 2 H 3
Слайд 6

Классификация
По типу R
Предельные C2H5 – NH2 – Этиламин
Ароматические C6H5 –
NH 2 – Фениламин ( анилин )
Слайд 7

Структурная изомерия
а) изомерия углеродного скелета:
Слайд 8

изомерия положения функциональной группы:
Слайд 9

Слайд 10

Физические свойства аминов
Простейшие амины (метиламин, диметиламин, триметиламин) — газообразные вещества. Остальные
низшие амины — жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака.
Первичные и вторичные амины способны образовывать водородные связи. Это приводит к заметному повышению их температур кипения по сравнению с соединениями, имеющими ту же молекулярную массу, но не способными образовывать водородные связи.
Анилин — маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184 °С.
Слайд 11

Химические свойства аминов
Химические свойства аминов определяются в основном наличием у атома
азота неподеленной электронной пары.
Амины как основания. Атом азота аминогруппы, подобно атому азота в молекуле аммиака, за счет неподеленной пары электронов может образовывать ковалентную связь по донорно-акцепторному механизму, выступая в роли донора. В связи с этим амины, как и аммиак, способны присоединять катион водорода, т. е. выступать в роли основания:
Слайд 12

Слайд 13

Реакция амионов с водой приводит к образованию гидроксид-ионов
Слайд 14

Слайд 15

Слайд 16

Получение
Синтез из спиртов.
Пропусканием паров спирта и аммиака при 400
0С над катализатором получают смесь первичных, вторичных и третичных спиртов:
Слайд 17

Реакция Гофмана.
Действие аммиака на галогенопроизводные позволяет получить смесь солей различных аминов:
Слайд 18

Реакция Зинина
Нитросоединения восстанавливаются водородом в присутствии катализатора:
Слайд 19
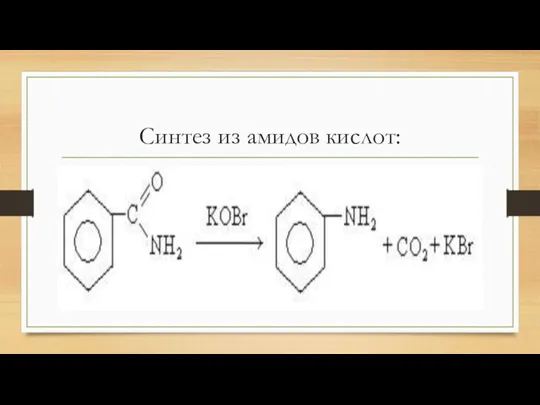
Слайд 20
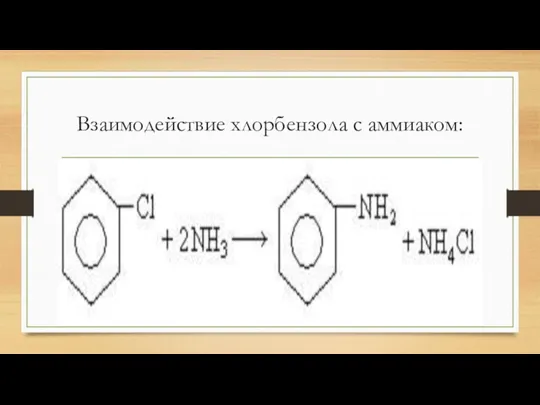
Взаимодействие хлорбензола с аммиаком:



















 Изомерия биоорганических соединений. Структура и функции биолекул
Изомерия биоорганических соединений. Структура и функции биолекул Медь и её соединения
Медь и её соединения Атом - сложная частица
Атом - сложная частица Лабораторные исследования состава и физико-химических свойств нефти
Лабораторные исследования состава и физико-химических свойств нефти Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Молярный объем газов
Молярный объем газов Вуглеводи
Вуглеводи Планетарная модель строения атома
Планетарная модель строения атома Технология промышленных газов
Технология промышленных газов Алюминий. Схема расположения электронов на энергетических подуровнях
Алюминий. Схема расположения электронов на энергетических подуровнях Гидроочистка дизельного топлива
Гидроочистка дизельного топлива Материаловедение, как отрасль науки
Материаловедение, как отрасль науки Кремний и его соединения
Кремний и его соединения Типы химических реакций
Типы химических реакций Взаємодія кисеню зі складними речовинами
Взаємодія кисеню зі складними речовинами Химическая связь
Химическая связь Общая характеристика неметаллов
Общая характеристика неметаллов Значення періодичного закону
Значення періодичного закону Аннелирование бензольного кольца
Аннелирование бензольного кольца Водородная связь
Водородная связь Періодичний закон Д.І. Менделєєва. Періодична система хімічних елементів, її структура
Періодичний закон Д.І. Менделєєва. Періодична система хімічних елементів, її структура Органические соединения серы
Органические соединения серы Проектная работа. Косметика своими руками
Проектная работа. Косметика своими руками Методы окислительно-восстановительного и комплексонометри-ческого титрования
Методы окислительно-восстановительного и комплексонометри-ческого титрования Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Алотропні модифікації фосфору
Алотропні модифікації фосфору Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша)
Стратегії дослідження хімічних сполук з використанням сучасних фізичних методів (частина перша) Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу