Содержание
- 2. Властивості хімічних елементів, простих речовин, а також склад і властивості сполук перебувають у періодичній залежності від
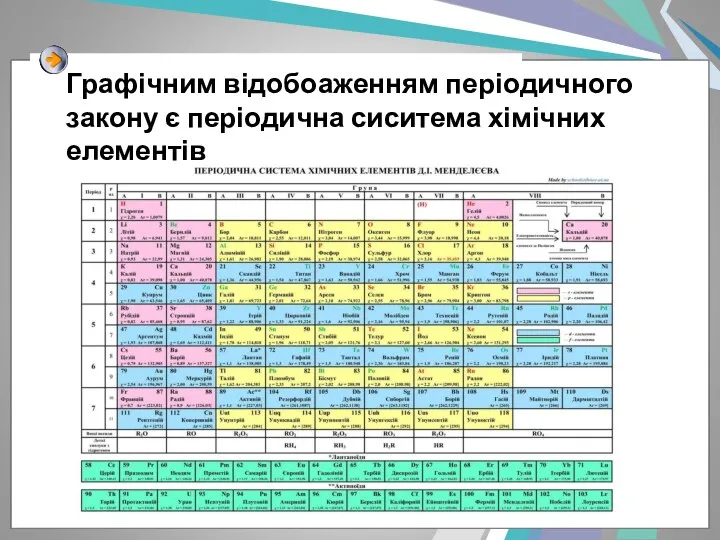
- 3. Графічним відобоаженням періодичного закону є періодична сиситема хімічних елементів
- 4. Минуло більш як 150 років, але періодичний закон та періодична система з успіхом застосовується і донині.
- 5. Періодичний закон – один із найфундаментальніших законів природи. Йому підпорядковані всі хімічні елементи всесвіту. А оскільки
- 6. Розв’яжіть задачу №1. Відносна молекулярна маса вищого оксиду елемента V групи дорівнює 230. Установіть, який це
- 7. Розв’яжіть задачу №2. Телур 52Те утворює з Гідрогеном летку сполуку, формула якої Н2Те. Яка формула його
- 8. Розв’яжіть задачу №3. Вищій оксид хімічного елемента 3 періоду має загальну формулу ЕО2. Установіть елемент, обчисліть
- 9. Розв’яжіть задачу №4. Елемент утворює з Гідрогеном летку сполуку, формула якої Н2Е. Про який елемент ідеться,
- 10. Наукове значення періодичного закону Періодичний закон Д.І. Менделєєва один із основних і найзагальніших законів природи, закон,
- 11. Періодичний закон Д.І. Менделєєва дав можливість пояснювати явища, в яких беруть участь хімічні елементи, та передбачати
- 12. Передбачення існування ще не відкритих хімічних елементів Гафній Hf (Ar=178,5) буде відкритий Д.Костером і Д.Хевеши в
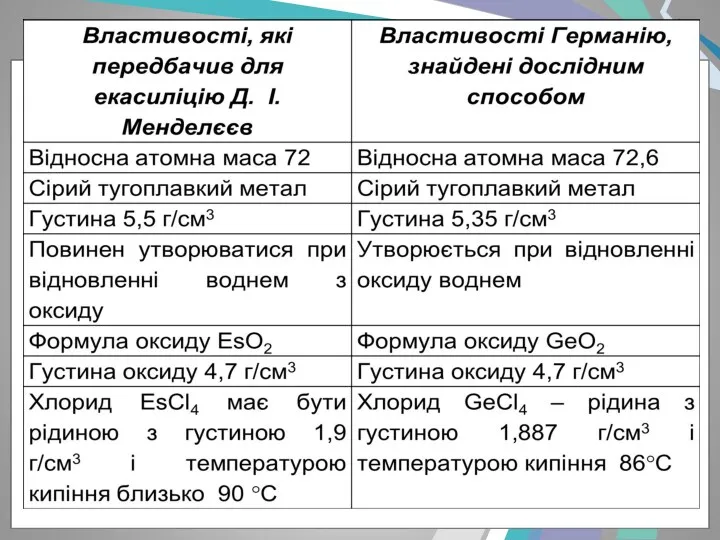
- 13. - Д. І. Менделєєв у 1870 році дуже докладно описав властивості трьох ще не відкритих елементів
- 15. На основі періодичного закону і періодичної системи вбуло виправлено відносні атомні маси багатьох елементів ( берилію,
- 16. Відкриття інертних газів Відкриття інертних газів було, мабуть, найскладнішим. Ці речовини містяться в атмосфері у незначній
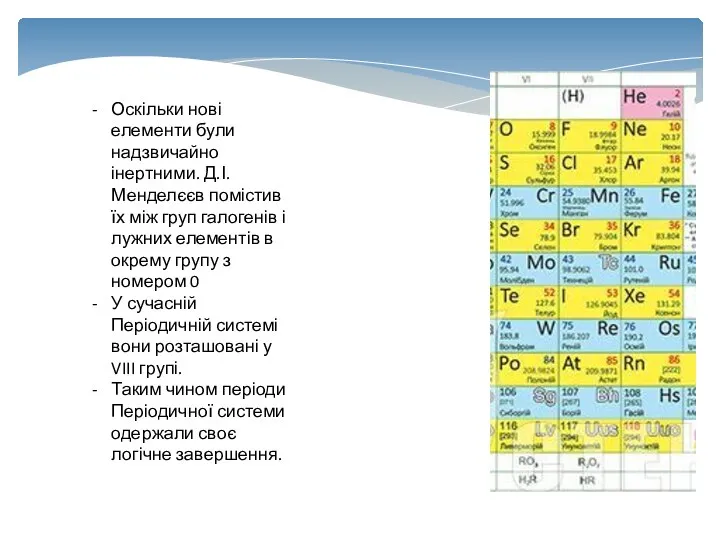
- 17. Оскільки нові елементи були надзвичайно інертними. Д.І.Менделєєв помістив їх між груп галогенів і лужних елементів в
- 18. Підсумки Періодичний закон систематизував та узагальнив всі відомості про хімічні елементи та їх сполуки, об’єднав у
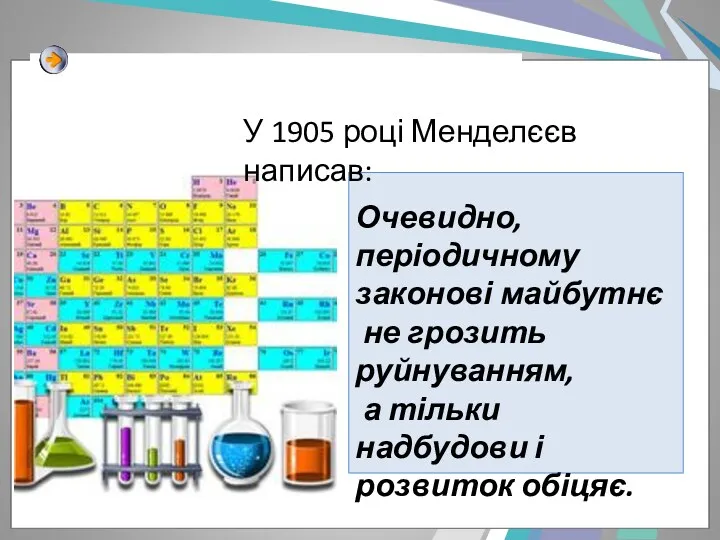
- 19. Очевидно, періодичному законові майбутнє не грозить руйнуванням, а тільки надбудови і розвиток обіцяє. У 1905 році
- 20. Оцінюючи велич діянь Д.І. Менделєєва, видатні вчені недарма називали періодичний закон «компасом» (Рамсей В.), «яскравим маяком»
- 21. Д.І.Менделєєв був найбільш визнаним у світі російським ученим – він мав понад ста почесних звань, зокрема
- 22. Перевірте свої знання: 1. Виберіть сучасне формулювання Періодичного закону А Властивості хімічних елементів і утворених ними
- 23. 2. Укажіть порядковий номер хімічного елемента Е, який належить до ІІІ періоду періодичної системи й утворює
- 24. 3. У якій групі періодичної системи (коротка форма) містяться лише металічні елементи? А ІІ. Б ІV.
- 25. 4. У періодичній системі хімічних елементів Карбон і Титан належать до: А одного періоду Б однієї
- 26. 5. Флуор, Хлор, Бром належать до: А f-елементів, Б d-елементів, В p-елементів, Г s-елементів
- 27. 6. Як розташовані хімічні елементи в періодичній системі Д. І. Менделєєва? А кожний період закінчується металічним
- 28. 7. Як змінюється склад електронної оболонки атомів хімічних елементів 3-го періоду періодичної системи Д.І. Менделєєва зі
- 29. 8. Укажіть символи хімічних елементів однієї підгрупи періодичної системи Д.І. Менделєєва. А K, Cu, Rb. Б
- 30. 9. Розташуйте хімічні елементи за зменшенням радіусів атомів. А Аl. Б Si. В С . Г
- 31. 10. Чому Сульфур і Хром розташовано в одній групі періодичної системи елементів Д.І. Менделєєва А атоми
- 32. 11. На підставі періодичного закону було виправлено: А) порядкові номери хімічних елементів; Б) назви хімічних елементів;
- 33. Хімічні елементи у періодичній системі розміщені у порядку зростання: А) радіусу атома Б) відносних атомних мас;
- 35. Скачать презентацию




























 Готовимся к экзамену по химии
Готовимся к экзамену по химии Катализ. Факторы, влияющие на скорость реакции
Катализ. Факторы, влияющие на скорость реакции Химические уравнения Закон сохранения массы веществ
Химические уравнения Закон сохранения массы веществ Реакции ионного обмена
Реакции ионного обмена Гірські породи
Гірські породи Синтез высокомолекулярных соединений
Синтез высокомолекулярных соединений Физико-химические методы анализа. Лекция 3
Физико-химические методы анализа. Лекция 3 Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены
Галогены Химическая промышленность
Химическая промышленность Рафинирование от растворимых окислов
Рафинирование от растворимых окислов Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов
Общая геохимия. Периодический закон Менделеева. Строение электронных оболочек. Геохимические классификации элементов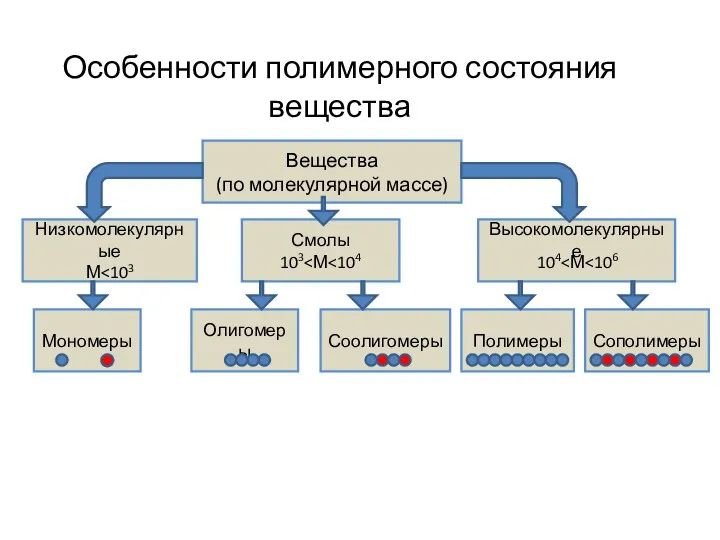 Особенности полимерного состояния вещества
Особенности полимерного состояния вещества Анионактивті беттік активті заттар
Анионактивті беттік активті заттар Гетерогенді химиялық реакциялар
Гетерогенді химиялық реакциялар Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Экскурсия по химическому факультету
Экскурсия по химическому факультету Реконструкция установки получения элементарной серы
Реконструкция установки получения элементарной серы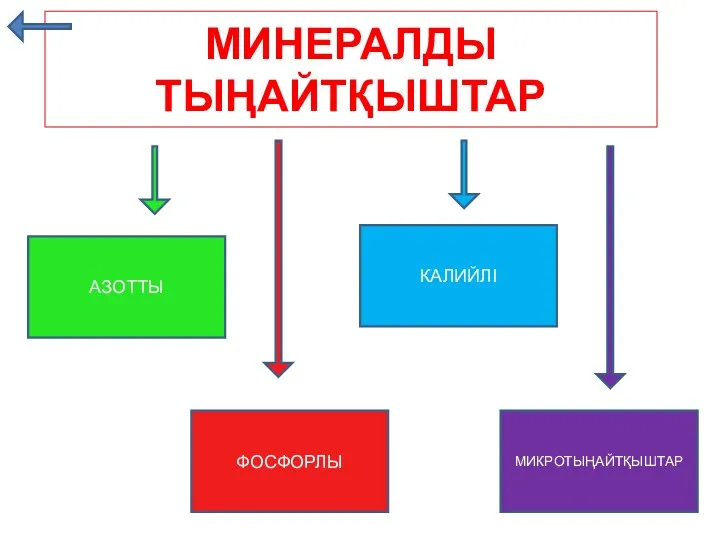 Минералды тыңайтқыштар
Минералды тыңайтқыштар 20230205_metally_pobochnyh_podgrupp
20230205_metally_pobochnyh_podgrupp Анализ качества лекарственных веществ, определяемых методом комплексонометрии
Анализ качества лекарственных веществ, определяемых методом комплексонометрии Производные хинолина и хинуклидина, производные 4-замещенных хинолина
Производные хинолина и хинуклидина, производные 4-замещенных хинолина Адсорбция
Адсорбция Phosphorus and its compounds
Phosphorus and its compounds Получение и применение альдегидов
Получение и применение альдегидов Электролитическая диссоциация
Электролитическая диссоциация Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування
Сполуки неметалічних елементів з Гідрогеном. Особливості водних розчинів цих сполук, їх застосування