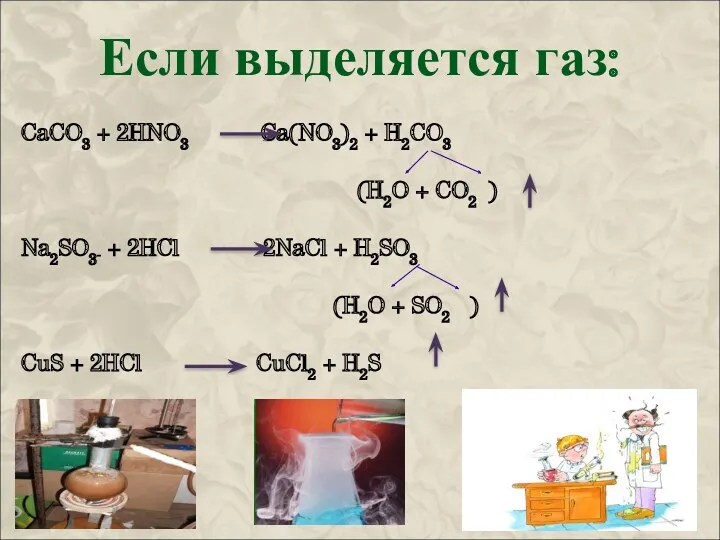
Ионные уравнения
Для реакций ионного обмена составляют полные и сокращенные
ионные уравнения.
При этом на ионы никогда не раскладывают :
нерастворимые вещества (см. таблицу растворимости);
оксиды;
воду;
газы
Помним, что ионы – это заряженные частицы
катионы анионы
+
-
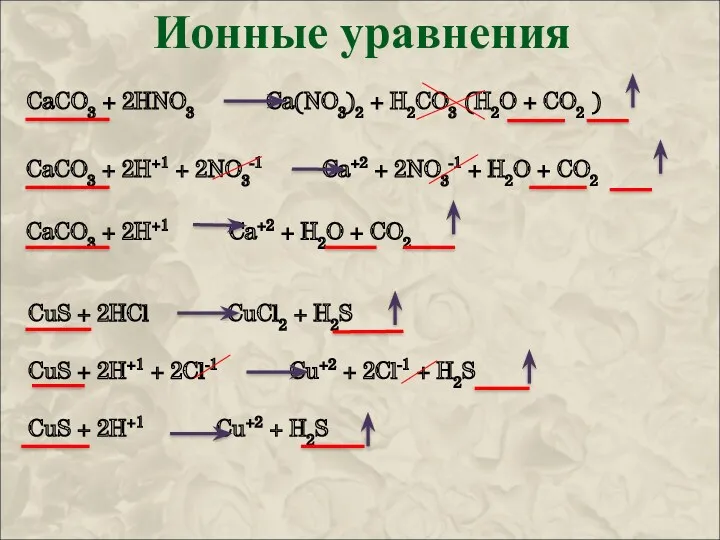
1) Запишем молекулярное уравнение и уравняем его:
CuSO4 + 2NaOH Na2SO4 + Cu(OH)2
2) Разложим на ионы все, что возможно и затем сократим одинаковые ионы в обоих частях уравнения:
Cu+2 + SO4-2 + 2Na+1 + 2OH-1 2Na+1 + SO4-2 + Cu(OH)2
(полное ионное уравнение)
3) Запишем то, что получилось:
Cu+2 + 2OH-1 Cu(OH)2 (сокращенное ионное уравнение)





 Полиметилметакрилат
Полиметилметакрилат Корунд. Разновидности корунда
Корунд. Разновидности корунда Введение в химическую термодинамику
Введение в химическую термодинамику Диссоциация кислот, оснований, солей
Диссоциация кислот, оснований, солей Кристалдардың ішкі құрылымы
Кристалдардың ішкі құрылымы Шкала рН. Лекция 03-1
Шкала рН. Лекция 03-1 Реакции SR в ряду алканов
Реакции SR в ряду алканов Металлы. Общие свойства металлов
Металлы. Общие свойства металлов Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция
Беттiк құбылыстар, олардың ағзадағы маңызы. Адсорбция Розчин і його компоненти
Розчин і його компоненти Химические элементы и организм человека
Химические элементы и организм человека Составление формул химических соединений
Составление формул химических соединений Основні класи неорганічних сполук
Основні класи неорганічних сполук Полимеры. Основные понятия
Полимеры. Основные понятия Механизм реакции в органической химии
Механизм реакции в органической химии Водородная связь
Водородная связь Химия нефти и газа. Лекция № 1
Химия нефти и газа. Лекция № 1 Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15
Химические реакторы. Гетерогенно-каталитические химические процессы. Лекция №15 Губна помада та ії призначення
Губна помада та ії призначення Теория растворов электролитов и неэлектролитов
Теория растворов электролитов и неэлектролитов Способи очищення води
Способи очищення води Аммиак. Строение молекулы аммиака, его физические и химические свойства
Аммиак. Строение молекулы аммиака, его физические и химические свойства Реакция обменного разложения веществ водой - гидролиз
Реакция обменного разложения веществ водой - гидролиз Метод электронного баланса для уравнивания окислительно-восстановительных реакций
Метод электронного баланса для уравнивания окислительно-восстановительных реакций Моноядерні арени
Моноядерні арени Силіцій
Силіцій Водород
Водород Непредельные углеводороды. Алкены. Номенклатура алкенов
Непредельные углеводороды. Алкены. Номенклатура алкенов