Слайд 2

Содержание
1.Определение
2.Номенклатура алкенов
3.Изомерия алкенов
4.Строение алкенов
5.Получение алкенов
6.Физические свойства
7.Химические свойства
8.Применение алкенов
Слайд 3

Определение
Алкены – непредельные углеводороды, в молекулах которых между атомами углерода
имеется одна двойная связь.
Общая формула: СnH2n , где n ≥2
Слайд 4
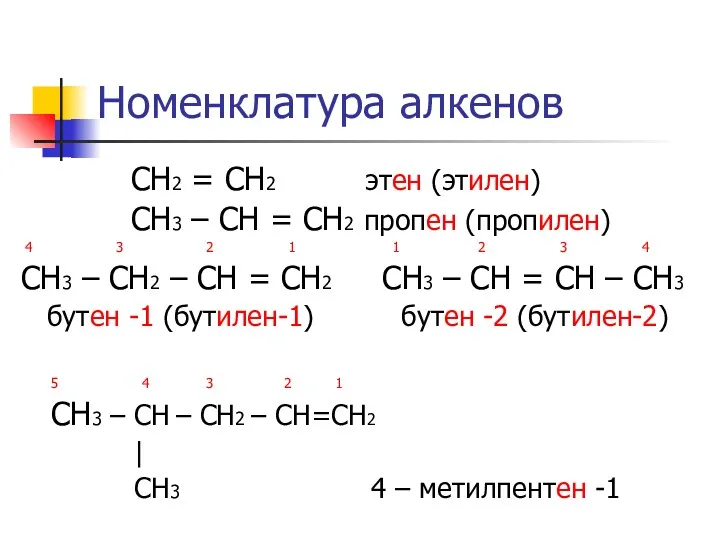
Номенклатура алкенов
СН2 = СН2 этен (этилен)
СН3 – СН =
СН2 пропен (пропилен)
4 3 2 1 1 2 3 4
СН3 – СН2 – СН = СН2 СН3 – СН = СН – СН3
бутен -1 (бутилен-1) бутен -2 (бутилен-2)
5 4 3 2 1
СН3 – СН – CH2 – CH=CH2
|
CH3 4 – метилпентен -1
Слайд 5
Слайд 6

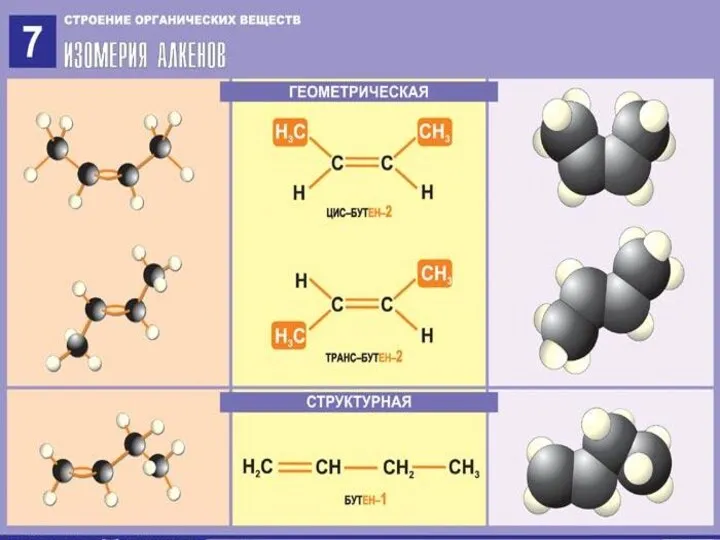
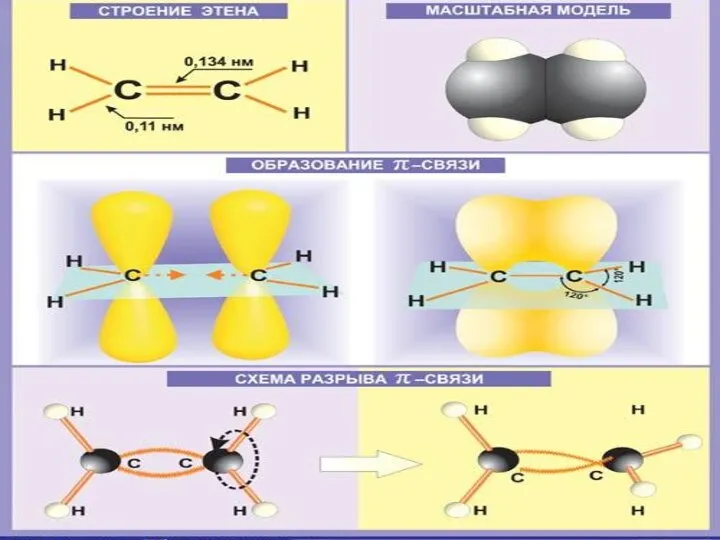
Строение алкенов
СН2 = СН2 этилен (этен)
Двойная связь: σ-связь+π-связь
Тип гибридизации: sp²
Валентный угол: 120°
Форма молекулы:
плоскостная (треугольная)
Слайд 7
Слайд 8
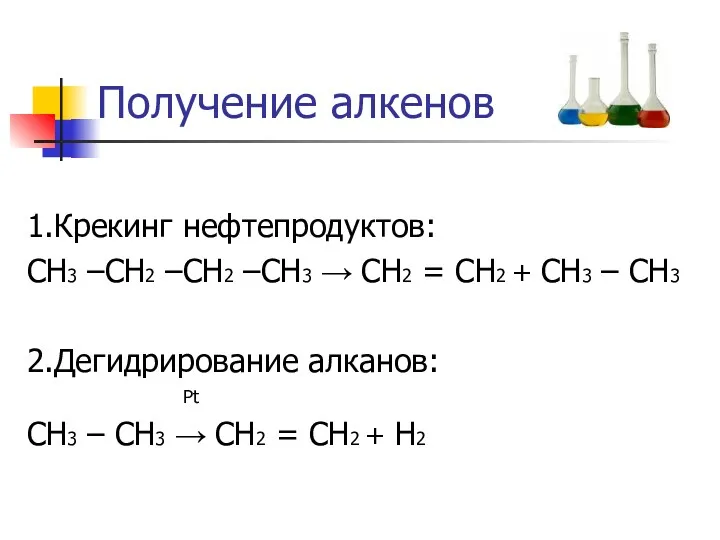
Получение алкенов
1.Крекинг нефтепродуктов:
СН3 –СН2 –СН2 –СН3 → СН2 = СН2 +
СН3 – СН3
2.Дегидрирование алканов:
Pt
СН3 – СН3 → СН2 = СН2 + Н2
Слайд 9
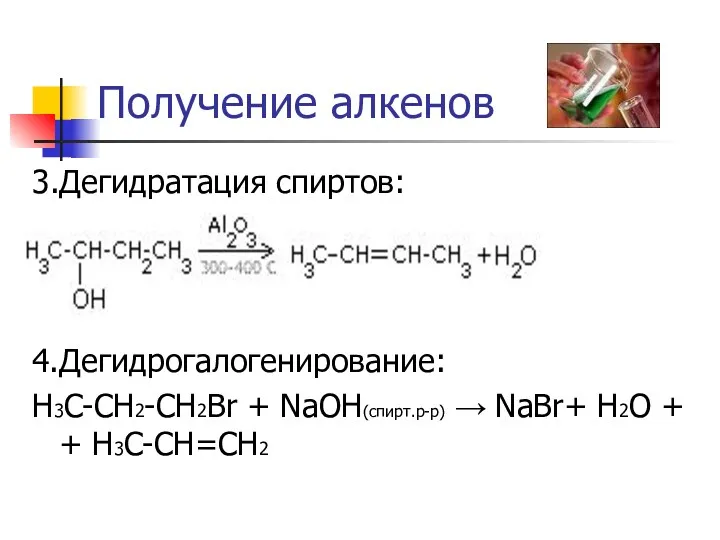
Получение алкенов
3.Дегидратация спиртов:
4.Дегидрогалогенирование:
H3C-CH2-CH2Br + NaOH(спирт.р-р) → NaBr+ H2O + + H3C-CH=CH2
Слайд 10
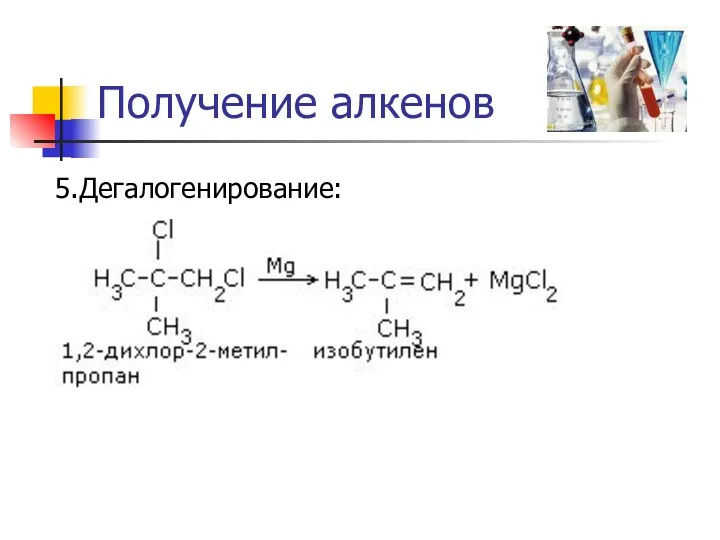
Получение алкенов
5.Дегалогенирование:
Слайд 11

Физические свойства
Этен,пропен, бутен – газы
С5Н10 – С16Н32 - жидкости
Высшие
алкены – тв.вещества
Слайд 12

Химические свойства
I.Реакции присоединения:
1.Гидрирование :
CH2=CH-CH3+Н2 → CH3-CH2-CH3
2.Галогенирование:
CH2=CH-CH3+Cl2 → CH2Cl-CHCl-CH3
3.Гидрогалогенирование:
CH2=CH-CH3+НCl
→ CH3-CHCl-CH3











 Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) 20230802_stroenie_atoma_avtosohranennyy_2
20230802_stroenie_atoma_avtosohranennyy_2 Методы очистки натрия от примесей
Методы очистки натрия от примесей Алюминий
Алюминий Количество вещества. Моль
Количество вещества. Моль Одноатомные и многоатомные спирты
Одноатомные и многоатомные спирты Окислительно-востановительные реакции в растворах
Окислительно-востановительные реакции в растворах Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения
Важнейшие классы бинарных соединений - оксиды и летучие водородные соединения Ионные уравнения
Ионные уравнения Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Химияның негізгі стехиометриялық заңдары
Химияның негізгі стехиометриялық заңдары VIIА группа: галогены
VIIА группа: галогены Периодическая таблица химических элементов
Периодическая таблица химических элементов Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Цинк и его соединения
Цинк и его соединения Гибкость цепи полимеров
Гибкость цепи полимеров Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4)
The structure and properties of the nitrogen and ammonia molecules. Industrial production of nitrogen fertilizers (topic 4.4) Игра по химии В рамках периодической таблицы
Игра по химии В рамках периодической таблицы Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Электролиз расплавов и растворов
Электролиз расплавов и растворов Процессы проявления и фиксирования
Процессы проявления и фиксирования Жидкие вещества
Жидкие вещества Определение химического элемента на основании расчетов по химическим реакциям
Определение химического элемента на основании расчетов по химическим реакциям Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Р-элементы IV Группы Периодической Системы
Р-элементы IV Группы Периодической Системы