Содержание
- 2. Задание 1 Определите степени окисления элементов в соединениях: AlCl3, MgS, Ba3N2, Cu2O, CuO Назовите вещества
- 3. Задание 2 Составьте формулы веществ по названиям Сульфид лития, оксид серы (VI); Хлорид меди (II), карбид
- 4. Важнейшие классы бинарных соединений – оксиды и летучие водородные соединения
- 5. Cu2O, CuO, SO3, Fe2O3. Определите основные признаки оксидов
- 6. I. Оксиды Оксиды – это сложные вещества, состоящие из атомов двух химических элементов, один из которых
- 7. Номенклатура оксидов: называют их просто – «оксид» «элемента» и указывают степень окисления, если она переменна. Например:
- 8. Классификация оксидов: - оксиды металлов - Na2O, СuO, Al2O3 - оксиды неметаллов - NO2, SO2, Cl2O7
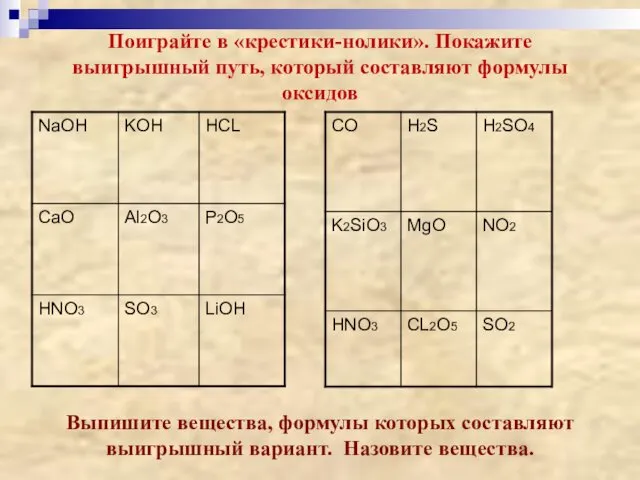
- 9. Поиграйте в «крестики-нолики». Покажите выигрышный путь, который составляют формулы оксидов Выпишите вещества, формулы которых составляют выигрышный
- 10. Выберите формулы оксидов, дайте им названия OF2N2O3MgSiO2CS2NаBr2 Fe2O3K2SK2OCaCl2CO2 OF2N2O3MgSiO2CS2NаBr2 Fe2O3K2SK2OCaCl2CO2 N2O3 – оксид азота (III) SiO2
- 11. Составьте формулы названных в тексте оксидов В земной коре – литосфере – находятся оксид алюминия …
- 12. Ответ: AL2O3, SiO2, Fe2O3, H2O, CO2, CO, SO2, NO2
- 13. Важнейшие представители оксидов
- 14. Самым распространенным оксидом на нашей планете является вода H2O Важнейшие представители оксидов
- 15. Вода (Н2О) самое распространенное вещество на нашей планете, она покрывает 71% площади поверхности Земли, льдом покрыто
- 16. Углекислый газ (CO2) CO2 – содержится в составе вулканических газов, участвует в процессе фотосинтеза, используется при
- 17. Углекислый газ (CO2) содержание углекислого газа в атмосфере 0,04-0,03%, растения, благодаря фотосинтезу, усваивают углекислый газ из
- 18. Углекислый газ (CO2) образуется углекислый газ при дыхании и сгорании топлива, при тлении и гниении органических
- 19. Угарный газ (CO) образуется при неполном сгорании топлива, в выхлопных газах. очень опасен для здоровья, загрязняет
- 20. Негашёная известь (CаO) белое тугоплавкое вещество, энергично взаимодействует с водой, образуя гашёную известь, применяемую в строительстве,
- 21. СаО
- 22. Оксид кремния (SiO2) оксиды кремния и алюминия составляют основную массу земной коры – литосферы, образуя многочисленные
- 23. SiO2 Агат Сапфир Al2O3 Рубин Яшма Опал Халцедон
- 24. Оксид алюминия (Al2O3) используется в ювелирном деле, в металлургии, как огнеупорный материал, катализатор Боксит (глина), рубин,
- 25. Оксид хрома (III) (Cr2O3) кристаллическое вещество зеленого цвета, нерастворимое в воде, используют как пигмент при изготовлении
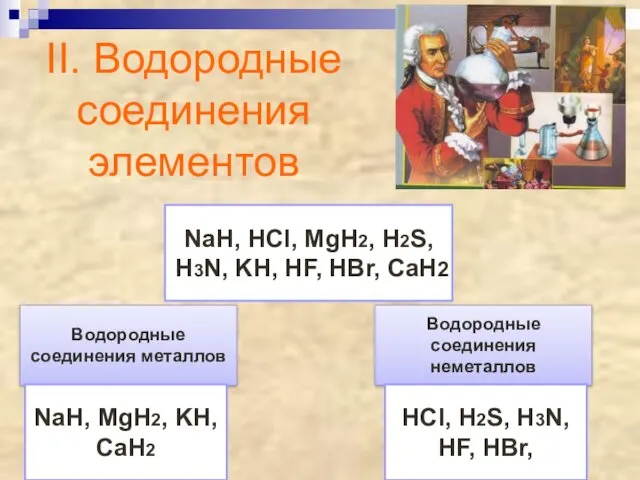
- 26. II. Водородные соединения элементов NaH, HCl, MgH2, H2S, H3N, KH, HF, HBr, CaH2 Водородные соединения металлов
- 27. 1. Водородные соединения металлов – гидриды: - твёрдые, - нелетучие, - тугоплавкие вещества, в кото- рых
- 28. 2. Водородные соединения неметаллов – летучие водородные соединения: - летучие, - как правило газообразные, - хорошо
- 29. Хлороводород (НCl) бесцветный газ, тяжелее воздуха, хорошо растворим в воде, в 1 объёме воды может раствориться
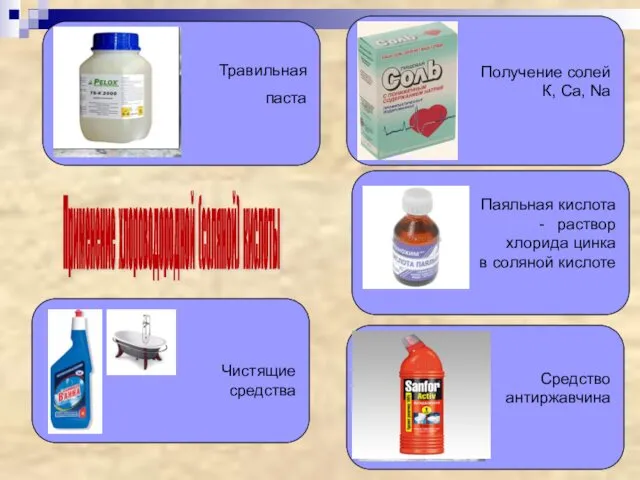
- 30. Применение хлороводородной (соляной) кислоты
- 31. Аммиак (NН3) бесцветный газ, своеобразный резкий запах, почти в 2 раза легче воздуха, хорошо растворим в
- 32. Применение аммиака Опрыскивание с/х угодий аммиачной водой
- 33. Проверь себя: 1). Оксиды – это: а) вещества, в состав которых входит водород, б) вещества, в
- 35. Скачать презентацию




























 Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ III А – топтың элементтері
III А – топтың элементтері Удивительные свойства воды
Удивительные свойства воды Гидролиз солей (11 класс)
Гидролиз солей (11 класс) Кристаллизация. Структура жидких металлов
Кристаллизация. Структура жидких металлов Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз
Глюкоза. Хімічні властивості глюкози. Сахароза, гідроліз Алкены. Строение алкенов, характерные типы химических реакций
Алкены. Строение алкенов, характерные типы химических реакций Кремнийдің құрамы, құрылысы және қасиеттері
Кремнийдің құрамы, құрылысы және қасиеттері Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химиялық элемент оттегі
Химиялық элемент оттегі Теплота горения
Теплота горения Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Фенолдар, аминдер, альдегидтер
Фенолдар, аминдер, альдегидтер СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2
СФ- И ЯМР-ИССЛЕДОВАНИЕ РЕДОКС-ПРОЦЕССОВ В СИСТЕМЕ Со(II)-ЭДТА-H2O2 Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Некоторые d-элементы
Некоторые d-элементы Пенообразование в растворах поверхностно-активных веществ. Лекция 13
Пенообразование в растворах поверхностно-активных веществ. Лекция 13 Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Химические свойства солей
Химические свойства солей Хімічні явища, їх ознаки
Хімічні явища, їх ознаки Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Алюминий. Определите элемент
Алюминий. Определите элемент 20230219_prezentatsiya_k_uroku_neft
20230219_prezentatsiya_k_uroku_neft 20231028_kislorod
20231028_kislorod Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов