Содержание
- 2. «Область соединений углерода так велика, что составляет особую отрасль химии, т.е. химии углеродистых или, лучше, углеводородистых
- 3. Положение в периодической системе 4 группа Главная подгруппа 2 период Состав атома: 6 протонов, 6 электронов,
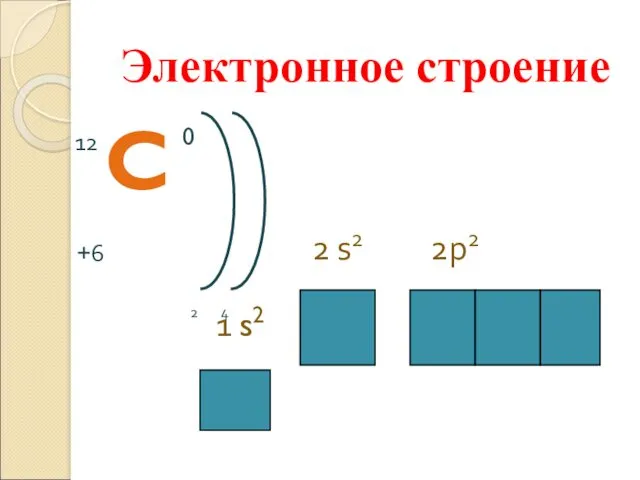
- 4. 1 s2 2 s2 2p2 Электронное строение
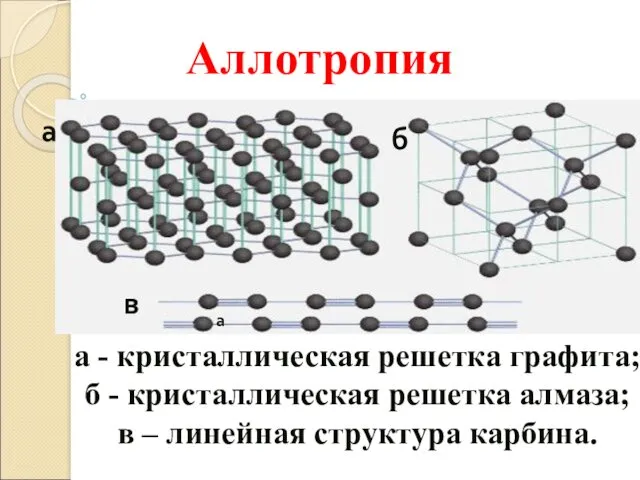
- 5. а б в а - кристаллическая решетка графита; б - кристаллическая решетка алмаза; в – линейная
- 6. А Л М А З
- 7. Звезда ордена Св. Андрея Первозванного Алмаз «Шах» Скипетр императорский
- 8. Большая императорская корона Малая императорская корона
- 9. Г Р А Ф И Т Применение графита: Электроды для электролиза Облицовка сопел ракетных двигателей Смазка
- 10. Сходное с графитом строение имеют: Сажа Древесный уголь Кокс типографская краска, картриджи, резина, косметическая тушь восстановитель
- 11. Карбин обладает полупроводниковыми свойствами, причём под воздействием света его проводимость сильно увеличивается. На этом свойстве основано
- 12. Карбин широко использоваться в различных областях, включая микроэлектронику на моноуглеродной основе, термоядерный синтез, технологии получения чистых
- 13. Карбин уже нашел применение в электронике, космонавтике, авиации и медицине. Перспективно его применение в оптике, микроволновой
- 14. Химические свойства углерода Уголь горит в избытке кислорода с образованием углекислого газа (оксида углерода (IV)): С
- 15. Химические свойства углерода При спекании угля с кальцием или оксидом кальция образуется карбид кальция СаС2: Са
- 16. Химические свойства углерода При взаимодействии угля с водородом образуется метан: С + 2Н2 = СН4. При
- 17. 1) Углерод – окислитель: а) С + Н2 б) С + Al 2) Углерод – восстановитель:
- 18. С сталь сельское хозяйство топливо медицина типография ювелирные изделия адсорбент резина крем обуви Применение
- 19. Самостоятельная работа Составить схемы электронного баланса следующих реакций: Ca + 2C = CaC2 4A1 + 3C
- 21. Скачать презентацию
















 Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Темір және оның маңызды қосылыстары
Темір және оның маңызды қосылыстары Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Общая характеристика металлов
Общая характеристика металлов Карбонильные соединения. Альдегиды и кетоны
Карбонильные соединения. Альдегиды и кетоны Пестициды. Применение пестицидов
Пестициды. Применение пестицидов Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Методы определения Тст и Тт полимеров
Методы определения Тст и Тт полимеров Простые и сложные вещества
Простые и сложные вещества Химический элемент йод
Химический элемент йод Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Виды присадок к моторным топливам (керосин)
Виды присадок к моторным топливам (керосин) Экскурсия по химическому факультету
Экскурсия по химическому факультету Химическая промышленность
Химическая промышленность Соли. Классификация
Соли. Классификация Проект Получение пресной и чистой воды
Проект Получение пресной и чистой воды Маңызды мұнай өнімдері
Маңызды мұнай өнімдері Предмет, история и задачи геохимии, положение среди других наук
Предмет, история и задачи геохимии, положение среди других наук Искусственные полимеры
Искусственные полимеры Марганец и хром
Марганец и хром Смоги и их влияние на человека
Смоги и их влияние на человека Реакции ионного обмена
Реакции ионного обмена Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Химические свойства металлов. Электрохимический ряд напряжения металлов
Химические свойства металлов. Электрохимический ряд напряжения металлов Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05
Общие закономерности адсорбции из растворов на поверхности твердого тела. Лекция 05 Оксиды. Определение
Оксиды. Определение Гидрокси(окси) кислоты
Гидрокси(окси) кислоты Разделение углеводородных газов
Разделение углеводородных газов