Содержание
- 2. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания о строении, номенклатуре и реакционной способности спиртов, фенолов и карбонильных соединений.
- 3. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ К этому классу относятся соединения, в состав которых входит карбонильная группа : Если карбонильный
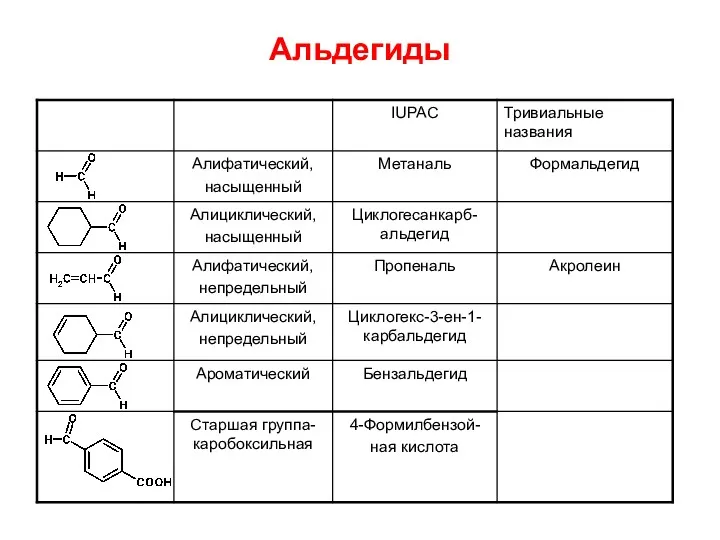
- 4. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Для альдегидов характерна изомерия углеродного скелета, начинается с С4. Для кетонов – изомерия положения
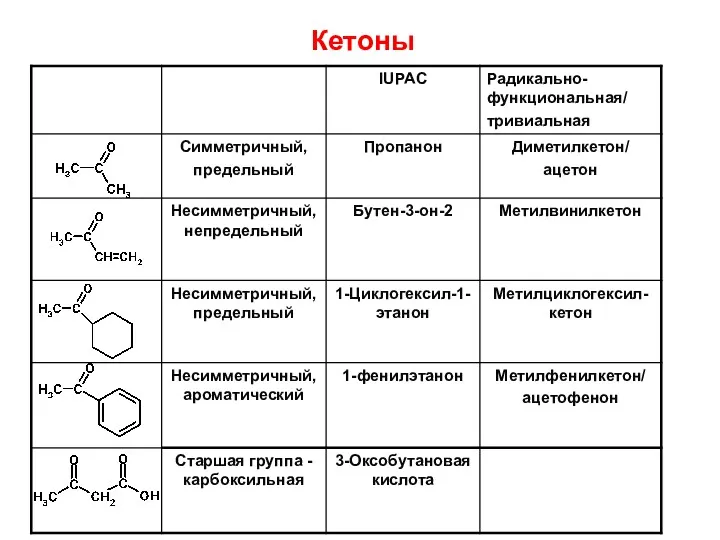
- 5. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Для кетонов также используют 3 вида номенклатуры: 1.Тривиальные названия 2.Радикально-функциональной номенклатуре кетоны называют по
- 6. Альдегиды
- 7. Кетоны
- 8. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 1. Окисление и дегидрирование первичных и вторичных спиртов В качестве окислителей чаще
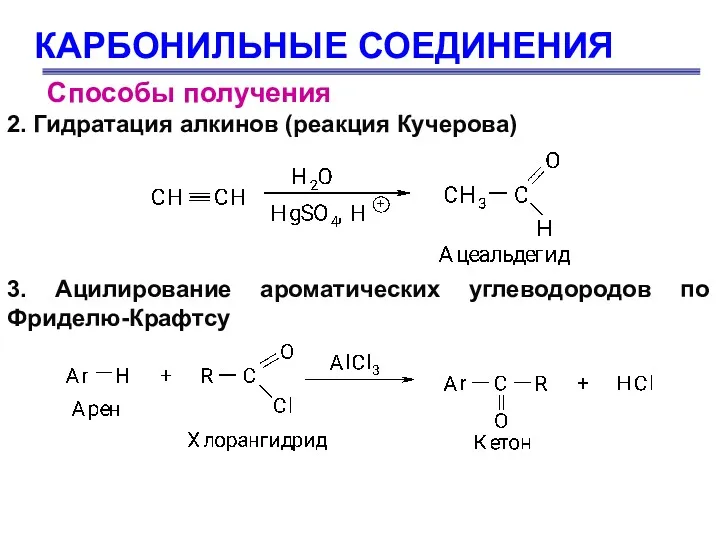
- 9. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 2. Гидратация алкинов (реакция Кучерова) 3. Ацилирование ароматических углеводородов по Фриделю-Крафтсу
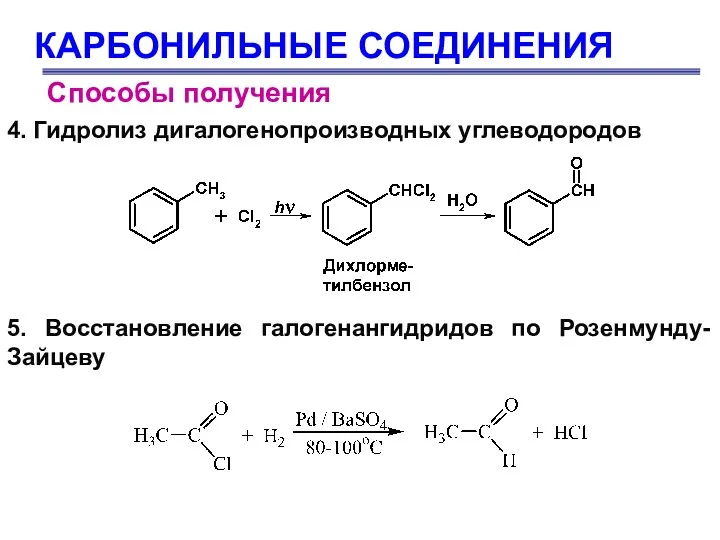
- 10. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 4. Гидролиз дигалогенопроизводных углеводородов 5. Восстановление галогенангидридов по Розенмунду-Зайцеву
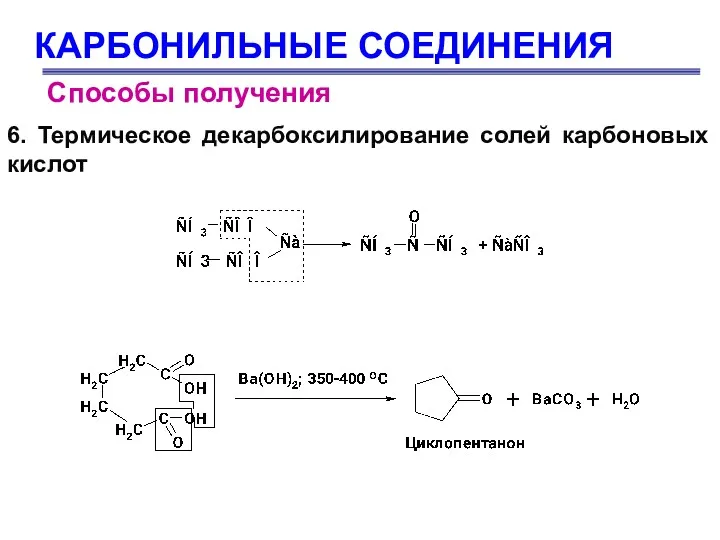
- 11. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 6. Термическое декарбоксилирование солей карбоновых кислот
- 12. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 6. Термическое декарбоксилирование солей карбоновых кислот Для получения альдегидов и кетонов используют
- 13. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 7. Взаимодействие сложных эфиров с реактивом Гриньяра Реакция эфиров муравьиной кислоты с
- 14. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 7. Взаимодействие сложных эфиров с реактивом Гриньяра Синильная кислота или нитрилы при
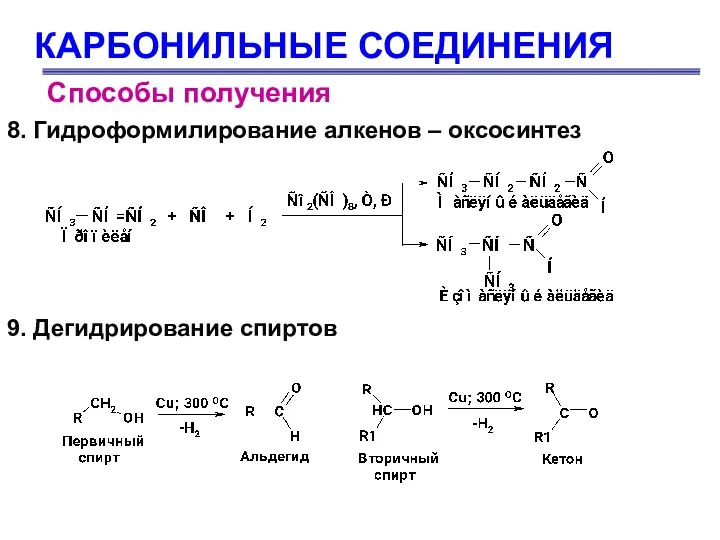
- 15. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 8. Гидроформилирование алкенов – оксосинтез 9. Дегидрирование спиртов
- 16. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 10. Окисление алкенов Дизамещенный алкен → два альдегида → две кислоты; Тризамещенный
- 17. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 10. Окисление алкенов Вакер-процесс: каталитическое окисление этена в ацетальдегида. Основной промышленный способ
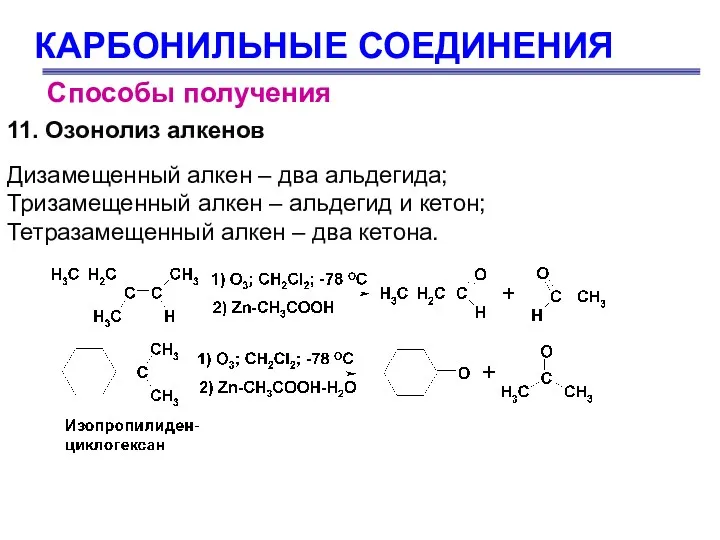
- 18. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Способы получения 11. Озонолиз алкенов Дизамещенный алкен – два альдегида; Тризамещенный алкен – альдегид
- 19. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Физические свойства альдегидов и кетонов Формальдегид – газ с резким запахом, растворим в воде.
- 20. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Физические свойства альдегидов и кетонов Плотность альдегидов и кетонов меньше единицы. При одном и
- 21. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Строение карбонильной группы Атом углерода карбонильной группы находится в состоянии sp2-гибридизации. Его конфигурация плоская:
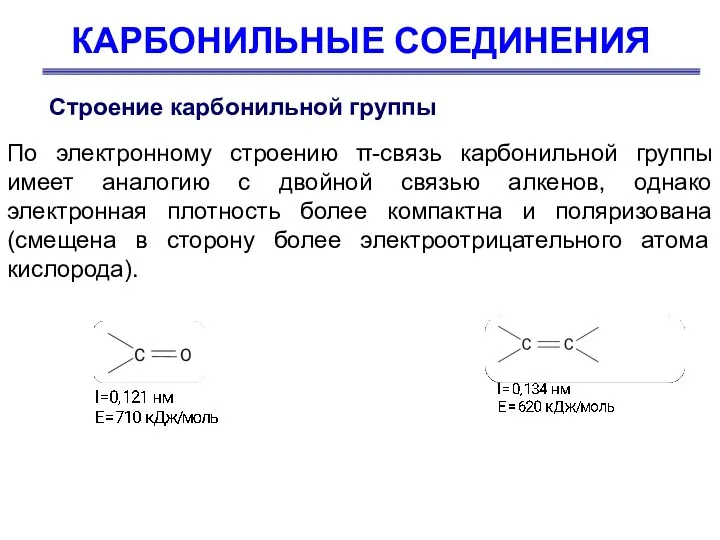
- 22. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Строение карбонильной группы По электронному строению π-связь карбонильной группы имеет аналогию с двойной связью
- 23. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Строение карбонильной группы В силу значительной полярности связи C = О она склонна к
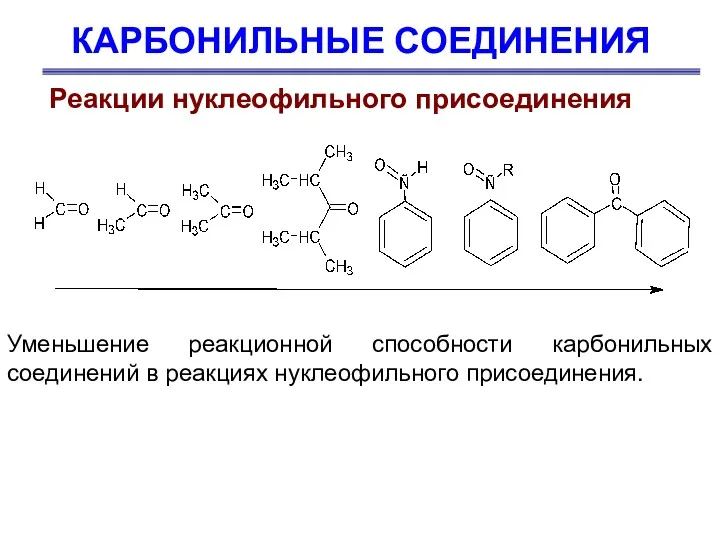
- 24. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Реакции нуклеофильного присоединения Реакционная способность карбонильных соединений в реакциях нуклеофильного присоединения определяется пространственными и
- 25. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Реакции нуклеофильного присоединения Уменьшение реакционной способности карбонильных соединений в реакциях нуклеофильного присоединения.
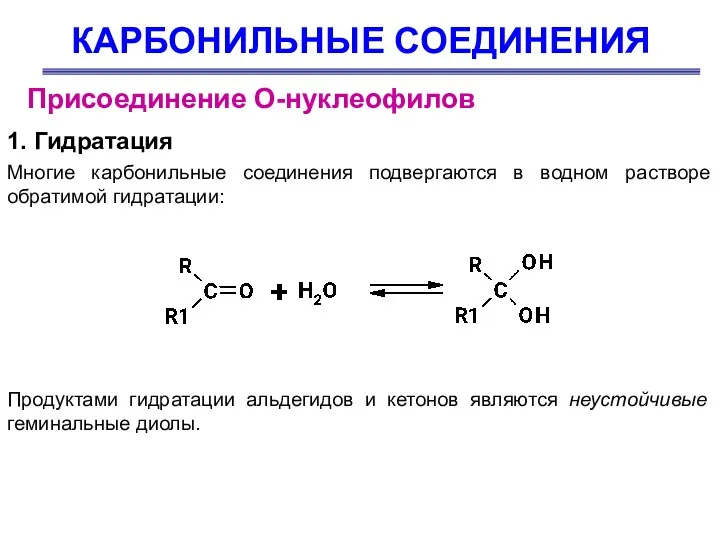
- 26. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 1. Гидратация Многие карбонильные соединения подвергаются в водном растворе обратимой гидратации: Продуктами
- 27. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 1. Гидратация Гидратация может протекать в условиях как общего кислотного, так и
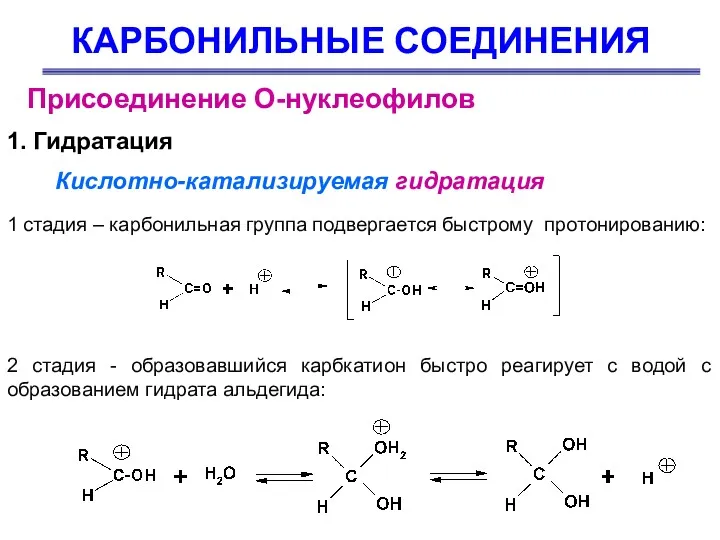
- 28. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 1. Гидратация Кислотно-катализируемая гидратация 1 стадия – карбонильная группа подвергается быстрому протонированию:
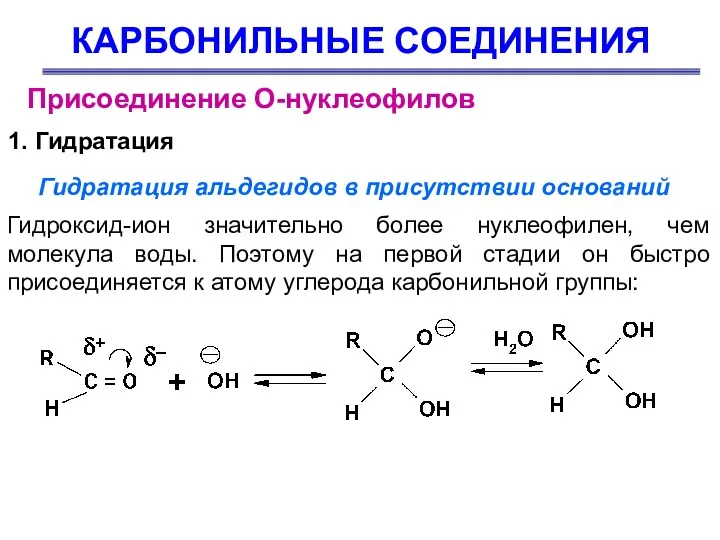
- 29. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 1. Гидратация Гидратация альдегидов в присутствии оснований Гидроксид-ион значительно более нуклеофилен, чем
- 30. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 1. Гидратация Электронодонорные заместители ингибируют образование гидрата, тогда как электроноакцепторные заместители активируют
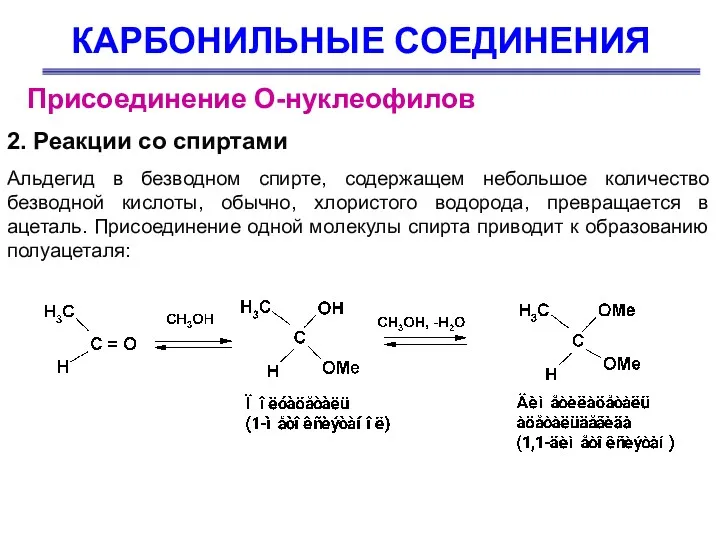
- 31. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов Альдегид в безводном спирте, содержащем небольшое количество безводной кислоты, обычно, хлористого водорода,
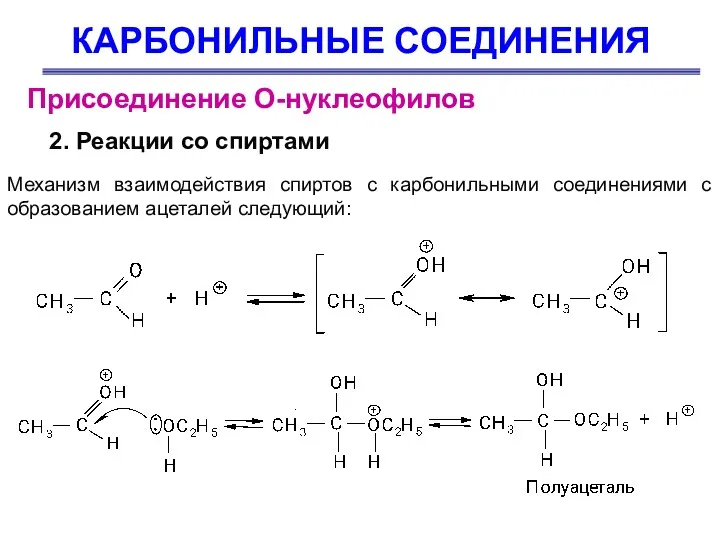
- 32. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 2. Реакции со спиртами Механизм взаимодействия спиртов с карбонильными соединениями с образованием
- 33. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 2. Реакции со спиртами Полуацеталь представляет собой спирт и простой эфир одновременно,
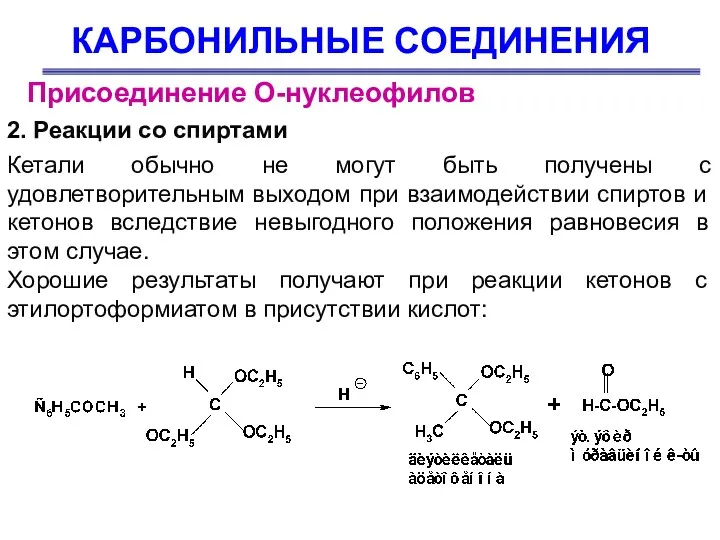
- 34. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов 2. Реакции со спиртами Кетали обычно не могут быть получены с удовлетворительным
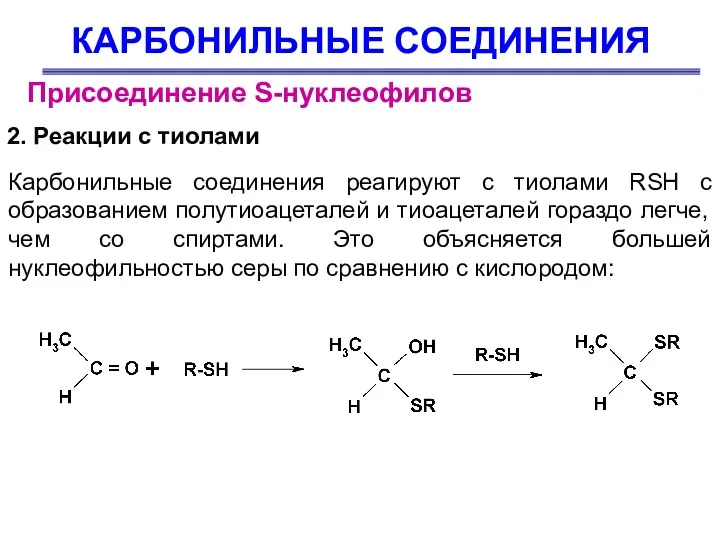
- 35. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение S-нуклеофилов 2. Реакции с тиолами Карбонильные соединения реагируют с тиолами RSH с образованием
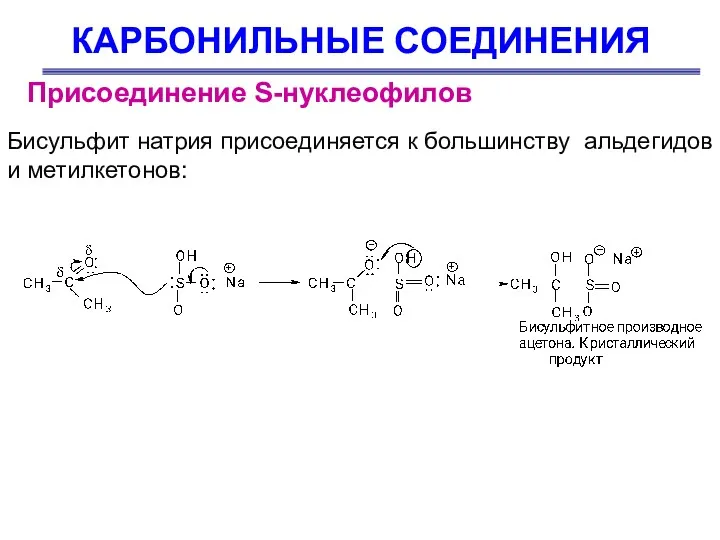
- 36. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение S-нуклеофилов Бисульфит натрия присоединяется к большинству альдегидов и метилкетонов:
- 37. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение S-нуклеофилов Эту реакцию используют для очистки карбонильных соединений: полученный кристаллический продукт отделяют от
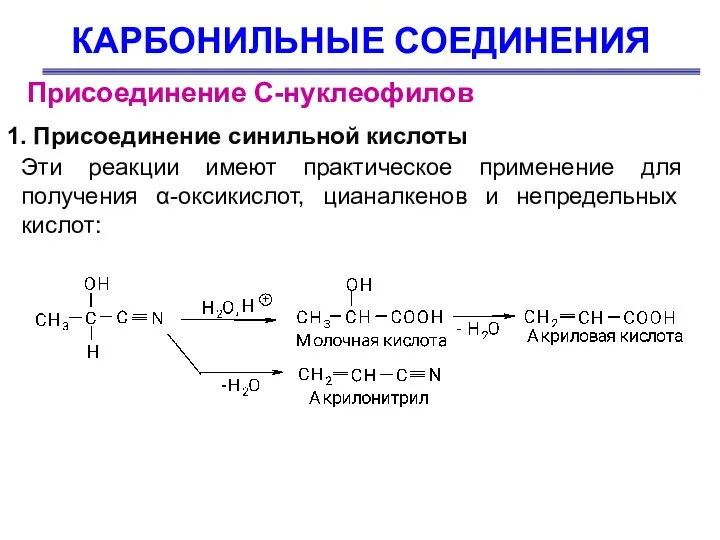
- 38. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение С-нуклеофилов 1. Присоединение синильной кислоты Цианистый водород присоединяется ко многим альдегидам и кетонам,
- 39. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение С-нуклеофилов Присоединение –CN обратимо и в отсутствие донора протонов смещается в сторону исходных
- 40. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение С-нуклеофилов Эти реакции имеют практическое применение для получения α-оксикислот, цианалкенов и непредельных кислот:
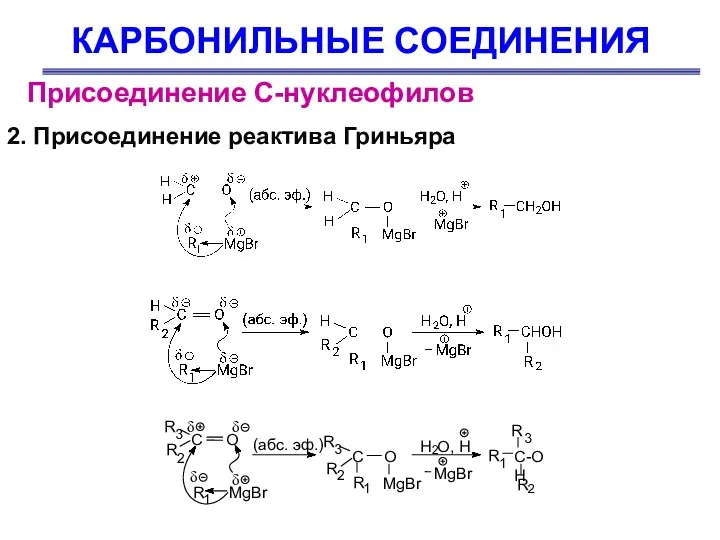
- 41. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение С-нуклеофилов 2. Присоединение реактива Гриньяра
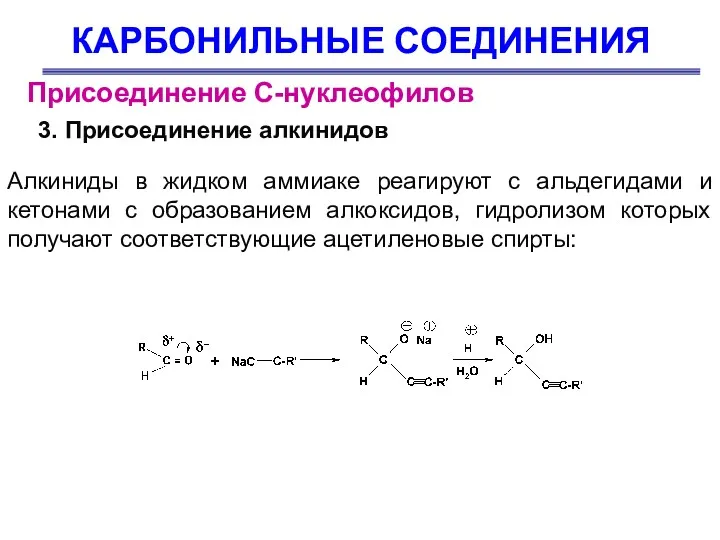
- 42. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение С-нуклеофилов 3. Присоединение алкинидов Алкиниды в жидком аммиаке реагируют с альдегидами и кетонами
- 43. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение - отщепление Известен ряд реакций нуклеофильного присоединения к группе С = О
- 44. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение - отщепление Реакция с N-нуклеофилами представляет собой различные реакции аммиака, первичных и
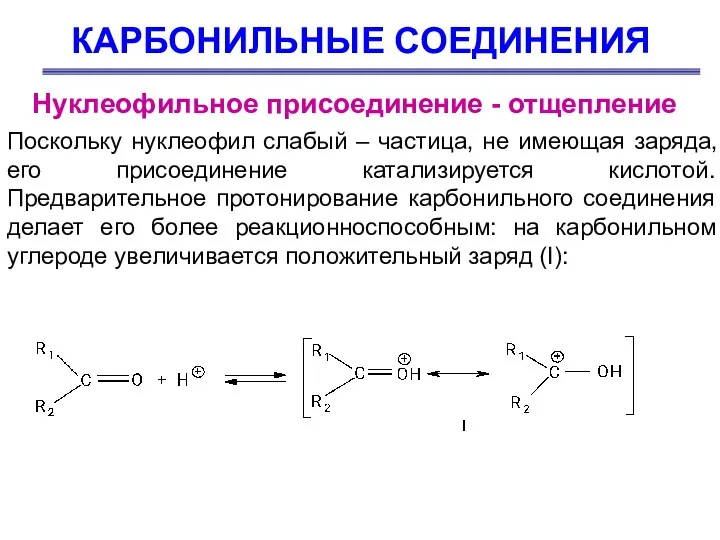
- 45. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение - отщепление Поскольку нуклеофил слабый – частица, не имеющая заряда, его присоединение
- 46. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение - отщепление На второй стадии электрофильный атом углерода, несущий положительный заряд, подвергается
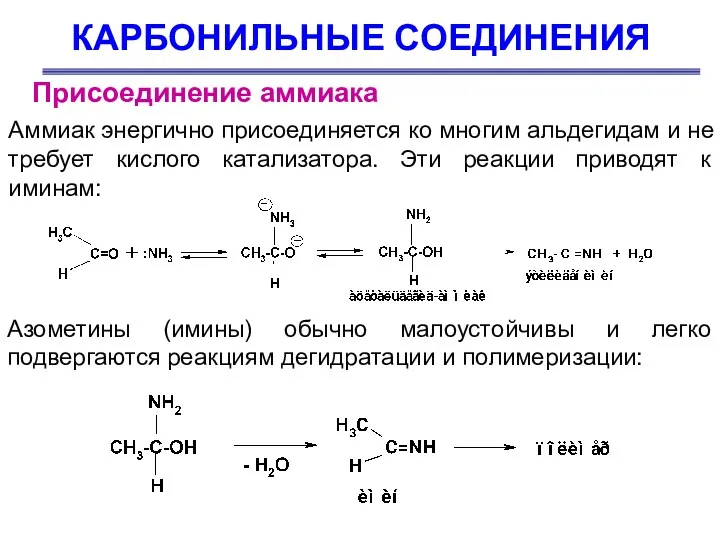
- 47. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Аммиак энергично присоединяется ко многим альдегидам и не требует кислого катализатора. Эти реакции приводят
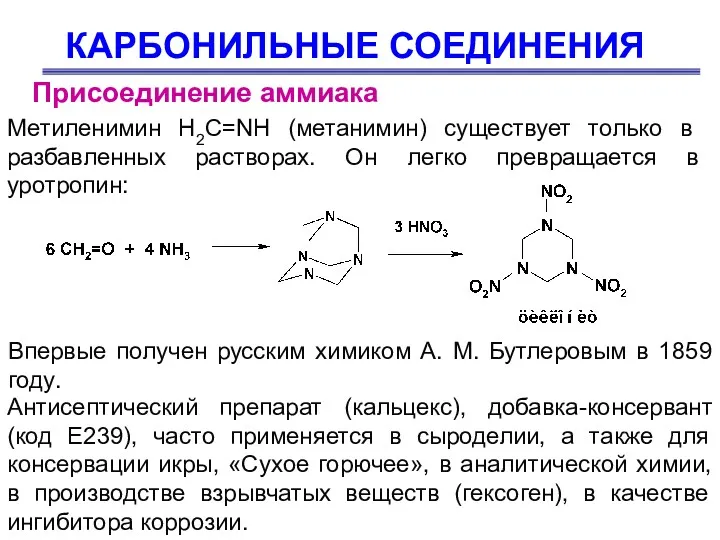
- 48. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение аммиака Метиленимин H2C=NH (метанимин) существует только в разбавленных растворах. Он легко превращается в
- 49. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Реакции альдегидов и кетонов с первичными аминами ведет к получению N-замещенных иминов, которые являются
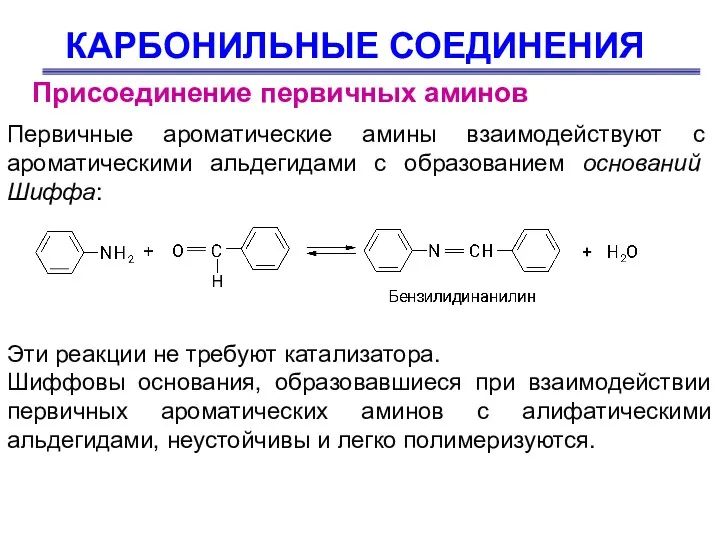
- 50. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение первичных аминов Первичные ароматические амины взаимодействуют с ароматическими альдегидами с образованием оснований Шиффа:
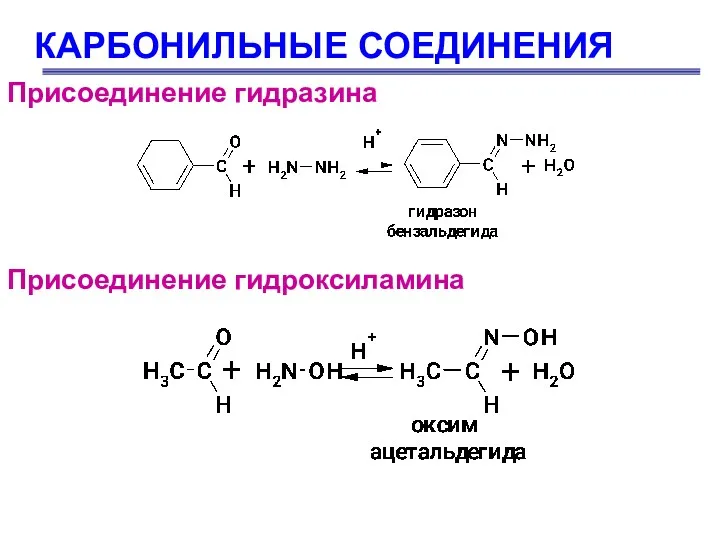
- 51. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение гидразина Присоединение гидроксиламина
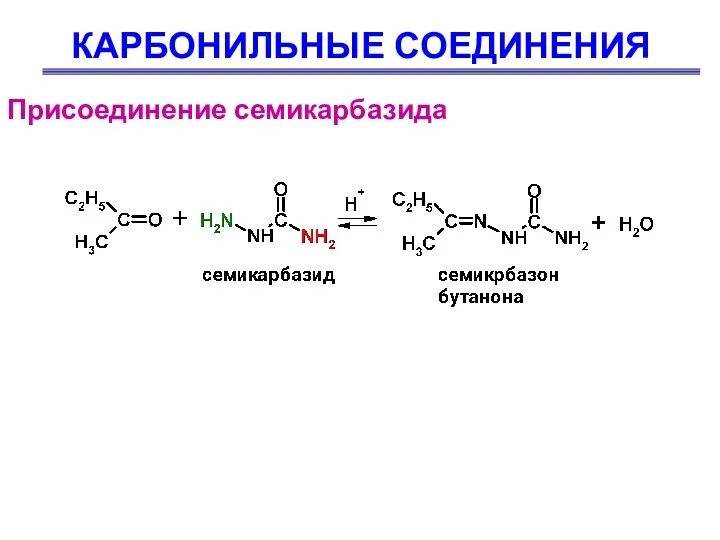
- 52. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение семикарбазида
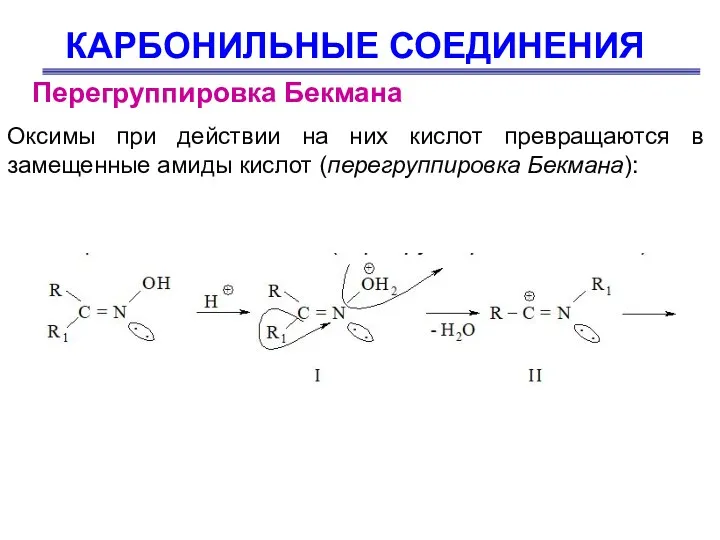
- 53. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Перегруппировка Бекмана Оксимы при действии на них кислот превращаются в замещенные амиды кислот (перегруппировка
- 54. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Перегруппировка Бекмана Сначала происходит протонирование оксима (I) и отщепление воды. Синхронно с отщеплением воды
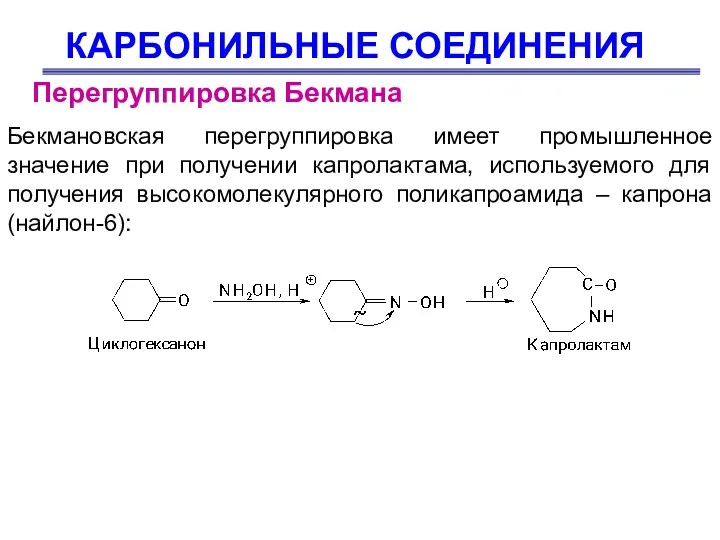
- 55. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Бекмановская перегруппировка имеет промышленное значение при получении капролактама, используемого для получения высокомолекулярного поликапроамида –
- 56. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Реакции енольных форм альдегидов и кетонов СН-Кислотность и кетоенольная таутомерия Под влиянием карбонильной группы
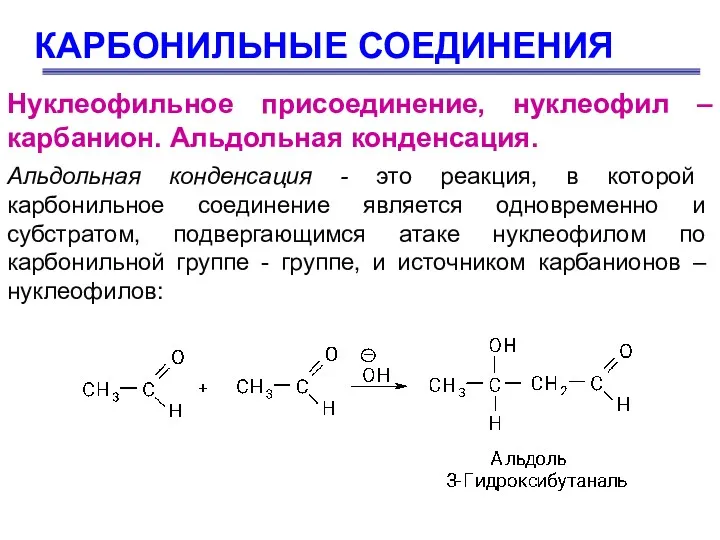
- 57. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение, нуклеофил – карбанион. Альдольная конденсация. Альдольная конденсация - это реакция, в которой
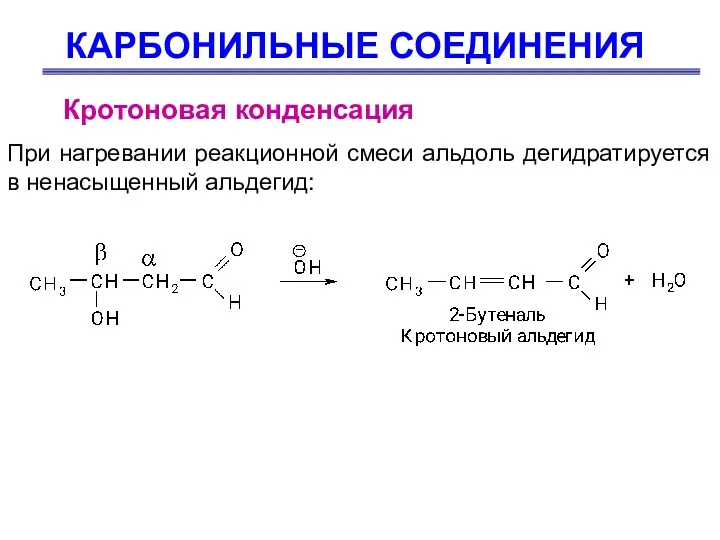
- 58. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Кротоновая конденсация При нагревании реакционной смеси альдоль дегидратируется в ненасыщенный альдегид:
- 59. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Кротоновая конденсация Протекание реакции дегидратации можно объяснить тем, что альдоль содержит α-Н-атомы, которые могут
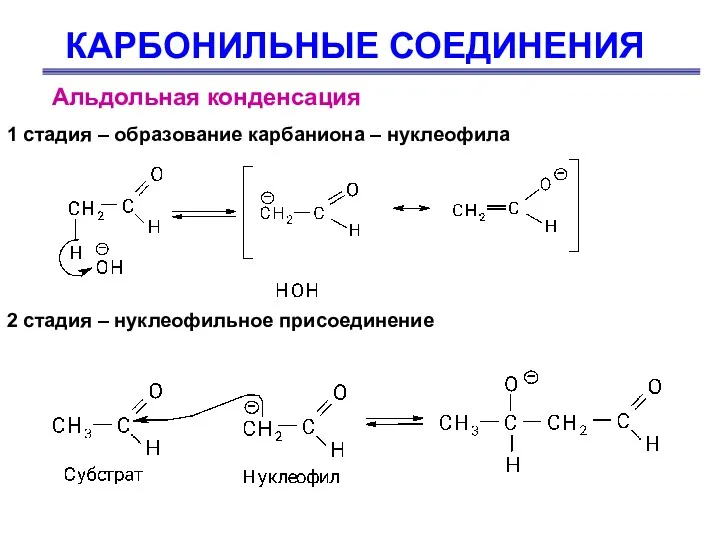
- 60. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Альдольная конденсация 1 стадия – образование карбаниона – нуклеофила 2 стадия – нуклеофильное присоединение
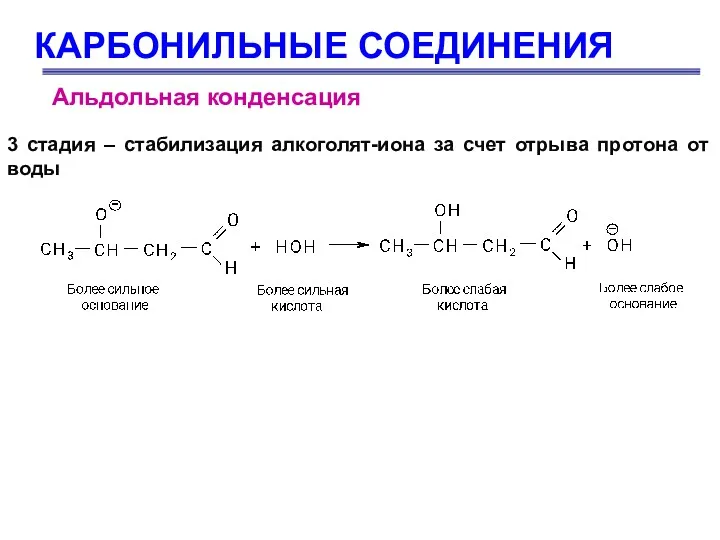
- 61. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Альдольная конденсация 3 стадия – стабилизация алкоголят-иона за счет отрыва протона от воды
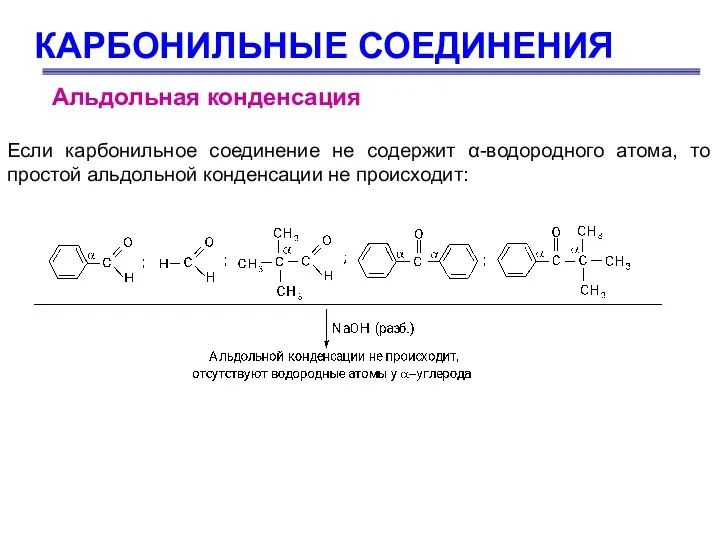
- 62. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Альдольная конденсация Если карбонильное соединение не содержит α-водородного атома, то простой альдольной конденсации не
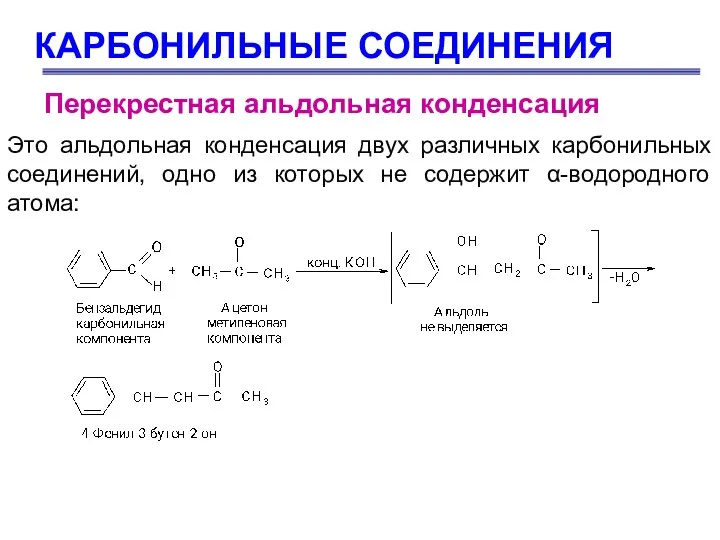
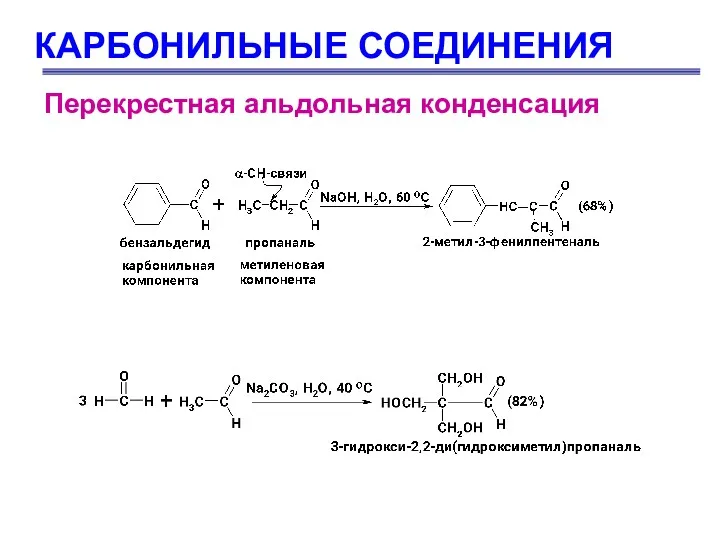
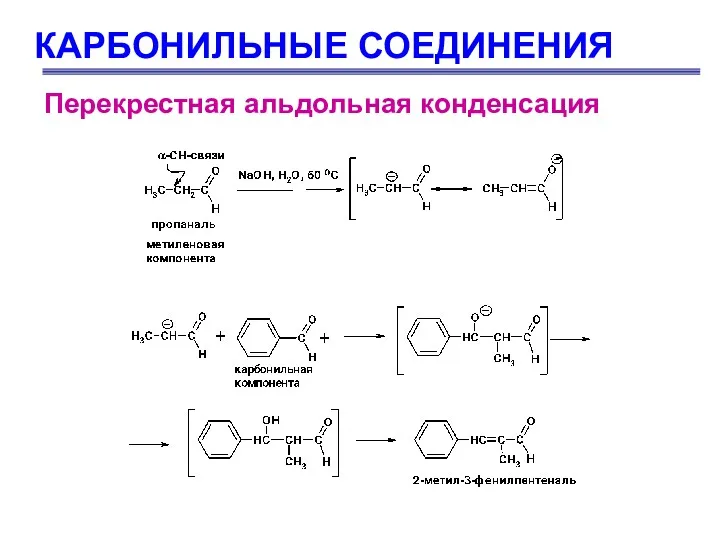
- 63. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Перекрестная альдольная конденсация Это альдольная конденсация двух различных карбонильных соединений, одно из которых не
- 64. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Перекрестная альдольная конденсация
- 65. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Перекрестная альдольная конденсация
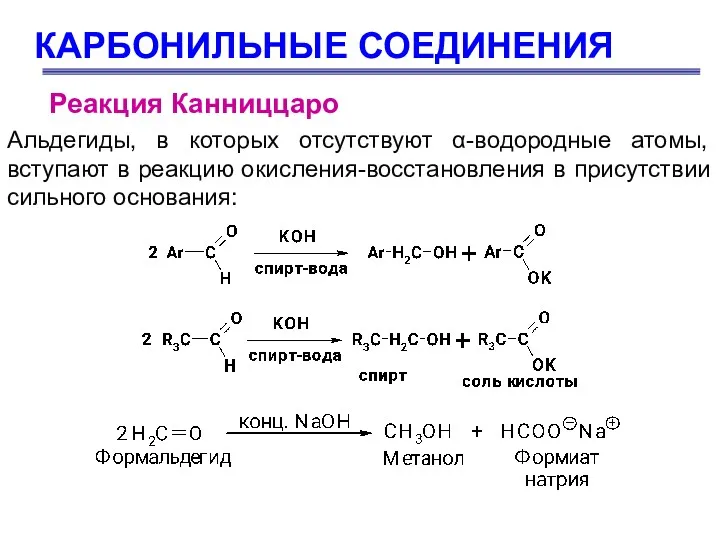
- 66. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Реакция Канниццаро Альдегиды, в которых отсутствуют α-водородные атомы, вступают в реакцию окисления-восстановления в присутствии
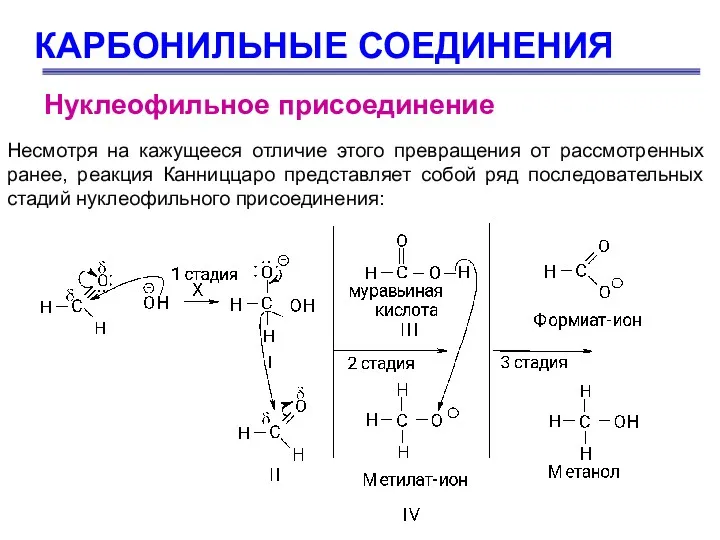
- 67. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Несмотря на кажущееся отличие этого превращения от рассмотренных ранее, реакция Канниццаро представляет собой ряд
- 68. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Нуклеофильное присоединение 1 стадия – нуклеофильное присоединение иона ОН с образованием промежуточного соединения (I);
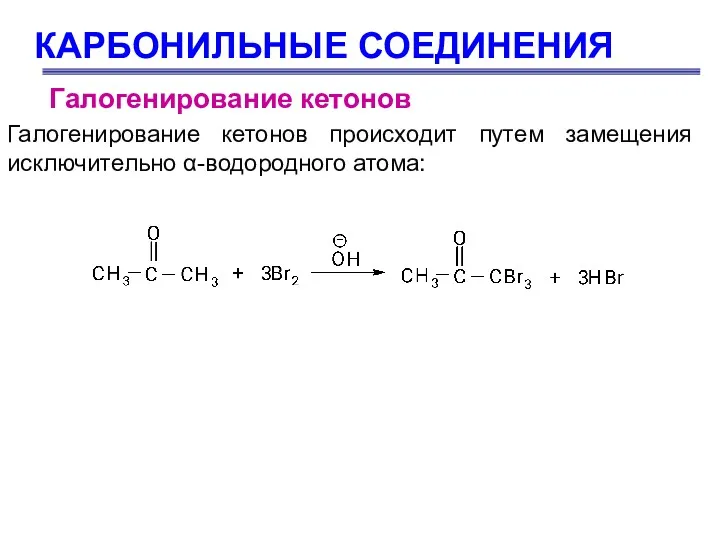
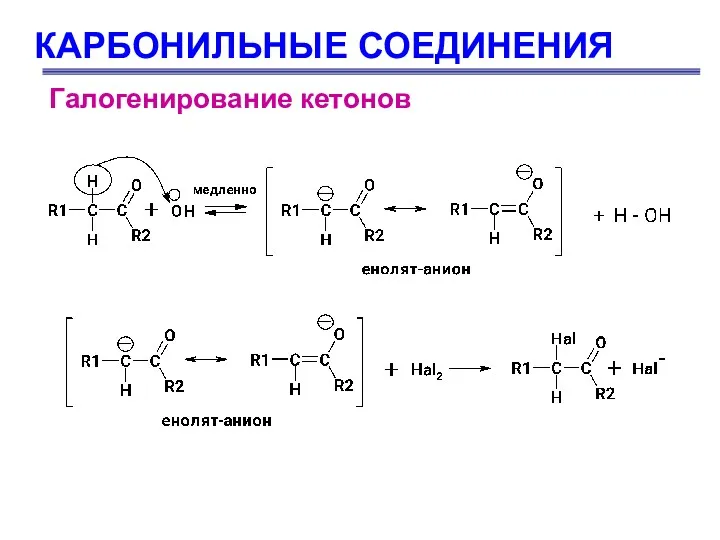
- 69. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Галогенирование кетонов Галогенирование кетонов происходит путем замещения исключительно α-водородного атома:
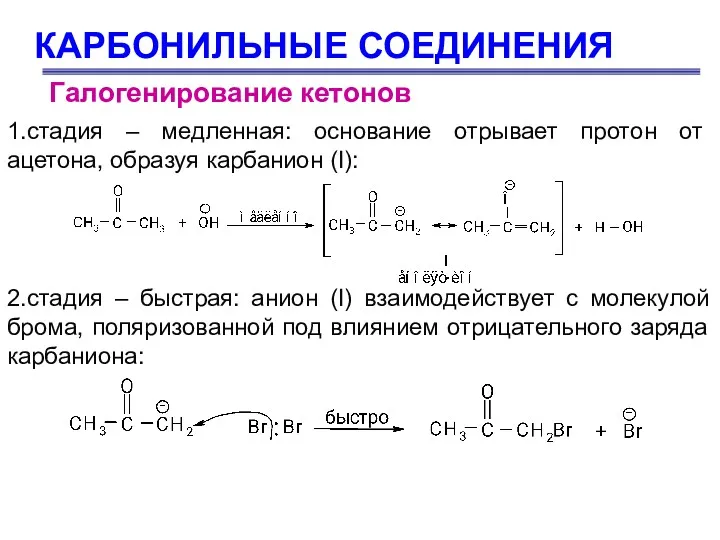
- 70. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Галогенирование кетонов 1.стадия – медленная: основание отрывает протон от ацетона, образуя карбанион (I): 2.стадия
- 71. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Галогенирование кетонов
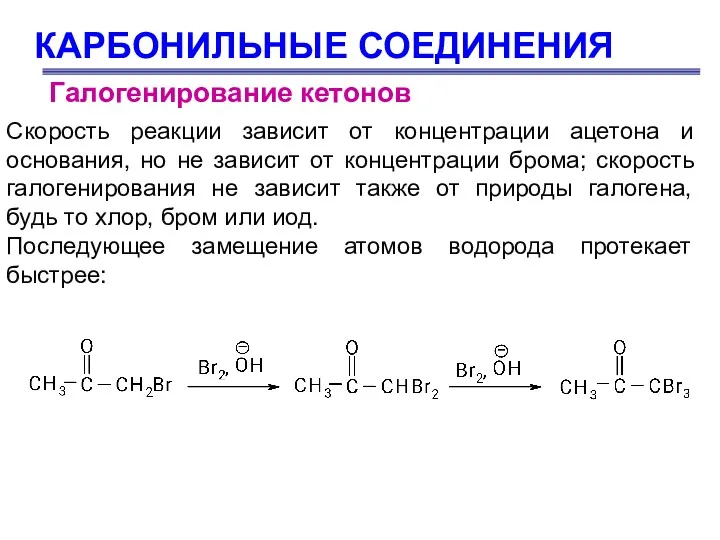
- 72. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Галогенирование кетонов Скорость реакции зависит от концентрации ацетона и основания, но не зависит от
- 73. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Взаимодействие альдегидов и кетонов с пентахлоридом фосфора Альдегиды и кетоны при взаимодействии с РCl5
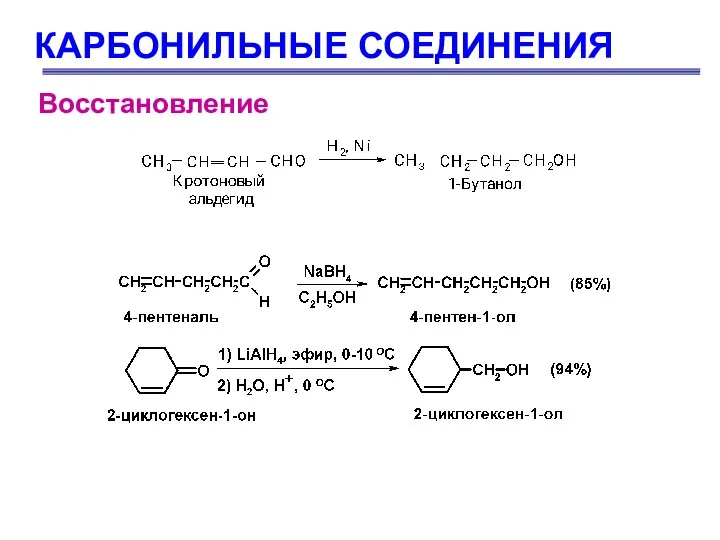
- 74. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Восстановление
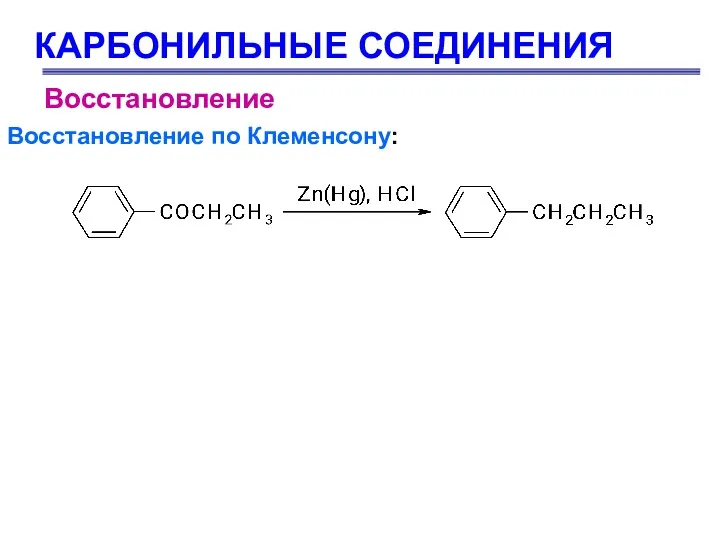
- 75. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Восстановление Восстановление по Клеменсону:
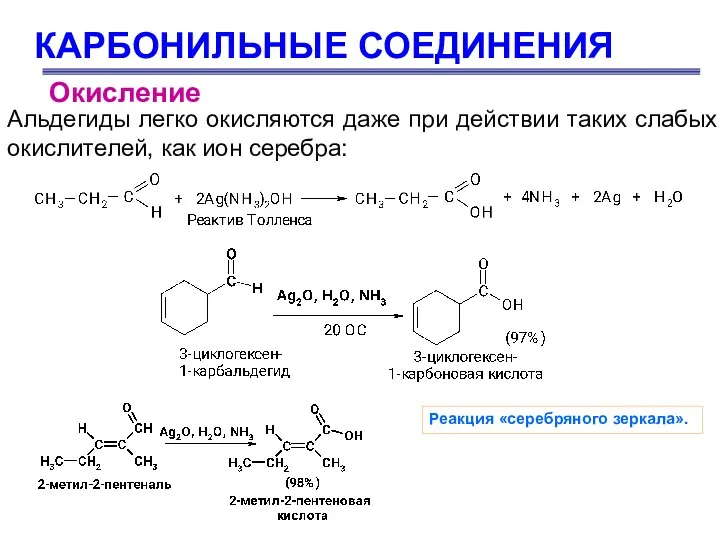
- 76. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Альдегиды легко окисляются даже при действии таких слабых окислителей, как ион серебра: Окисление Реакция
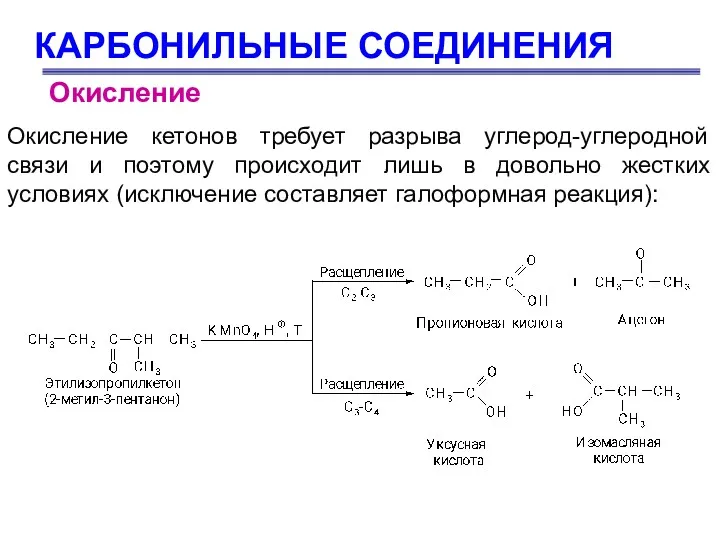
- 77. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Окисление кетонов требует разрыва углерод-углеродной связи и поэтому происходит лишь в довольно жестких условиях
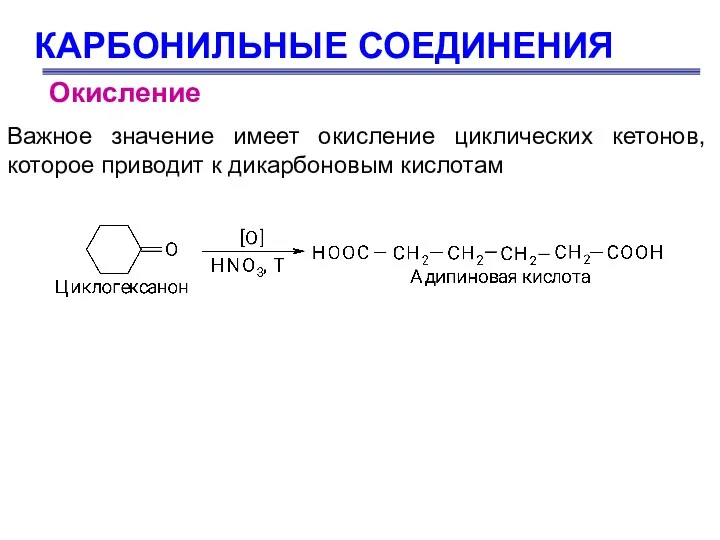
- 78. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Важное значение имеет окисление циклических кетонов, которое приводит к дикарбоновым кислотам Окисление
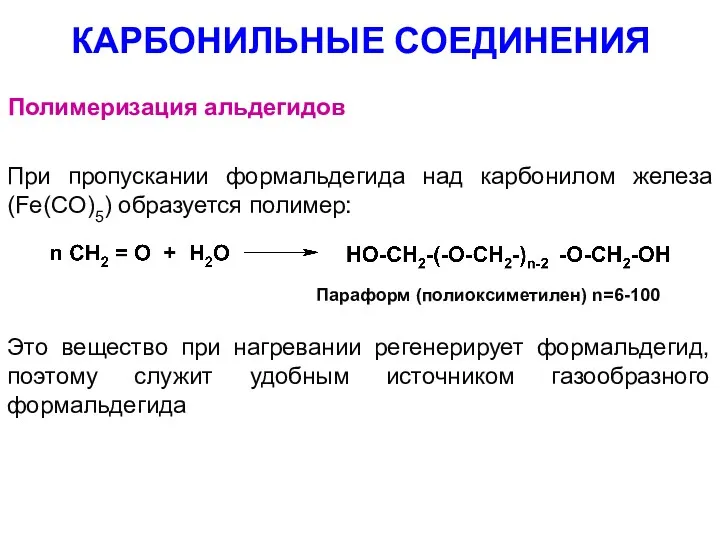
- 79. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Полимеризация альдегидов При пропускании формальдегида над карбонилом железа (Fe(CO)5) образуется полимер: Параформ (полиоксиметилен) n=6-100
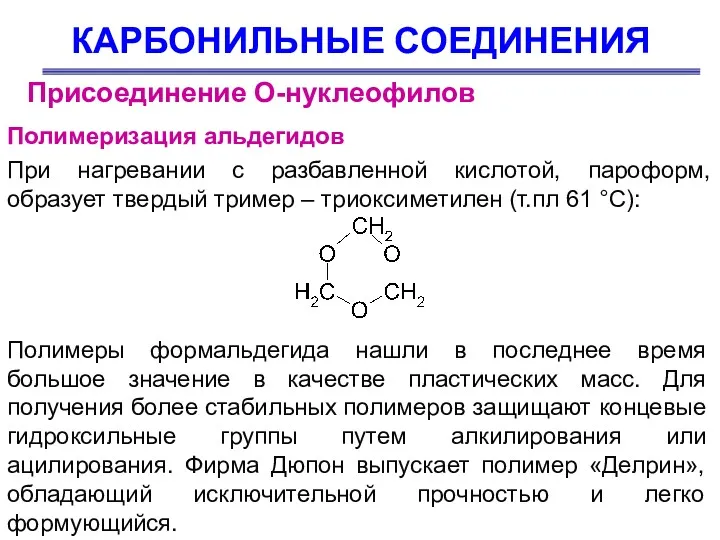
- 80. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов Полимеризация альдегидов При нагревании с разбавленной кислотой, пароформ, образует твердый тример –
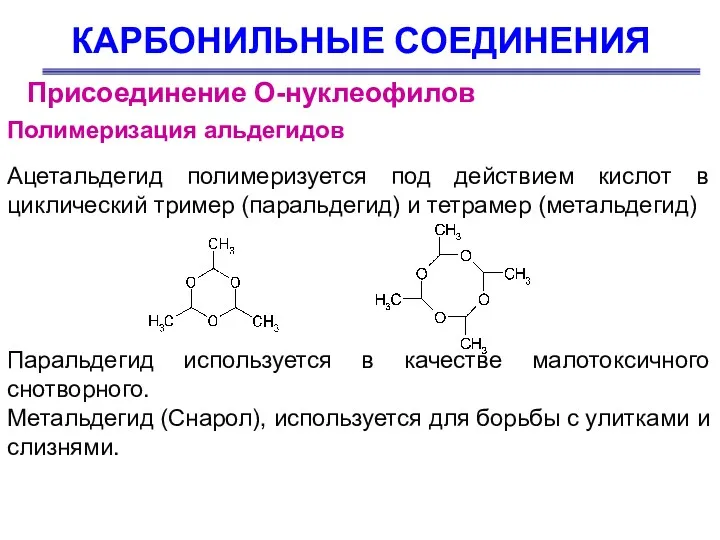
- 81. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Присоединение О-нуклеофилов Полимеризация альдегидов Ацетальдегид полимеризуется под действием кислот в циклический тример (паральдегид) и
- 82. КАРБОНИЛЬНЫЕ СОЕДИНЕНИЯ Отдельные представители Муравьиный альдегид Муравьиный альдегид (формальдегид) – бесцветный газ с резким запахом, очень
- 84. Скачать презентацию































 Мембранное материаловедение. Топливные элементы
Мембранное материаловедение. Топливные элементы Камни и Козерог
Камни и Козерог Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution
Elements 17 (7A) group. Study of the properties of halogens and the determination of halide ions in aqueous solution Классификация химических реакций
Классификация химических реакций Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність
Алюміній: загальна характеристика, властивості , добування, застосування. Алюміній оксид, алюміній гідроксид, їх амфотерність Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Классы неорганических соединений
Классы неорганических соединений Простые вещества - неметаллы. 8 класс
Простые вещества - неметаллы. 8 класс Альдегиды и кетоны
Альдегиды и кетоны Карбонові кислоти. Хімія. 9 клас
Карбонові кислоти. Хімія. 9 клас Фенолфармальдегидные смолы
Фенолфармальдегидные смолы Дисперсные системы
Дисперсные системы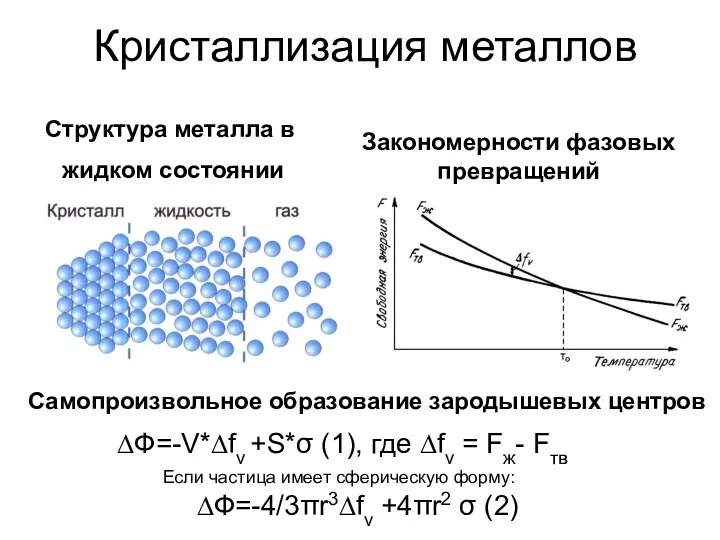 Закономерности фазовых превращений
Закономерности фазовых превращений Органическая химия
Органическая химия Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Основания
Основания Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Тіршілік процесіне қатысатын гетерофункционалды қосылыстар
Тіршілік процесіне қатысатын гетерофункционалды қосылыстар Хімічні та фізичні явища
Хімічні та фізичні явища Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Методы прямого секвенирования белков (пептидов)
Методы прямого секвенирования белков (пептидов) Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Материаловедение. Химия функциональных материалов
Материаловедение. Химия функциональных материалов Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2)
Газохимия. Абсорбционно-газофракционирующая установка. (Лекция 5.2) Электроповерхностные явления. Строение двойного электрического слоя
Электроповерхностные явления. Строение двойного электрического слоя Оксиды. Классификация и химические свойства
Оксиды. Классификация и химические свойства