Содержание
- 2. План лекции Введение. Предмет науки химия. Основные разделы и понятия. Материя, вещество. Физические и химические свойства
- 3. п1. Введение. Предмет науки химия. Основные разделы и понятия. Материя, вещество. Физические и химические свойства вещества
- 4. 4 п.2. Строение вещества. Строение атома. Качественная и количественная характеристика состава атомов Квантово- механическая модель атома
- 5. Особенности микромира Квантование энергии: энергия микрообъекта изменяется не непрерывно, а дискретно, порциями (квантами) Корпускулярно-волновой дуализм микрообъекта
- 6. 6 п. 3. Строение электронных оболочек атомов. Квантовые числа. Энергетические уровни и подуровни, атомные электронные орбитали
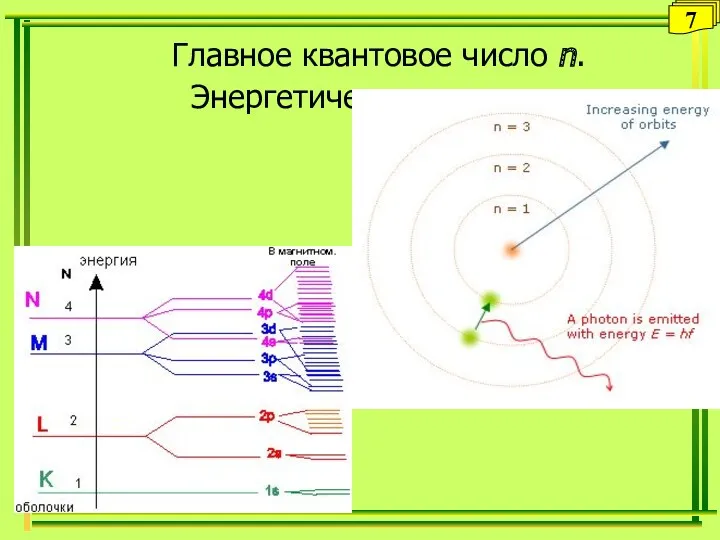
- 7. Главное квантовое число n. Энергетические уровни 7
- 8. Орбитальное квантовое число l. Энергетические подуровни. Формы электронных орбиталей l = 0, 1, 2, 3…… (n-1)
- 9. Формы электронных орбиталей 9
- 10. Магнитное квантовое число (ml) ml = -l…… -1, 0, +1……+l Значения l Значения ml 10 ml
- 11. Формы электронных орбиталей 11
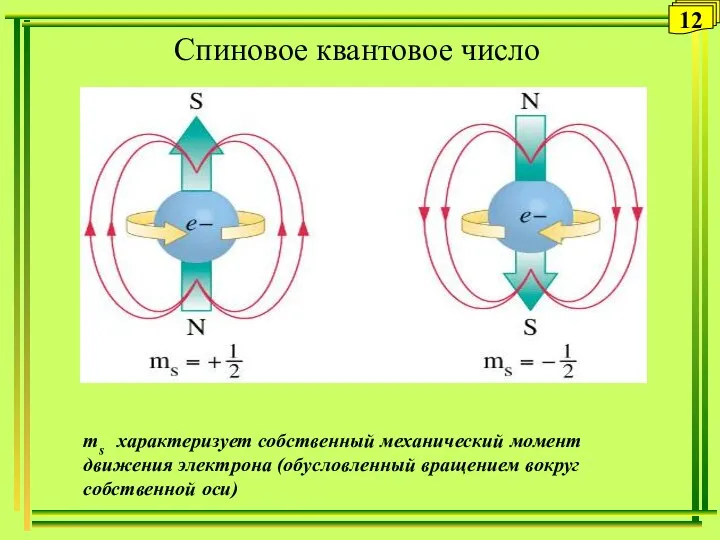
- 12. Спиновое квантовое число s 12 ms характеризует собственный механический момент движения электрона (обусловленный вращением вокруг собственной
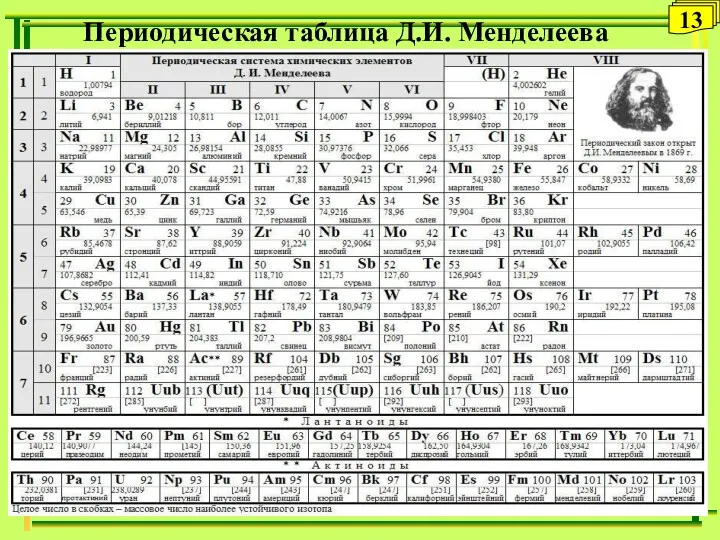
- 13. Периодическая таблица Д.И. Менделеева 13
- 14. 14 п.4. Правила составления электронных формул и схем строения электронных оболочек атомов (принцип минимальной энергии, правила
- 15. Правило Клечковского Клечковский Всеволод Маврикиевич (1900 -1972) Россия, 1961 Правило Клечковского: Электрон занимает в основном состоянии
- 16. 16 Электронная формула (конфигурация) атома 1H: 1s1 2He: 1s2 10Ne: 1s22s22p6 18Ar: 1s22s22p6 3s23p6 22Ti 1s22s22p6
- 17. Вольфганг Эрнст Паули (1900 – 1958) Австрия, 1940 Лауреат нобелевской премии (1945) Принцип Паули: В атоме
- 18. Фридрих Хунд (1896 – 1997) Германия \ Правило Хунда: При данном значении l (т. е. в
- 19. 19 п.5. Химические (окислительные, восстановительные) свойства атомов химических элементов и порядок их определения Окислители и восстановители
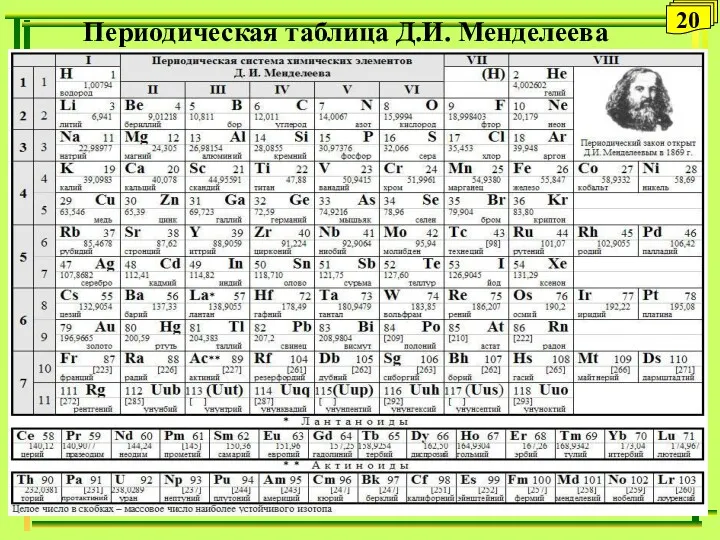
- 20. Периодическая таблица Д.И. Менделеева 20
- 21. Литература Кафедра химии УрГАУ/ ВКонтакте Vk.com/club86527277 Тел кафедры: 221-41-03 1. О.С. Габриелян и др. Химия. Учебное
- 22. 22 Вопросы к экзамену по общей и неорганической химии 1. Понятия: материя, вещество. Предмет науки химия
- 24. Скачать презентацию

















 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки