Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты презентация
Содержание
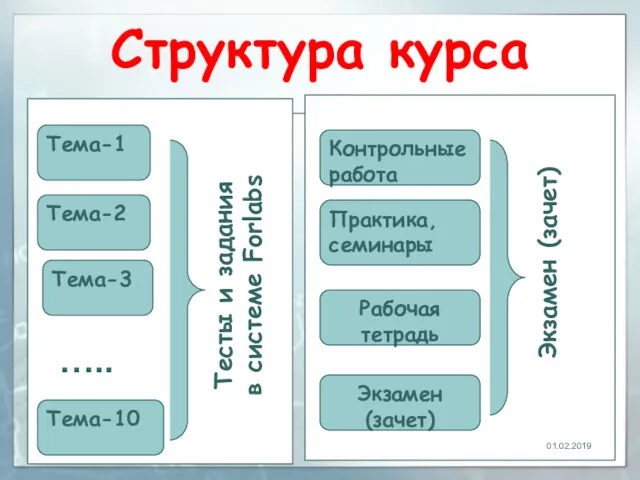
- 2. Структура курса 01.02.2019 Тема-1 Тема-10 Тема-2 Тема-3 Тесты и задания в системе Forlabs Практика, семинары Рабочая
- 3. Темы курса Тема 1 – Общая и неорганическая химия Тема 2 – Элементы периодической системы Д.И.
- 4. Темы курса Тема 7– Состав средств декоративной косметики Тема 8 – Красители, состав средств ухода за
- 5. Оценка по курсу 01.02.2019 Тема-1 Тема-5 Практика Рабочая тетрадь Экзамен (зачёт) 30% 20% 20% 20% После
- 6. Фармацевтическая промышленность
- 7. Искусственные волокна
- 8. Пластмассы
- 9. Синтетические каучуки
- 10. Продукты оргсинтеза Этиловый спирт Красители Взрывчатые вещества В настоящее время известно более 1 750 000 органических
- 11. Топливная промышленность
- 12. Косметическая химия (от греч. κοσμητική – искусство украшать) наука о строении и свойствах веществ, используемых в
- 13. Косметическая химия развивалась вместе с накоплением сведений о лекарствах и лекарственных растениях, вместе с развитием медицины,
- 15. Ряды Рихтера и триады Дёберейнера Немецкий химик И.В. Рихтер в 1793 г. расположил металлы, обладающие близкими
- 16. Группы элементов Гесса В изданном в 1849 г. учебнике "Основания чистой химии", российский химик Г.И. Гесс
- 17. Спираль Шанкуртуа или «теллурический винт» В 1862 году французский ученый А. Бегье де Шанкуртуа сгруппировал элементы
- 18. Закон октав В 1865 г. американский химик Дж. Ньюлендс предложил "закон октав". В таблице Ньюлендса близкие
- 19. Таблица Лотара Мейера В 1864 г. немецкий химик Л.Ю. Мейер в книге "Современные теории химии и
- 20. Периодический закон и периодическая система химических элементов Д.И. Менделеев, 1869г. Создание учебника «Основы химии»
- 21. Периодический закон «Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости
- 22. Периодическая система химических элементов Д.И. Менделеева (1873 г.)
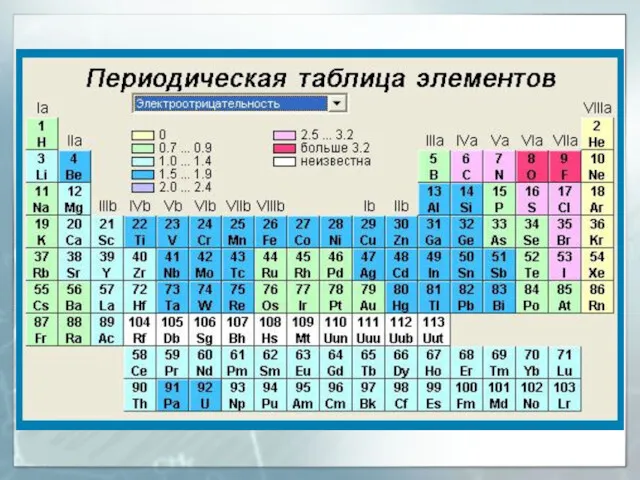
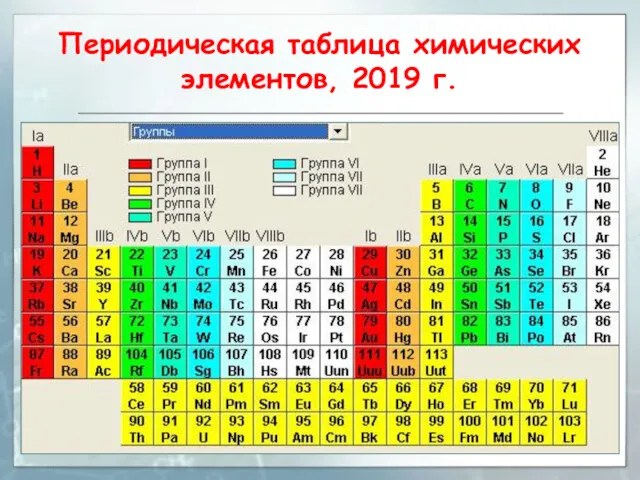
- 23. Периодическая таблица химических элементов, 2019 г.
- 24. Атомные массы и периодическая система химических элементов Менделеев учитывал, что для некоторых элементов атомные массы могли
- 25. Атомная орбиталь (АО) область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
- 26. Типы атомных орбиталей Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-,
- 27. Форма и энергия атомных орбиталей Атомные орбитали s-типа имеют форму сферы: Объем сферы увеличивается с ростом
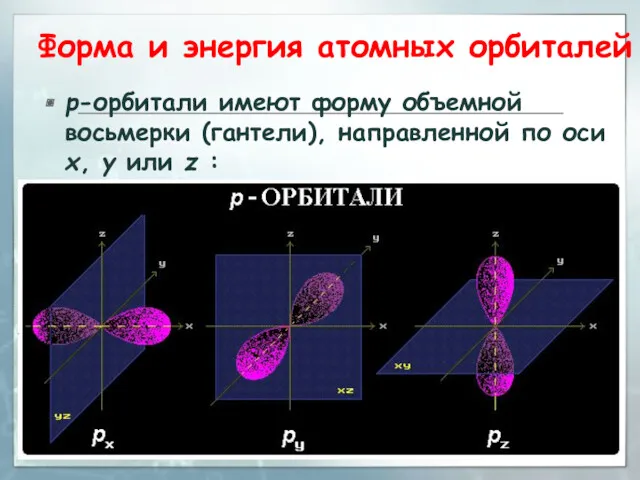
- 28. Форма и энергия атомных орбиталей р-орбитали имеют форму объемной восьмерки (гантели), направленной по оси x, y
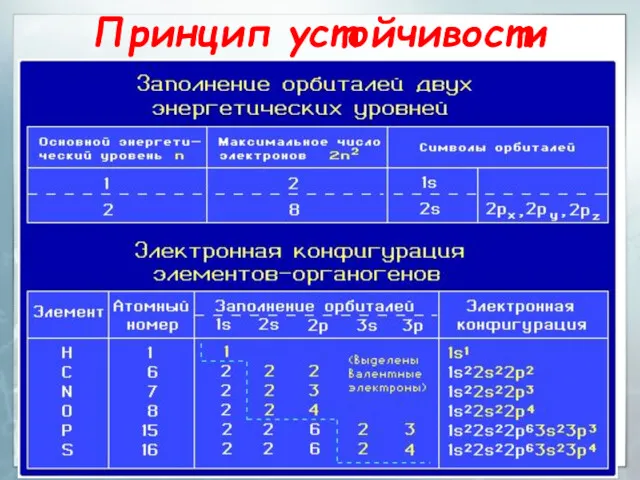
- 29. В элементах второго периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй
- 30. Заполнение атомных орбиталей электронами Принцип устойчивости АО заполняются электронами в порядке повышения их энергетических уровней: 1s
- 31. Принцип устойчивости
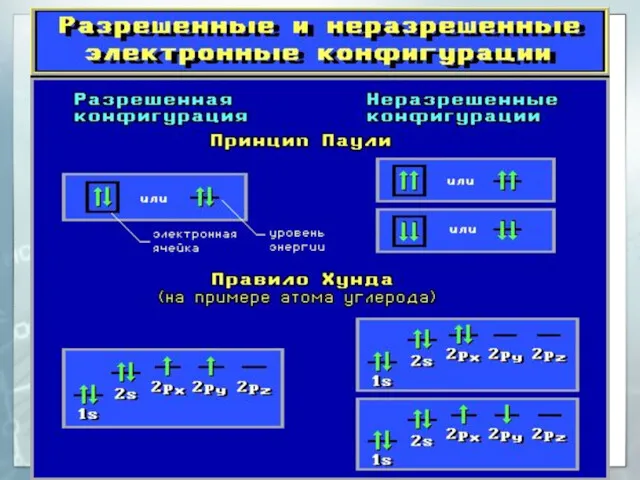
- 32. Заполнение атомных орбиталей электронами Принцип Паули На одной АО могут находиться не более двух электронов с
- 33. Заполнение атомных орбиталей электронами Правило Хунда (Гунда) На АО с одинаковой энергией, так называемых вырожденных орбиталях,
- 35. Квантовые числа энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится: 1.
- 36. Квантовые числа Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра
- 37. Квантовые числа Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать
- 38. Квантовые числа Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l
- 39. Квантовые числа Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они
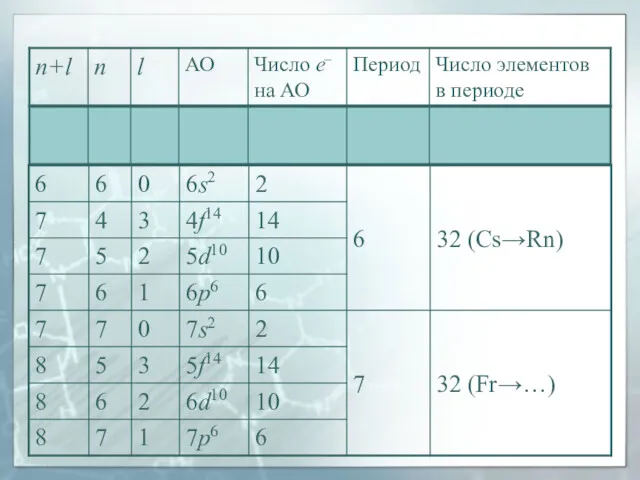
- 40. Правило Клечковского (правило n + l ) Заселение электронами энергетических уровней и подуровней в нейтральных атомах
- 41. Магнитные свойства Атомы или ионы, имеющие только спаренные электроны, выталкиваются из магнитного поля (они диамагнитны). Примеры:
- 42. Магнитные свойства Атомы или ионы, имеющие один или несколько неспаренных электронов, втягиваются в магнитное поле (они
- 43. Энергия ионизации Энергия (потенциал) ионизации атома Ei - минимальная энергия, необходимая для удаления электрона из атома:
- 44. Сродство к электрону Сродство атома к электрону Ee – способность атомов присоединять добавочный электрон и превращаться
- 45. Электроотрицательность (абсолютная электроотрицательность) Лайнус-Карл ПОЛИНГ (28.02.1901 – 19.08.1994)
- 46. Предсказание химических элементов Менделеев оставил в таблице пустые места для не открытых элементов (экабор, экаалюминий, экасилиций,
- 47. Физический смысл порядкового номера элемента А.И. Ван ден Брук (1870-1926) предположил, что "каждому элементу должен соответствовать
- 48. Периодический закон сегодня: "Свойства химических элементов, а также образуемых ими простых и сложных веществ находятся в
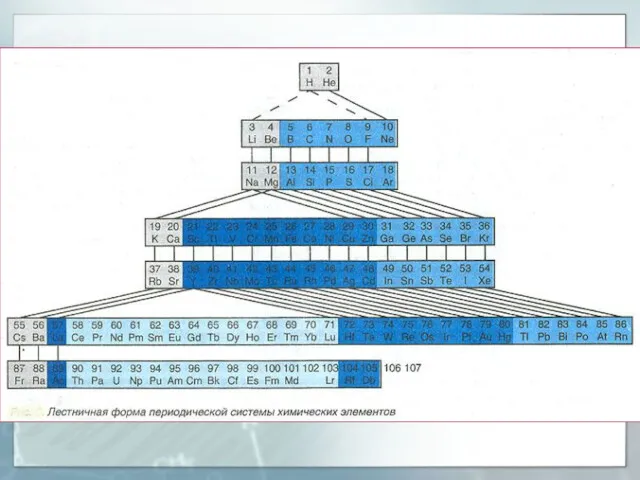
- 49. Структура периодической системы элементов Периодическая система химических элементов - классификация химических элементов, являющаяся табличным выражением периодического
- 53. Период и группа Период – горизонтальная последовательность элементов, начинающаяся со щелочного металла и заканчивающаяся благородным газом;
- 56. Периодичность Периодичность – это повторяемость свойств химических и физических свойств элементов и их соединений по определенному
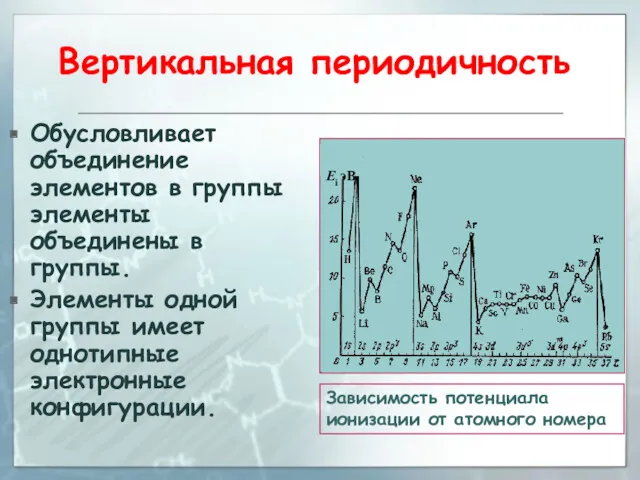
- 57. Вертикальная периодичность Обусловливает объединение элементов в группы элементы объединены в группы. Элементы одной группы имеет однотипные
- 58. Горизонтальная периодичность Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений
- 59. Горизонтальная периодичность
- 60. Диагональная периодичность Повторяемость свойств простых веществ и соединений по диагоналям Периодической системы; связана с возрастанием неметаллических
- 61. Диагональная периодичность Примеры: литий похож по свойствам на магний, бериллий на алюминий, бор на кремний, углерод
- 62. Звездная периодичность Пример: свойства германия напоминают свойства его соседей – галлия, кремния, мышьяка и олова. На
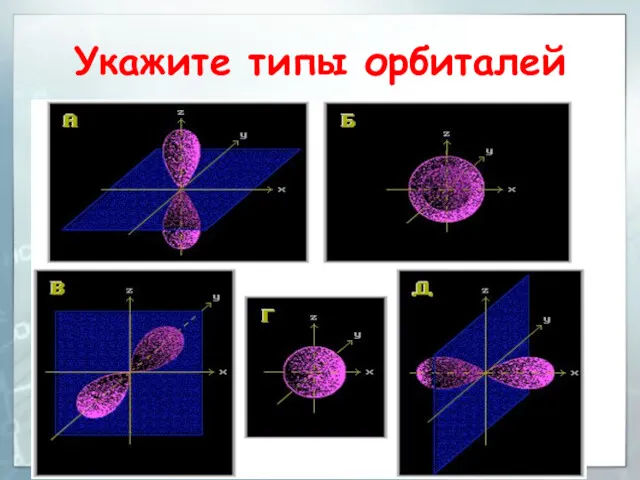
- 63. Укажите типы орбиталей
- 65. Скачать презентацию




















































 Материаловедение. Атомно-кристаллическое строение металлов и сплавов. (Тема 3)
Материаловедение. Атомно-кристаллическое строение металлов и сплавов. (Тема 3) Періодичний закон. Хімія. 8 клас
Періодичний закон. Хімія. 8 клас Комплексные соединения
Комплексные соединения Chemical Bonding I: Basic Concepts
Chemical Bonding I: Basic Concepts Записать формулы
Записать формулы Природные источники углеводородов
Природные источники углеводородов Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Фенол. Феноловая катастрофа
Фенол. Феноловая катастрофа Гидролиз солей
Гидролиз солей Склад і властивості основних класів неорганічних сполук
Склад і властивості основних класів неорганічних сполук Комплексні сполуки. Комплексоутворення в біологічних системах
Комплексні сполуки. Комплексоутворення в біологічних системах Композиционные материалы: углепластик, стеклопластик
Композиционные материалы: углепластик, стеклопластик Периодическая система элементов Д. И. Менделеева. IA группа
Периодическая система элементов Д. И. Менделеева. IA группа Уксусная кислота. Продуценты. Практическое использование
Уксусная кислота. Продуценты. Практическое использование Разработка технологии получения раствора коагулянта в условиях филиала Азот АО ОХК УРАЛХИМ
Разработка технологии получения раствора коагулянта в условиях филиала Азот АО ОХК УРАЛХИМ Синтетические моющие средства
Синтетические моющие средства Предпосылки открытия периодического закона
Предпосылки открытия периодического закона Термодинамика растворов неэлектролитов
Термодинамика растворов неэлектролитов Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Химическая природа косметического сырья. Простые и сложные вещества
Химическая природа косметического сырья. Простые и сложные вещества Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Нуклеиновые кислоты
Нуклеиновые кислоты КСЕ. Концепции химии. (Лекция 6)
КСЕ. Концепции химии. (Лекция 6) Классификация химических реакций
Классификация химических реакций Металлы. Распространённость металлов в земной коре
Металлы. Распространённость металлов в земной коре Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)