Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 6. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 8. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
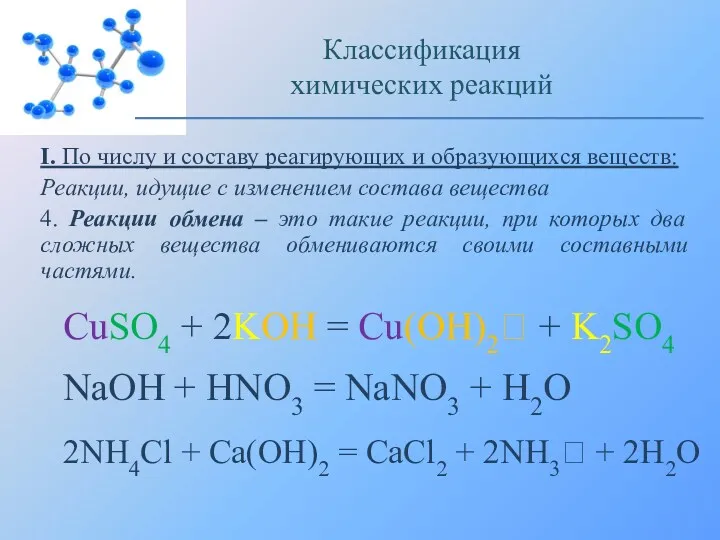
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 10. II. По изменению степеней окисления химических элементов: Окислительно-восстановительные реакции – реакции, в которых происходит перенос электронов,
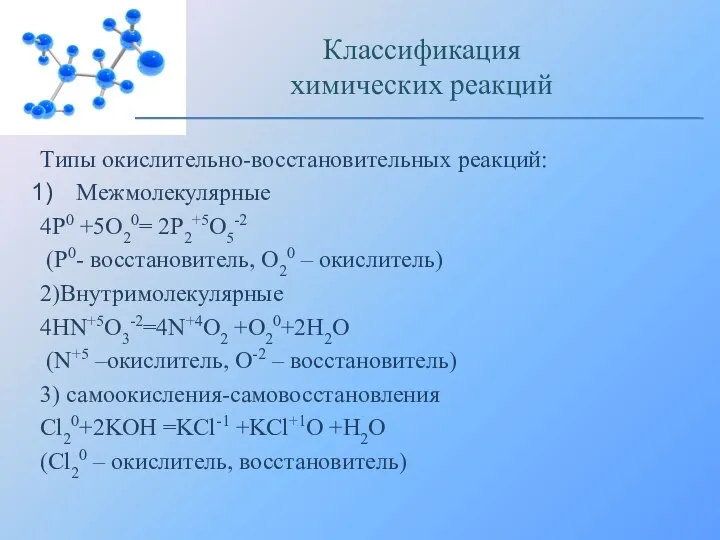
- 11. Типы окислительно-восстановительных реакций: Межмолекулярные 4Р0 +5О20= 2Р2+5О5-2 (Р0- восстановитель, О20 – окислитель) 2)Внутримолекулярные 4НN+5O3-2=4N+4O2 +O20+2H2O (N+5
- 12. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 13. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 14. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
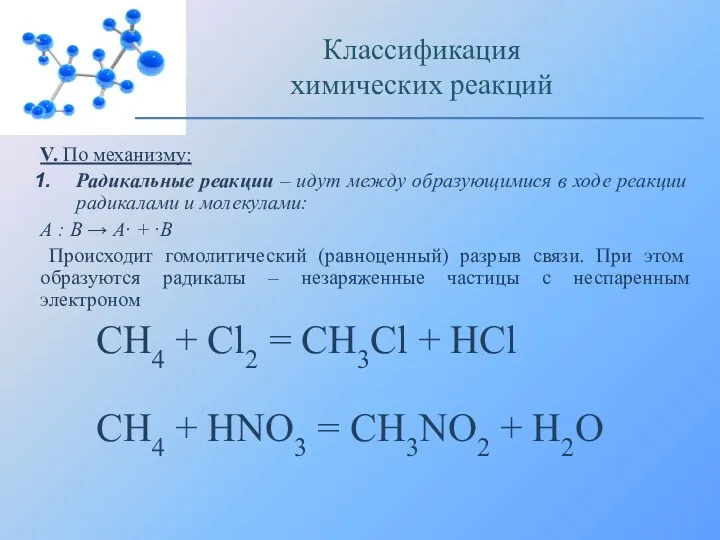
- 15. V. По механизму: Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами: А
- 16. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 17. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
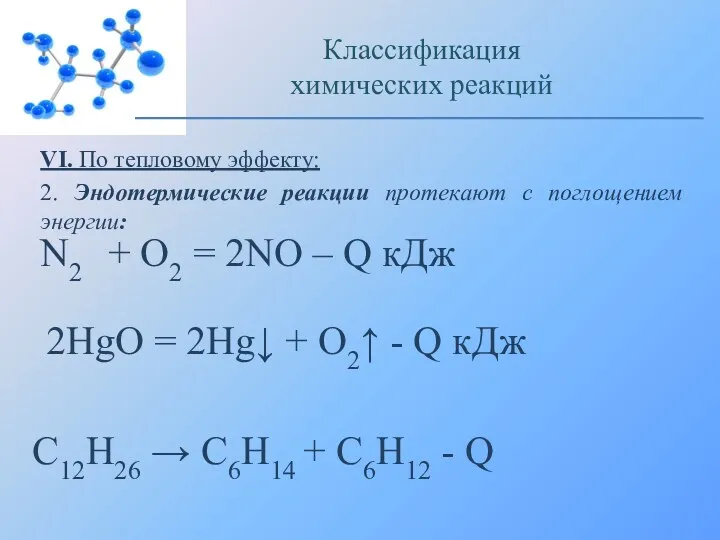
- 18. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 19. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. (синтез хлороводорода, взаимодействие метана с
- 20. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, протекающие на границе раздела фаз, реагирующие вещества
- 21. VIII. По фазовому составу: 2. Гомогенные реакции – реакции, в которых все исходные вещества находятся в
- 23. Скачать презентацию















 Галогены. Хлор
Галогены. Хлор Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Геохимические барьеры
Геохимические барьеры Периодическая таблица Д.И. Менделеева. Своя игра
Периодическая таблица Д.И. Менделеева. Своя игра Высокомолекулярные соединения
Высокомолекулярные соединения Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Основы органической химии. Углеводороды. Алкины
Основы органической химии. Углеводороды. Алкины Серная кислота и её свойства
Серная кислота и её свойства Кремний и его соединения
Кремний и его соединения Введение в коллоидную химию. Основные понятия и закономерности
Введение в коллоидную химию. Основные понятия и закономерности Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Валентность и степень окисления
Валентность и степень окисления Общая характеристика неметаллов
Общая характеристика неметаллов 20230419_kontsentratsiya
20230419_kontsentratsiya Физико-химические свойства белков. Электрофоретические и хроматографические методы
Физико-химические свойства белков. Электрофоретические и хроматографические методы Водородная связь (11 класс)
Водородная связь (11 класс) Химическое равновесие
Химическое равновесие Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты
Проект узла регенерации растворителя уксусной кислоты производства терефталевой кислоты Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Химический состав клетки. Неорганические вещества клетки
Химический состав клетки. Неорганические вещества клетки Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Емтихан сұрақтары
Емтихан сұрақтары Химическая промышленность и химическая технология
Химическая промышленность и химическая технология Обмен липидов
Обмен липидов Химический элемент цинк
Химический элемент цинк Анионактивті беттік активті заттар
Анионактивті беттік активті заттар