Содержание
- 2. Химический состав клетки
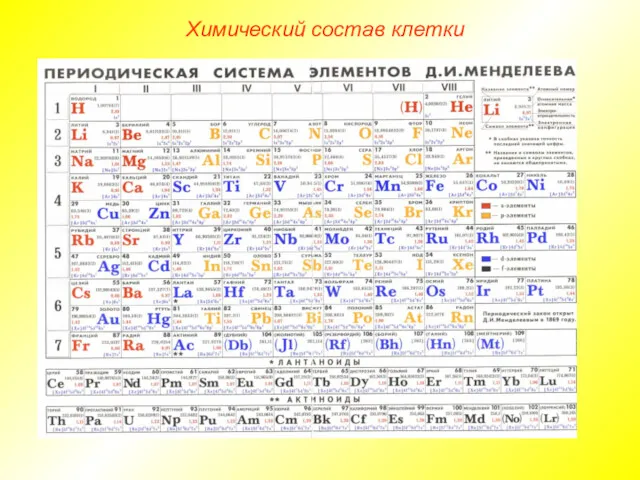
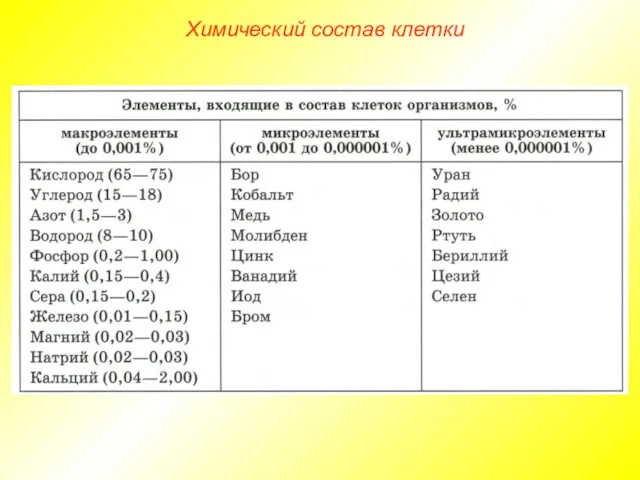
- 3. Химический состав клетки Все клетки, независимо от уровня организации, сходны по химическому составу. В живых организмах
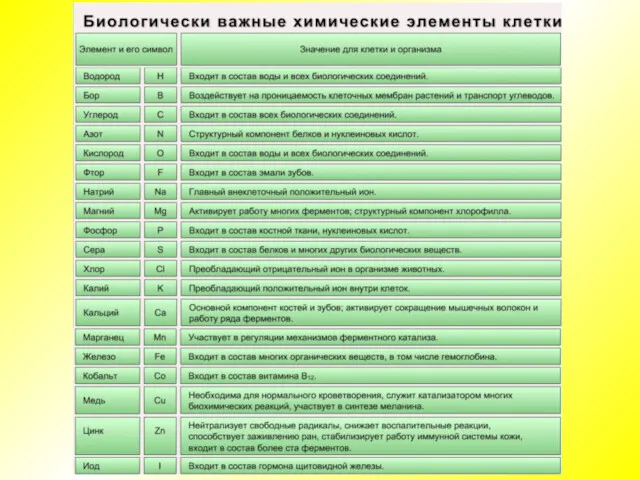
- 4. Химический состав клетки
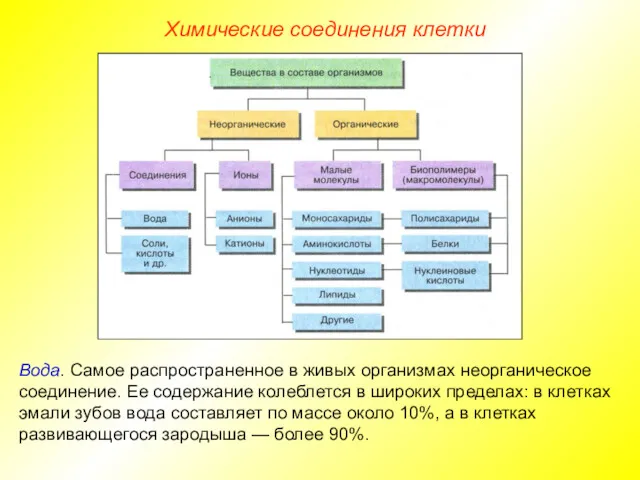
- 5. Химические соединения клетки Вода. Самое распространенное в живых организмах неорганическое соединение. Ее содержание колеблется в широких
- 6. Химические соединения клетки Вода. Самое распространенное в живых организмах неорганическое соединение. Ее содержание колеблется в широких
- 7. Химические соединения клетки Вода не только обязательный компонент живых клеток, но и среда обитания организмов. Биологическое
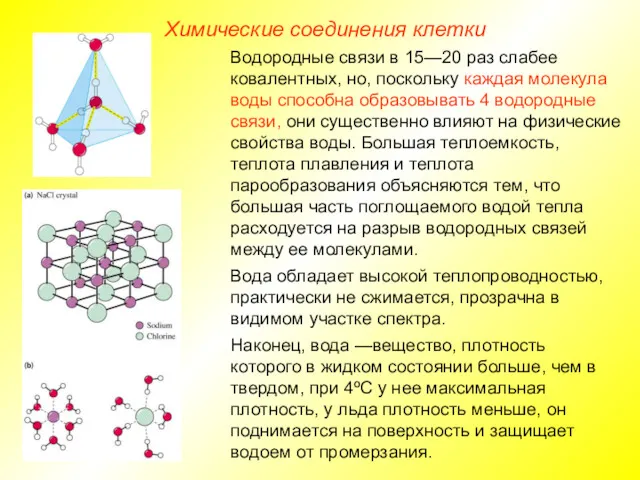
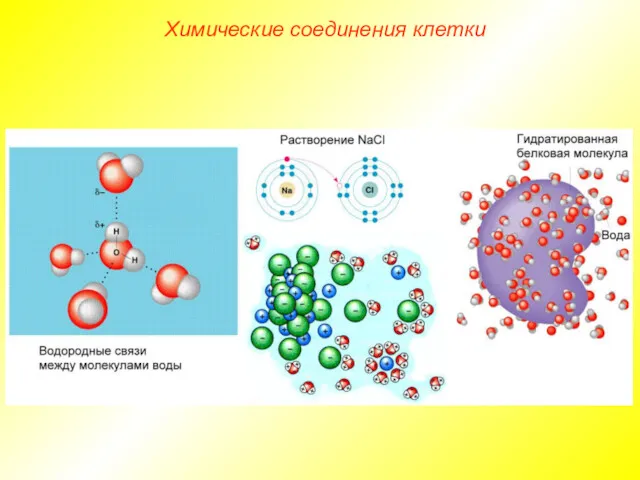
- 8. Химические соединения клетки Водородные связи в 15—20 раз слабее ковалентных, но, поскольку каждая молекула воды способна
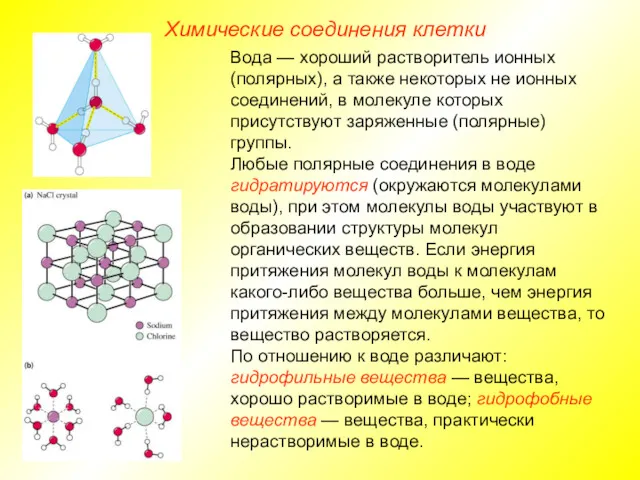
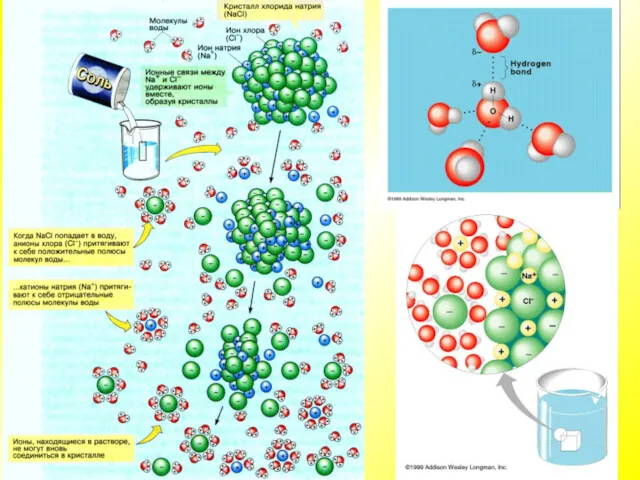
- 9. Химические соединения клетки Вода — хороший растворитель ионных (полярных), а также некоторых не ионных соединений, в
- 10. Химические соединения клетки
- 12. Химические соединения клетки Большинство биохимических реакций может идти только в водном растворе; многие вещества поступают в
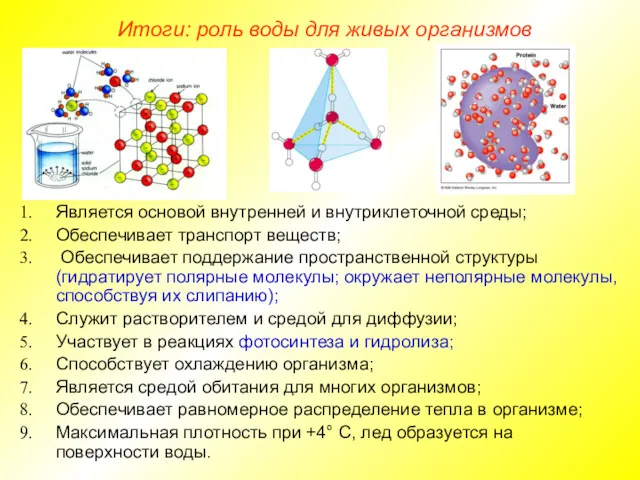
- 13. Является основой внутренней и внутриклеточной среды; Обеспечивает транспорт веществ; Обеспечивает поддержание пространственной структуры (гидратирует полярные молекулы;
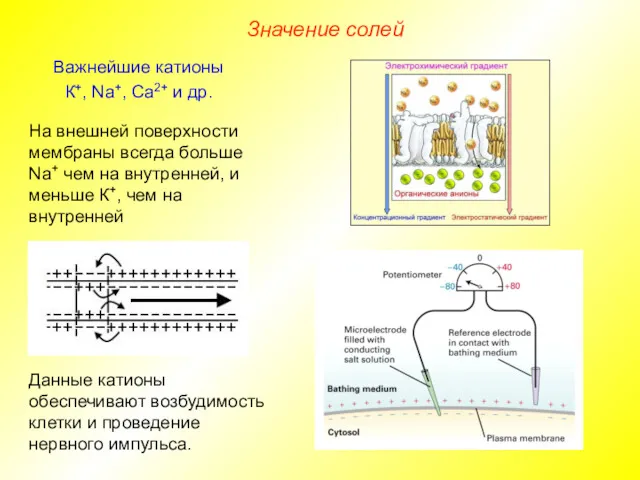
- 15. Значение солей Важнейшие катионы К+, Na+, Ca2+ и др. Данные катионы обеспечивают возбудимость клетки и проведение
- 17. Скачать презентацию




 Щелочные металлы
Щелочные металлы Аллотропные модификации углерода. Алмазы
Аллотропные модификации углерода. Алмазы Закон сохранения массы веществ. Уравнения химических реакций
Закон сохранения массы веществ. Уравнения химических реакций Различные теории кислот и оснований
Различные теории кислот и оснований Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы
Қышқылды-сілтілі тепетеңдік бұзылысының клиникалық биохимиясы Параметры токсичности продуктов горения материала. (Задача 3)
Параметры токсичности продуктов горения материала. (Задача 3) Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Натуральный каучук
Натуральный каучук Валентность химического элемента. Определение валентности по химической формуле
Валентность химического элемента. Определение валентности по химической формуле Rate of reactions. (Chapter 2)
Rate of reactions. (Chapter 2)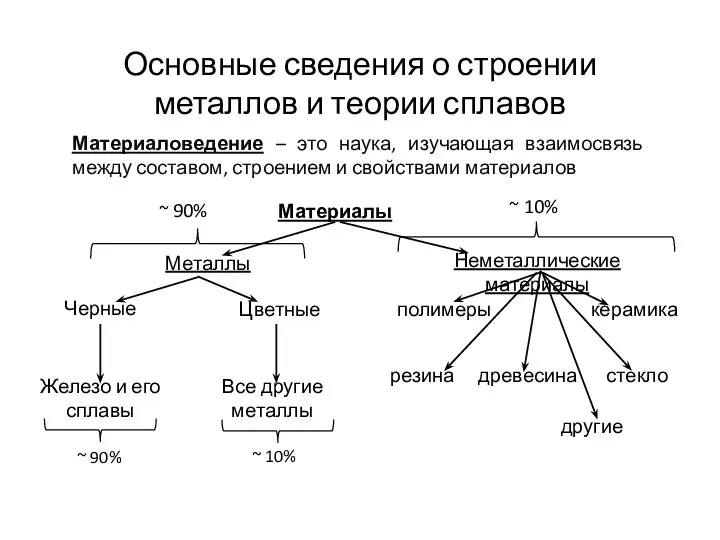 Основные сведения о строении металлов и теории сплавов
Основные сведения о строении металлов и теории сплавов Строение атома. Периодический закон и периодическая система элементов
Строение атома. Периодический закон и периодическая система элементов Магматизм. (Лекция 6)
Магматизм. (Лекция 6) Типы химических реакций
Типы химических реакций Углерод и его соединения
Углерод и его соединения Растворы. Лекция №5
Растворы. Лекция №5 Висмут, ртуть, сурьма
Висмут, ртуть, сурьма Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Si - Silicon. Distribute Properties
Si - Silicon. Distribute Properties Непредельные углеводороды
Непредельные углеводороды Калийные удобрения
Калийные удобрения Химия нефти и газа. Переработка нефти
Химия нефти и газа. Переработка нефти Electrolysis
Electrolysis Минералогия. Формы нахождения минералов в природе. Свойства минералов
Минералогия. Формы нахождения минералов в природе. Свойства минералов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Получение и применение радиоактивных изотопов
Получение и применение радиоактивных изотопов Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13) Твёрдое агрегатное состояние. Кристалические решетки. Урок 4
Твёрдое агрегатное состояние. Кристалические решетки. Урок 4