Содержание
- 2. Цель урока: У всех прошу я разрешенья -урок начать. Отбросив все свои сомненья, Вы помогите мне,
- 3. Реакция 1: «Горение магния» А вот и магний - «светский лев»: Придворных дам сердец разбил немало.
- 4. Уравнение реакции 2Mg + O2 = 2MgO – р. соединения
- 5. Реакция 2: «Взаимодействие натрия с водой» Ах, натрий! Как с водой он смел! В порыве вальса
- 6. Уравнение реакции 2Na + 2H2O = 2NaOH +H2 – р. замещения
- 7. Реакция 3: «Взаимодействие раствора хлорида калия с раствором нитрата серебра» Вот в полонезе калия хлорид С
- 8. Уравнение реакции КСl + AgNO3 = KNO3 + AgCl – р. обмена
- 9. Реакция 4: «Разложение бихромата аммония» Вот бихромат: оранж, красив. Однако, он весьма ревнив. И стоит лишь
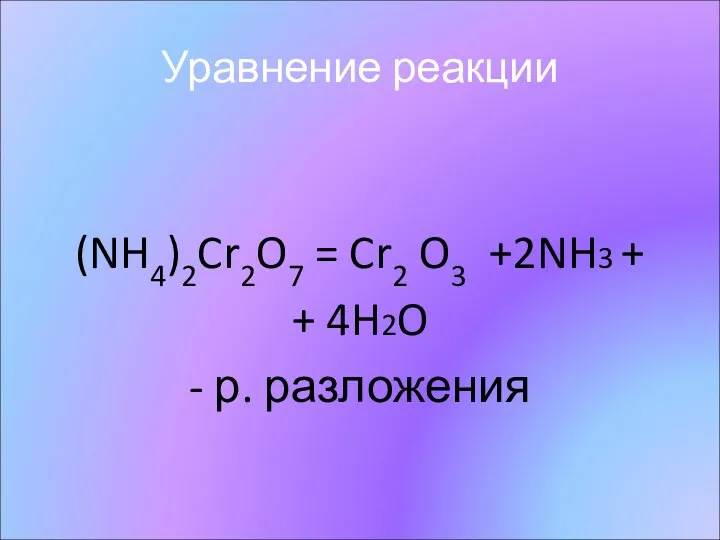
- 10. Уравнение реакции (NH4)2Cr2O7 = Cr2 O3 +2NH3 + + 4H2O - р. разложения
- 11. Явился красный лев – и был он женихом, И в тёплой жидкости они его венчали С
- 12. гемоглобин + СО = карбоксигемоглобин - р. соединения H2O2 = H2O + O2 - (ФЕРМЕНТ СЛЮНЫ
- 13. На месте известковых отложений часто образуются огромные полости в земной коре – карстовые пещеры. CaCO3 +CO2
- 14. Растворение веществ в воде - физико – химический процесс. При повышенной температуре сахароза + вода =
- 15. В июне 1794 г. для наблюдения за передвижением армии интервентов во время боя при Флёрюсе (Франция)
- 16. КАРТОЧКА № 1 ТИПЫ РЕАКЦИЙ: ПРОДУКТЫ: 1) реакция разложения а) более сложное вещество 2) реакция соединения
- 17. Код ответа: 1) б; г; 2) а; 3) д; 4) е.
- 18. Физкультминутка
- 19. Карточка №2 Лови ошибку 1. C+ O2 = CO2 Реакция замещения 2. NaOH + HCl =
- 20. Реакция замещения 11 21 2 31 2 3 4 Реакция соединения 11 21 2 31 2
- 21. Неправильно Реакция замещения 11 21 2 31 2 3 4 Реакция соединения 11 21 2 31
- 22. Правильно Реакция замещения 11 21 2 31 2 3 4 Реакция соединения 11 21 2 31
- 23. Выполнение тестов.
- 24. ОТВЕТЫ
- 25. Итог урока. Оценки.
- 26. Рефлексия.
- 28. Скачать презентацию
























 Технология получения многослойного и малослойного графена
Технология получения многослойного и малослойного графена Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості 20230816_belki_2
20230816_belki_2 Халькогены
Халькогены Растворы. (Лекция 7)
Растворы. (Лекция 7) Химические элементы азот и фосфор
Химические элементы азот и фосфор Альдегиды и кетоны
Альдегиды и кетоны Буферное кислотно - основное взаимодействие
Буферное кислотно - основное взаимодействие Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества
Наглядное пособие Динамические модели. Кристаллы. Немолекулярные вещества. Простые вещества Химическая связь
Химическая связь Биологически активные вещества и их содержание в лекарственных растениях
Биологически активные вещества и их содержание в лекарственных растениях Основания. Степени окисления элементов в соединениях
Основания. Степени окисления элементов в соединениях Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Диффузия вокруг нас
Диффузия вокруг нас Франций (Francium)
Франций (Francium) Термодинамика химических процессов
Термодинамика химических процессов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Качественные реакции
Качественные реакции Минералы горных пород
Минералы горных пород Химический элемент радон
Химический элемент радон Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Мило та миловаріння
Мило та миловаріння Кислотність та основність органічних сполук
Кислотність та основність органічних сполук Проведение лабораторных анализов образцов почвы
Проведение лабораторных анализов образцов почвы Подгруппа углерода
Подгруппа углерода Химический элемент алюминий
Химический элемент алюминий Пластические массы и изделия на их основе
Пластические массы и изделия на их основе Зависимость биохимических изменений в мясе от условий хранения
Зависимость биохимических изменений в мясе от условий хранения