Содержание
- 2. Домашнее задание: Конспект презентации (с 17 по 25 слайд включительно), выучить теорию, письменно в тетради выполнить
- 3. Определите степени окисления элементов в соединениях и дайте названия веществам N2O, NO2, N2O5, SO3, SO2, Fe2O3,
- 4. ОСНОВАНИЯ – это сложные вещества, в состав которых входят атомы металлов, связанных с одной или несколькими
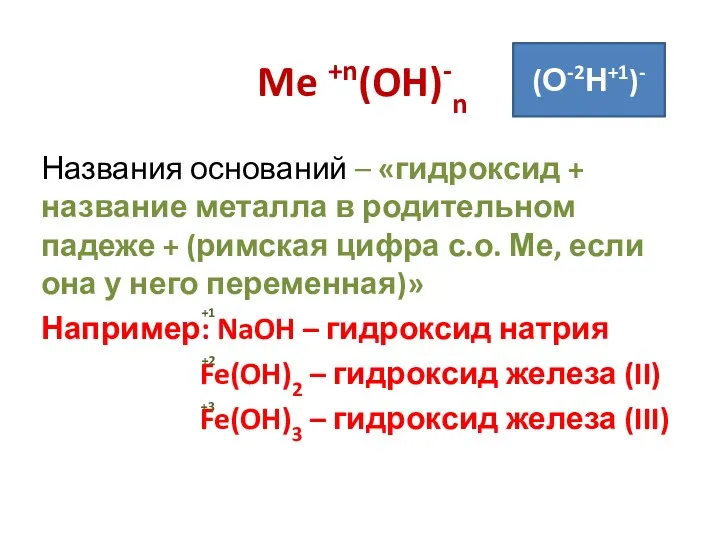
- 5. Me +n(OH)-n Названия оснований – «гидроксид + название металла в родительном падеже + (римская цифра с.о.
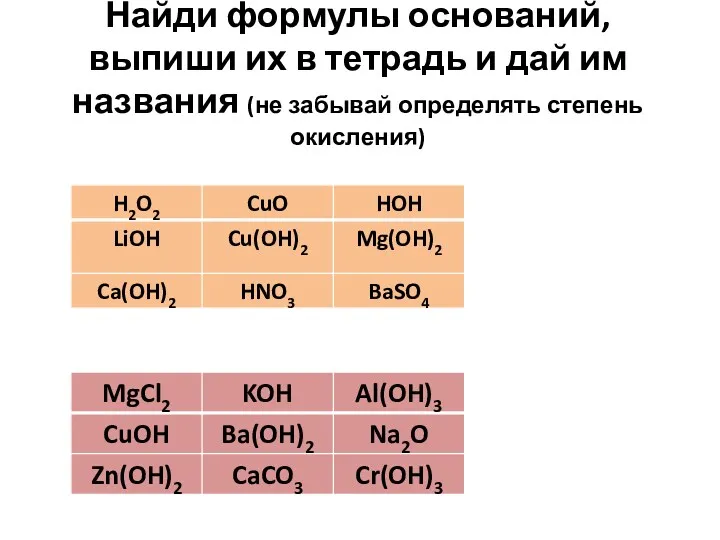
- 6. Найди формулы оснований, выпиши их в тетрадь и дай им названия (не забывай определять степень окисления)
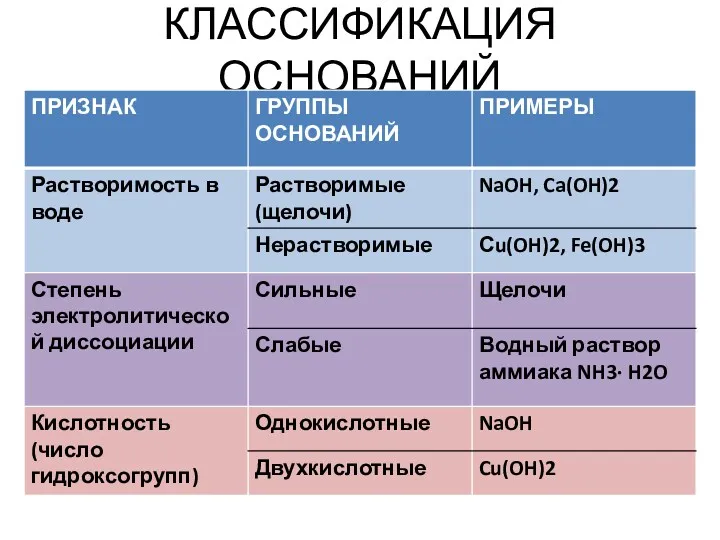
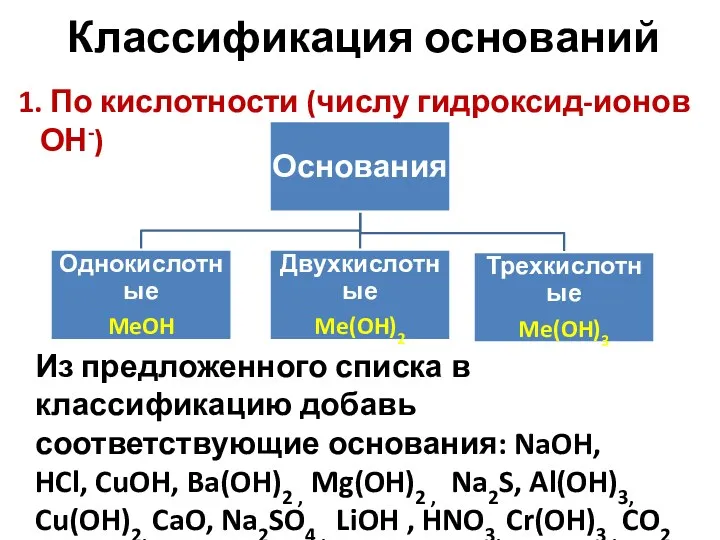
- 7. КЛАССИФИКАЦИЯ ОСНОВАНИЙ
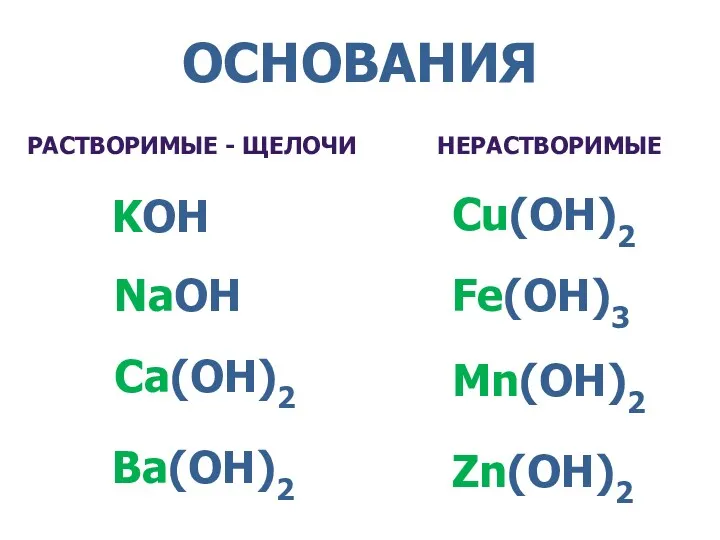
- 8. ОСНОВАНИЯ РАСТВОРИМЫЕ - ЩЕЛОЧИ НЕРАСТВОРИМЫЕ KOH NaOH Ca(OH)2 Ba(OH)2 Cu(OH)2 Fe(OH)3 Mn(OH)2 Zn(OH)2
- 9. Классификация оснований 1. По кислотности (числу гидроксид-ионов ОН-) Из предложенного списка в классификацию добавь соответствующие основания:
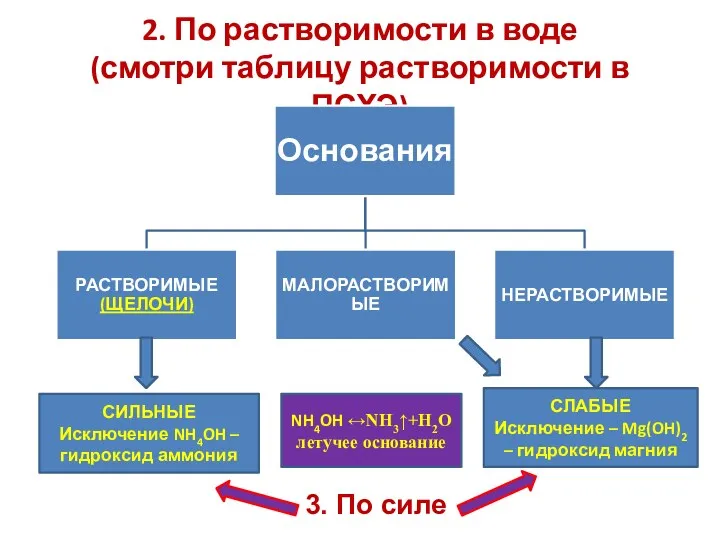
- 10. 2. По растворимости в воде (смотри таблицу растворимости в ПСХЭ) СЛАБЫЕ Исключение – Mg(OH)2 – гидроксид
- 11. Таблица растворимости кислот, солей и оснований !!! таблицу переписывать не нужно, она есть на форзаце в
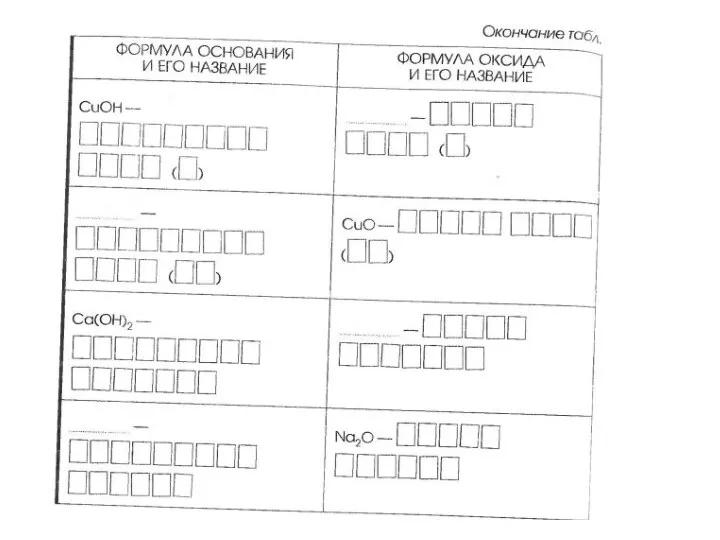
- 15. Составить формулы оксидов, соответствующих гидроксидам Гидроксид калия – К+1ОН – оксид калия К+12О Гидроксид натрия -
- 16. Техника безопасности при работе с NaOH и KOH При контакте слизистых поверхностей с едкой щёлочью необходимо
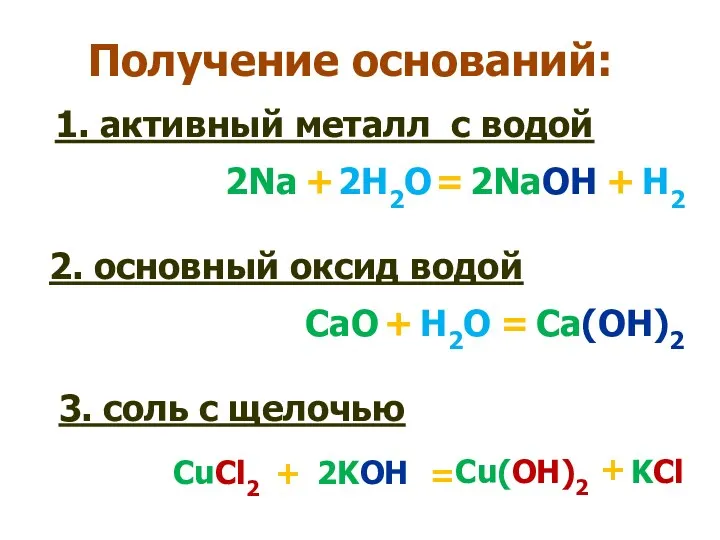
- 17. Получение оснований: 1. активный металл с водой 2Na + 2H2O = 2NaOH + H2 2. основный
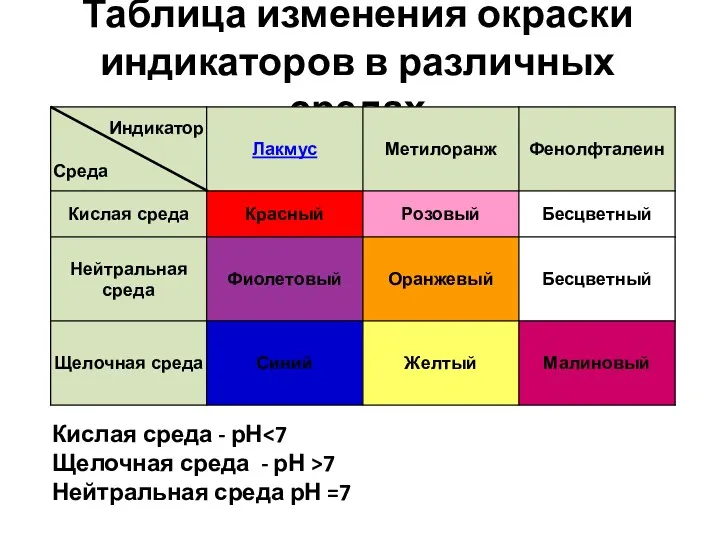
- 18. Химические свойства щелочей: Взаимодействие с индикаторами.
- 19. ЛАКМУС МЕТИЛОВЫЙ ФЕНОЛФТА- ОРАНЖЕВЫЙ ЛЕИН ОКРАСКА ИНДИКАТОРОВ В ЩЕЛОЧНОЙ СРЕДЕ
- 20. Качественные реакции Реакции, с помощью которых распознают определенные вещества Индикаторы (от лат. «указатели»)- вещества, изменяющие свою
- 21. Таблица изменения окраски индикаторов в различных средах Кислая среда - рН Щелочная среда - рН >7
- 22. Химические свойства щелочей: 2. Взаимодействие с кислотами – реакция нейтрализации, так как образуется соль и вода.
- 23. 3. Взаимодействие с кислотными оксидами. 2NaOH + СО2 = Na2CО3 + H2O
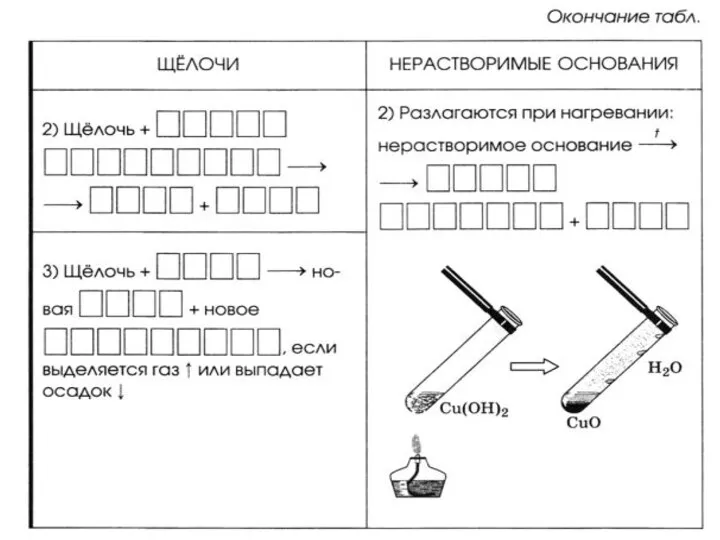
- 24. 4. Щелочь + соль= новое основание и новая соль Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
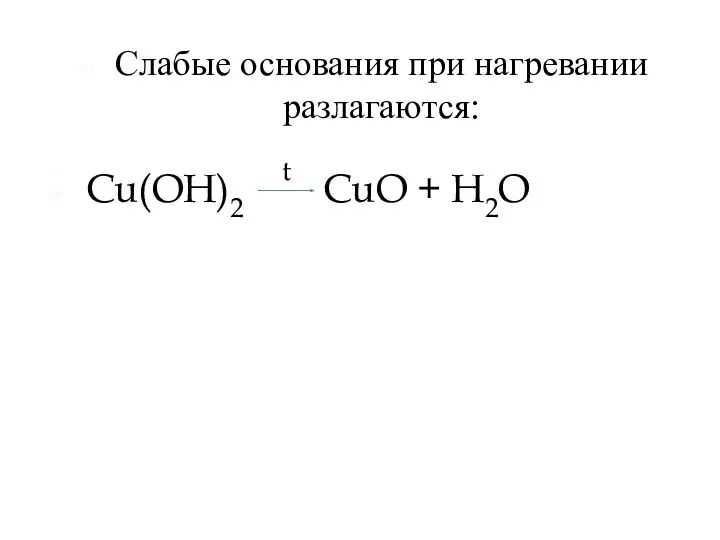
- 25. Слабые основания при нагревании разлагаются: t Cu(OH)2 CuO + H2O
- 31. Скачать презентацию
















 Химические вещества и материалы в индустрии красоты. Номенклатура и классификация органических соединений
Химические вещества и материалы в индустрии красоты. Номенклатура и классификация органических соединений Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции
Тепловой эффект химической реакции, термохимические уравнения, экзо- и эндотермические реакции Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Sm-Nd метод
Sm-Nd метод Кислород. Общая характеристика, получение и свойства
Кислород. Общая характеристика, получение и свойства Химическая связь
Химическая связь Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Применение родия (Rh)
Применение родия (Rh) Дисперсные системы
Дисперсные системы Хром. Физические и химические свойства
Хром. Физические и химические свойства Термическая и химико-термическая обработка
Термическая и химико-термическая обработка Непредельные углеводороды ряда этилена. Олефины
Непредельные углеводороды ряда этилена. Олефины Влияние газированных напитков на организм человека
Влияние газированных напитков на организм человека Твердость минералов и их применение
Твердость минералов и их применение История хроматографии. Виды хроматографических методов
История хроматографии. Виды хроматографических методов Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Суспензии: получение, свойства
Суспензии: получение, свойства Ізомерія. Структурна ізомерія
Ізомерія. Структурна ізомерія Альдегиды и кетоны. 10 класс
Альдегиды и кетоны. 10 класс Оксиды неметаллов и кислородсодержащие кислоты. 11 класс
Оксиды неметаллов и кислородсодержащие кислоты. 11 класс Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов
Химия и пища. Маркировка, упаковка пищевых и гигиенических продуктов Основы химической кинетики
Основы химической кинетики Тұздар. Құрамы және химиялық қасиеттері
Тұздар. Құрамы және химиялық қасиеттері Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины
Загрязнители пищи тяжелые металлы, радиоктивные элементы, ПАУ, пестициды, и нитрозамины Изомерия. Типы изомерии
Изомерия. Типы изомерии Непредельные углеводороды. Алкены
Непредельные углеводороды. Алкены Предмет органической химии
Предмет органической химии