Слайд 2

Закон сохранения энергии
Энергия не возникает из ничего и не исчезает бесследно,
а только переходит из одной формы в другую.
Слайд 3
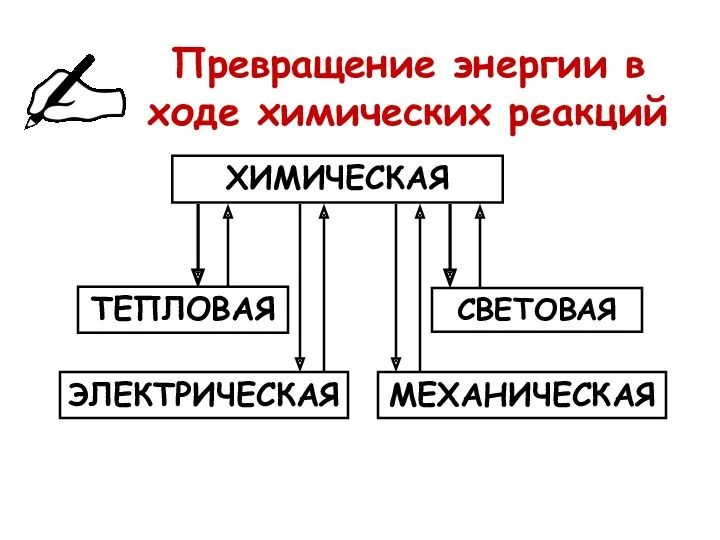
Превращение энергии в ходе химических реакций
ХИМИЧЕСКАЯ
ЭЛЕКТРИЧЕСКАЯ
СВЕТОВАЯ
ТЕПЛОВАЯ
МЕХАНИЧЕСКАЯ
Слайд 4
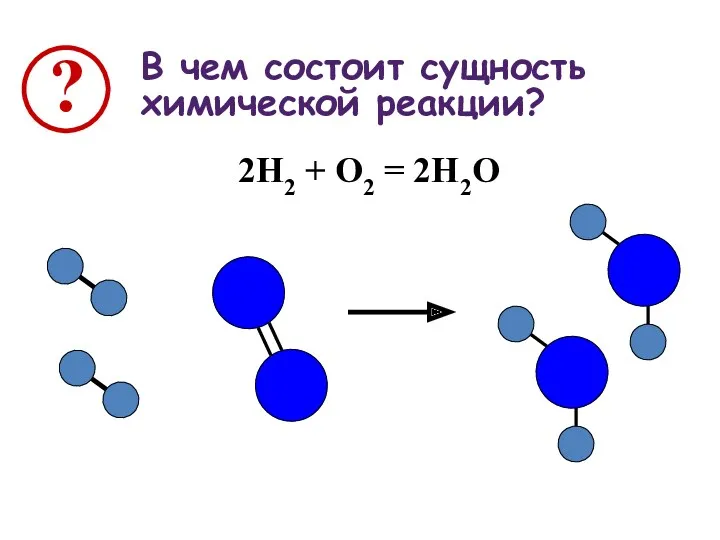
В чем состоит сущность химической реакции?
2Н2 + О2 = 2Н2О
Слайд 5
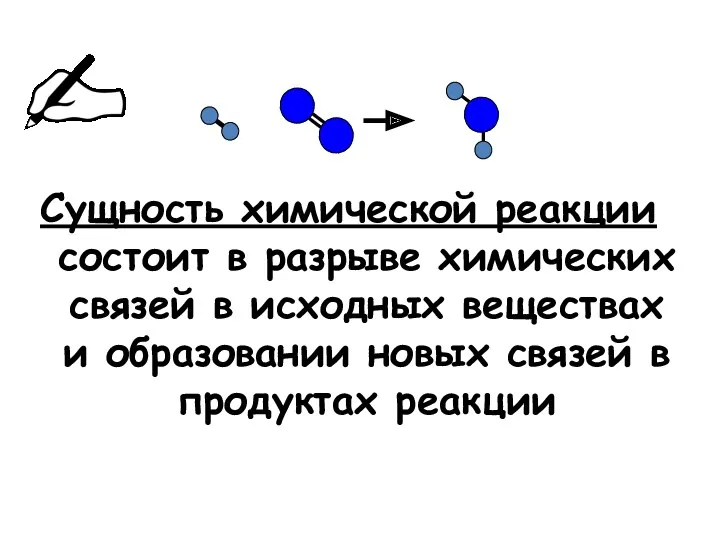
Сущность химической реакции
состоит в разрыве химических связей в исходных веществах и
образовании новых связей в продуктах реакции
Слайд 6

Связаны ли процессы разрыва и образования химических связей
с процессами изменения энергии?
Слайд 7
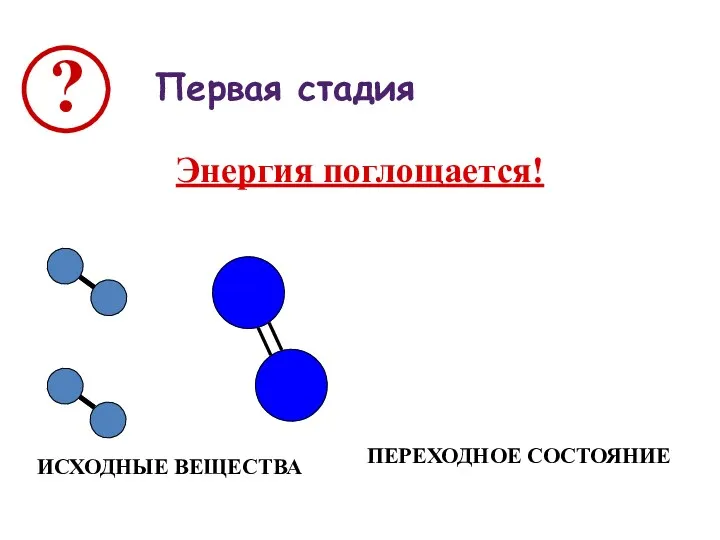
Первая стадия
Энергия поглощается!
ИСХОДНЫЕ ВЕЩЕСТВА
ПЕРЕХОДНОЕ СОСТОЯНИЕ
Слайд 8
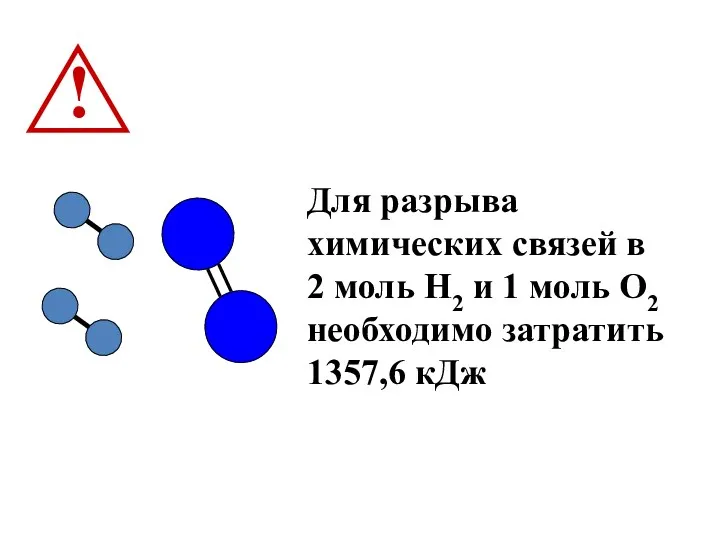
Для разрыва химических связей в 2 моль Н2 и 1 моль
О2 необходимо затратить 1357,6 кДж
Слайд 9
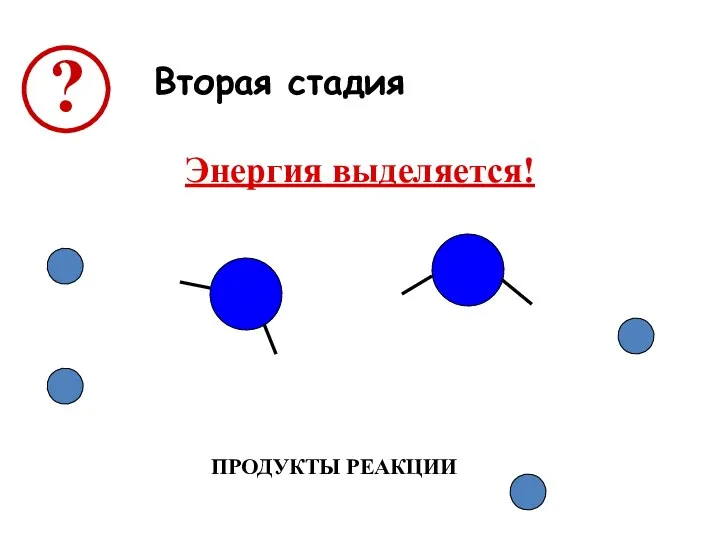
Вторая стадия
ПРОДУКТЫ РЕАКЦИИ
Энергия выделяется!
Слайд 10
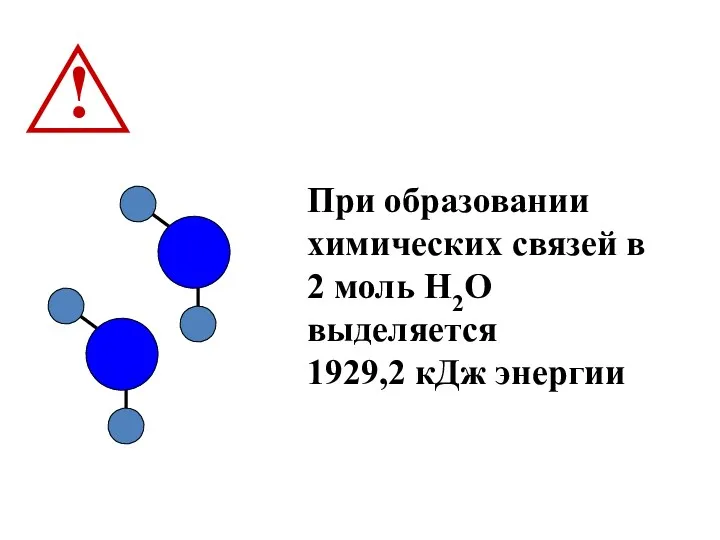
При образовании химических связей в 2 моль Н2О выделяется
1929,2 кДж
энергии
Слайд 11

Любая химическая реакция заключается в разрыве одних химических связей и образовании
других!
Слайд 12
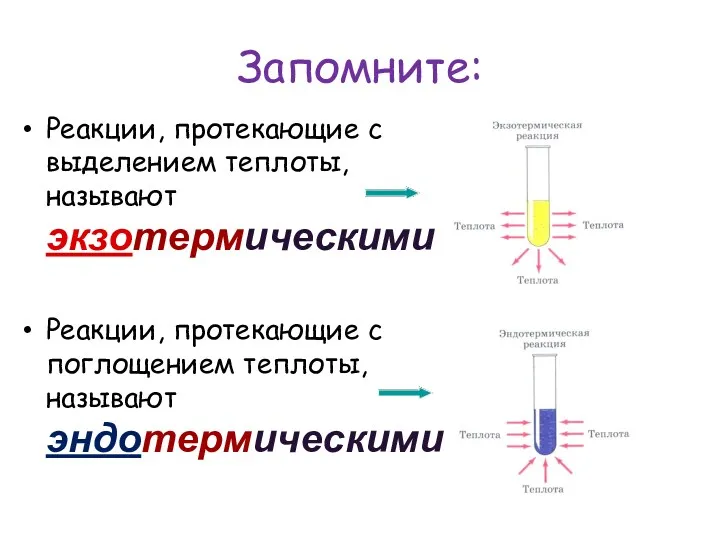
Запомните:
Реакции, протекающие с выделением теплоты, называют экзотермическими
Реакции, протекающие с поглощением теплоты,
называют эндотермическими
Слайд 13
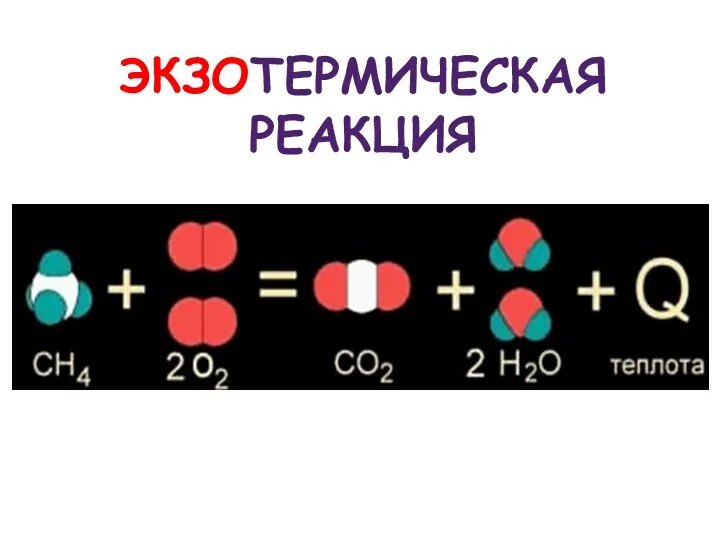
Слайд 14
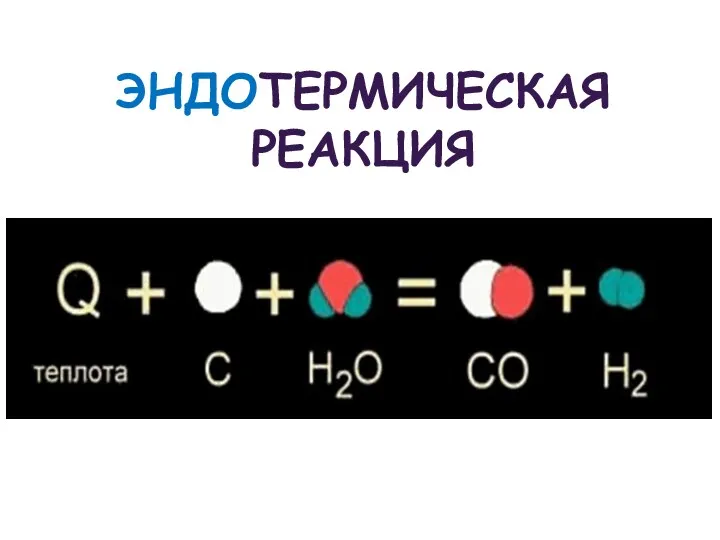
Слайд 15

Любая химическая реакция сопровождается выделением или поглощением ЭНЕРГИИ!
Слайд 16

Все реакции сопровождаются тепловыми эффектами.
,
Слайд 17

Тепловой эффект химической реакции
Q- это количество теплоты, которое выделяется или поглощается
при химических реакциях
Дж; кДж
Слайд 18

С(тв.) + О2(г.) ?СО2(г.) + 402,24кДж
2HgO(тв.)?2Hg(ж.)+O2(г.) - 180 кДж
Слайд 19

Химические уравнения, в которых указывается тепловой эффект, называются ТЕРМОХИМИЧЕСКИМИ


















 Различные теории кислот и оснований
Различные теории кислот и оснований Электролитическая диссоциация. Положительно-заряженный электрод
Электролитическая диссоциация. Положительно-заряженный электрод Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Энергетика химических процессов. Термодинамика. (Лекция 4)
Энергетика химических процессов. Термодинамика. (Лекция 4) Тренувальні вправи. Задачі
Тренувальні вправи. Задачі Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью
Циклоалканы. Предельные углеводороды с замкнутой (циклической) углеродной цепью Карбоновые кислоты
Карбоновые кислоты Метали IV групи побічної підгрупи (Ti, Zr, Hf)
Метали IV групи побічної підгрупи (Ti, Zr, Hf) Типы химических реакций
Типы химических реакций Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева
Общая характеристика металлов главных подгрупп I-III групп ПСХЭ Д.И. Менделеева Химические и физические свойства воды
Химические и физические свойства воды Каучук туралы жалпы мәліметтер
Каучук туралы жалпы мәліметтер Чисті речовини та суміші. Основні способи розділення сумішей (7 клас)
Чисті речовини та суміші. Основні способи розділення сумішей (7 клас) Химический элемент алюминий
Химический элемент алюминий Спирты
Спирты Типы химических реакций
Типы химических реакций Электролиты и неэлектролиты. Механизм электролитической диссоциации
Электролиты и неэлектролиты. Механизм электролитической диссоциации Теория электролитической диссоциации
Теория электролитической диссоциации Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Механизмы органических реакций
Механизмы органических реакций Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии
Мицеллярные растворы ПАВ. Солюбилизация. Микроэмульсии The translation and transcription
The translation and transcription Основи. Фізичні властивості основ
Основи. Фізичні властивості основ Готовимся к экзамену по химии. 9 класс
Готовимся к экзамену по химии. 9 класс Ионоселективные электроды
Ионоселективные электроды Виртуозы химического эксперимента
Виртуозы химического эксперимента Химический состав воздуха
Химический состав воздуха Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства