Содержание
- 2. Зачем знать механизм? 5
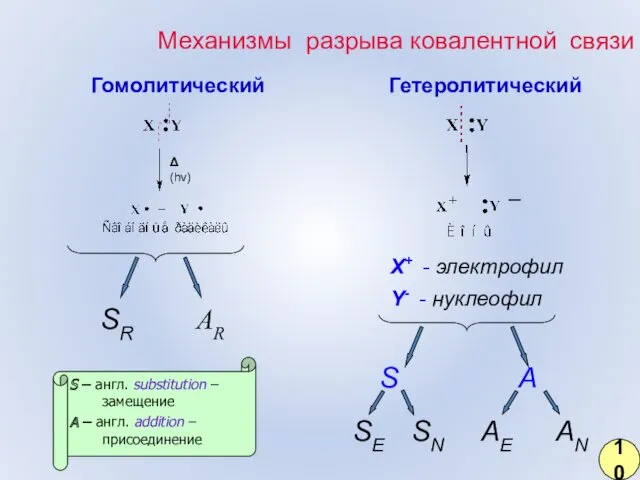
- 3. Механизмы разрыва ковалентной связи Гомолитический Гетеролитический Δ (hν) SR AR AE AN SE SN S A
- 4. Радикальное замещение SR 11
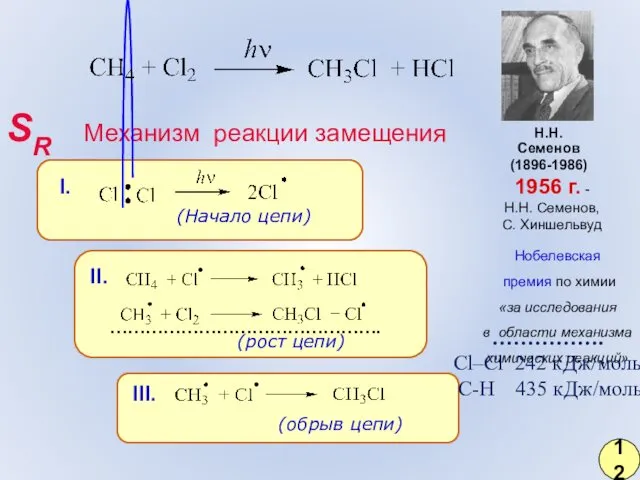
- 5. SR Механизм реакции замещения Н.Н. Семенов (1896-1986) 1956 г. - Н.Н. Семенов, С. Хиншельвуд Нобелевская премия
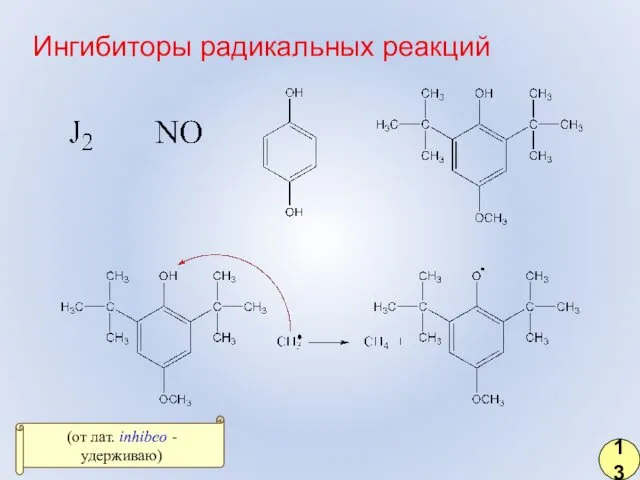
- 6. Ингибиторы радикальных реакций 13 (от лат. inhibeo - удерживаю)
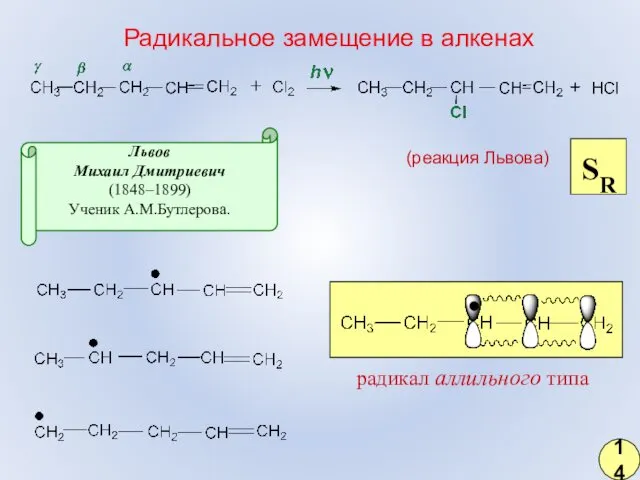
- 7. радикал аллильного типа SR (реакция Львова) Радикальное замещение в алкенах Львов Михаил Дмитриевич (1848–1899) Ученик А.М.Бутлерова.
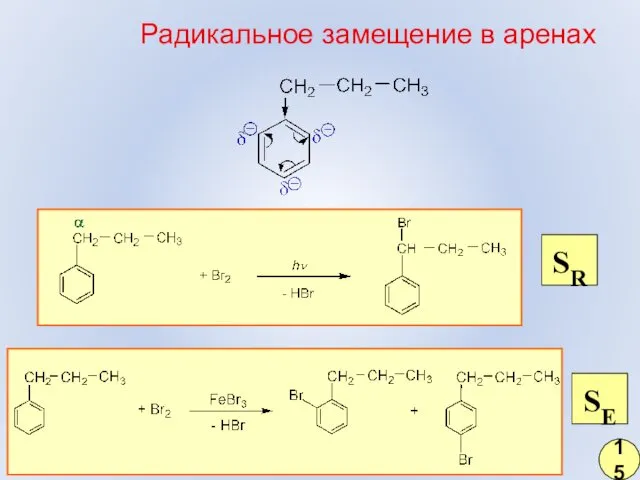
- 8. SE Радикальное замещение в аренах 15 SR
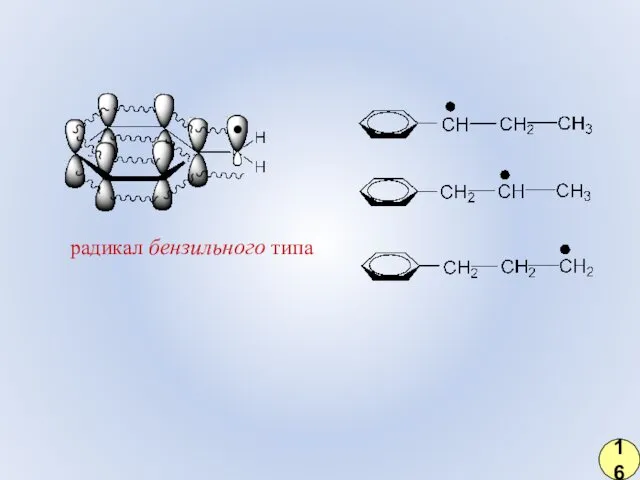
- 9. радикал бензильного типа 16
- 10. Электрофильное присоединение (AE)
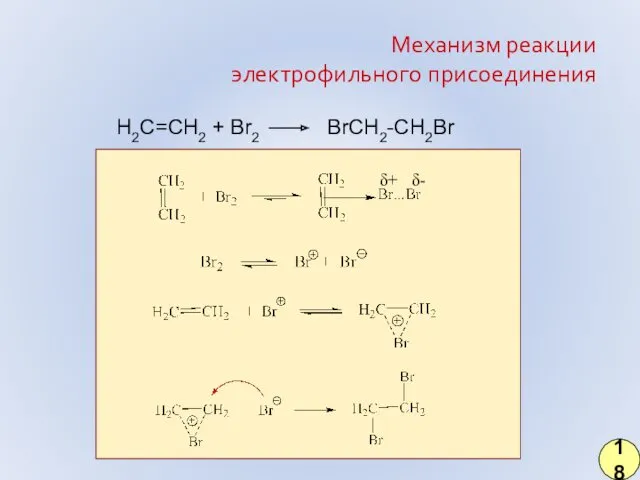
- 11. Механизм реакции электрофильного присоединения H2C=CH2 + Br2 BrCH2-CH2Br 18 δ+ δ-
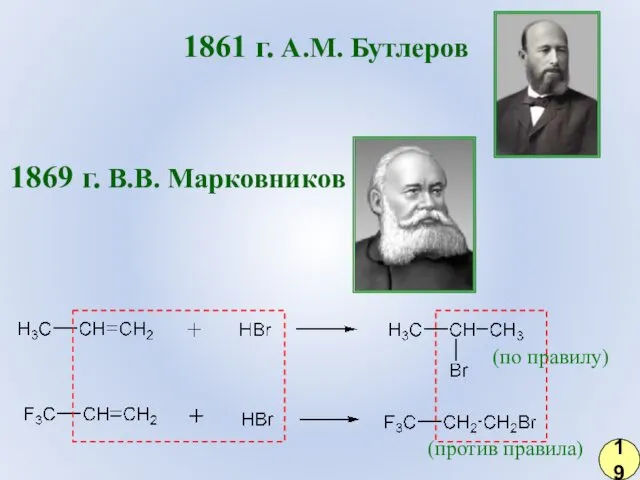
- 12. 1861 г. А.М. Бутлеров 1869 г. В.В. Марковников (по правилу) (против правила) 19
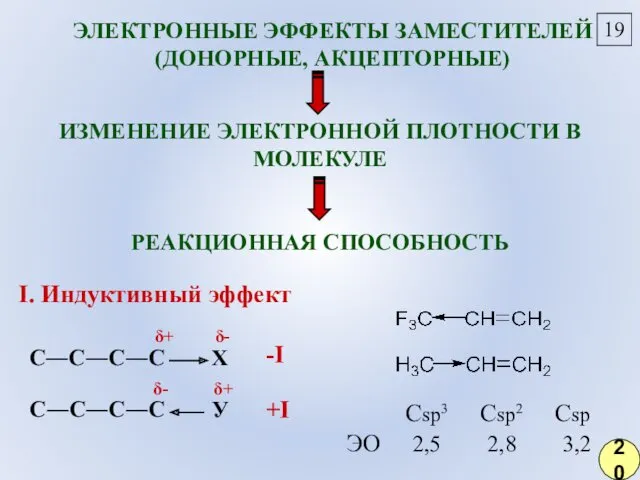
- 13. 19 ИЗМЕНЕНИЕ ЭЛЕКТРОННОЙ ПЛОТНОСТИ В МОЛЕКУЛЕ РЕАКЦИОННАЯ СПОСОБНОСТЬ Сsp3 Csp2 Csp ЭО 2,5 2,8 3,2 δ+
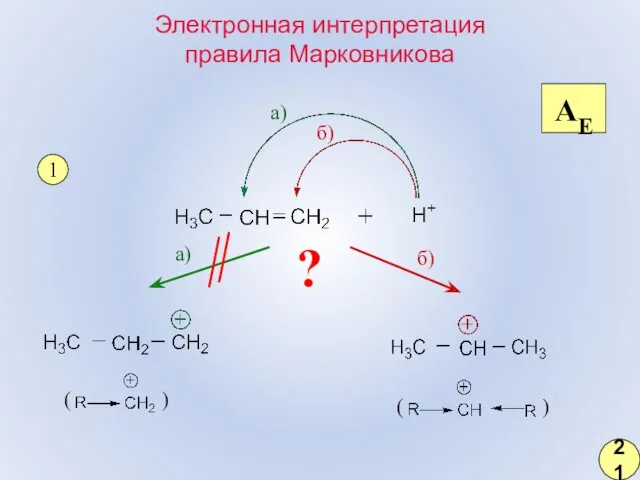
- 14. 1 а) б) а) б) AE ? Электронная интерпретация правила Марковникова 21
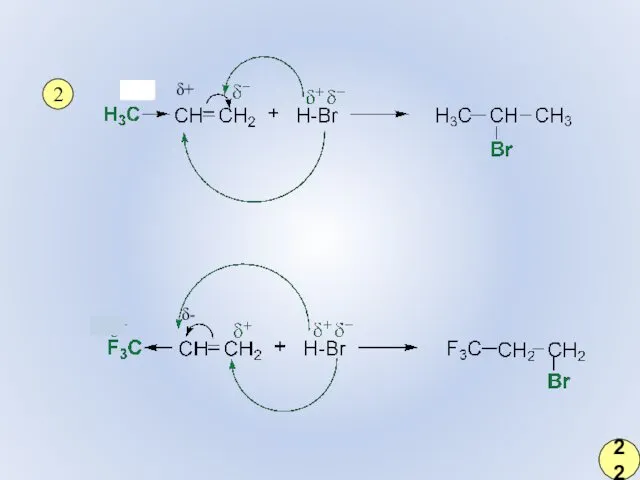
- 15. 2 δ+ δ- 22
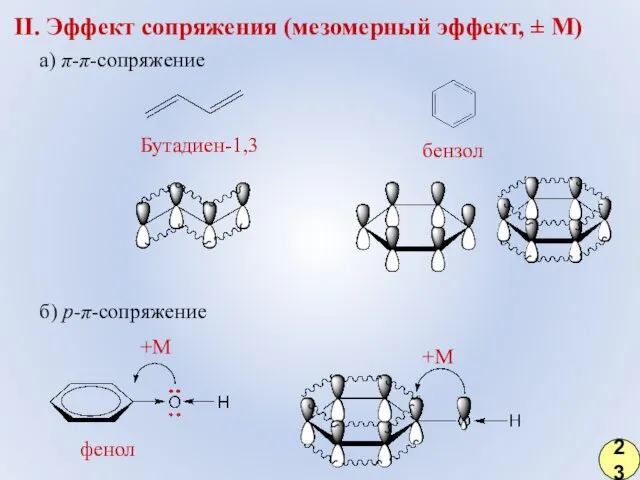
- 16. II. Эффект сопряжения (мезомерный эффект, ± М) а) π-π-сопряжение б) р-π-сопряжение Бутадиен-1,3 бензол +М +М фенол
- 17. Электрофильное замещение SE
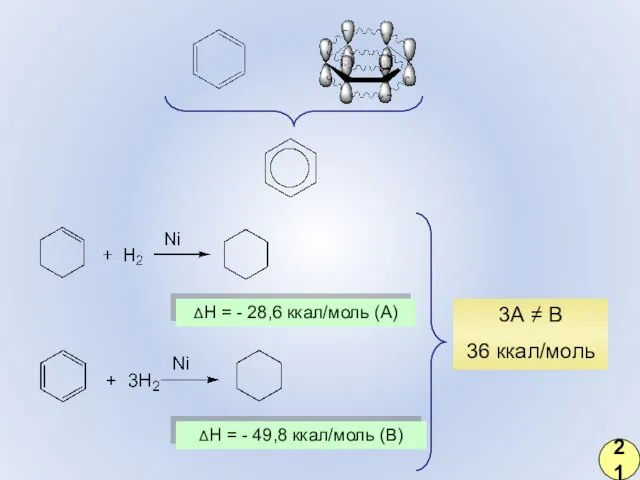
- 18. ΔH = - 28,6 ккал/моль (А) ΔH = - 49,8 ккал/моль (В) 3А ≠ В 36
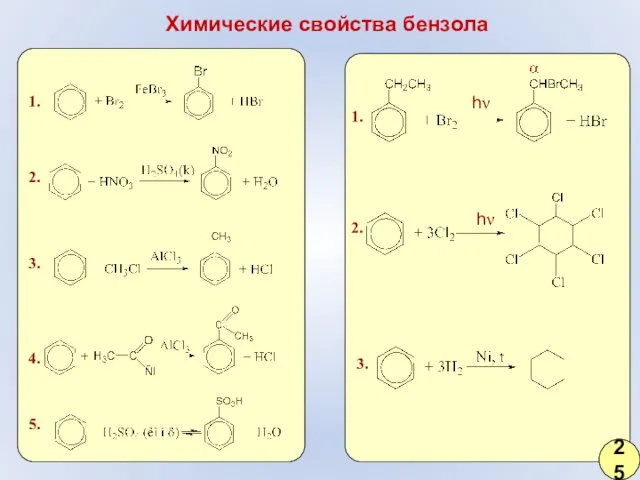
- 19. Химические свойства бензола 1. 2. 3. 4. 5. 1. 2. 3. hν hν 25
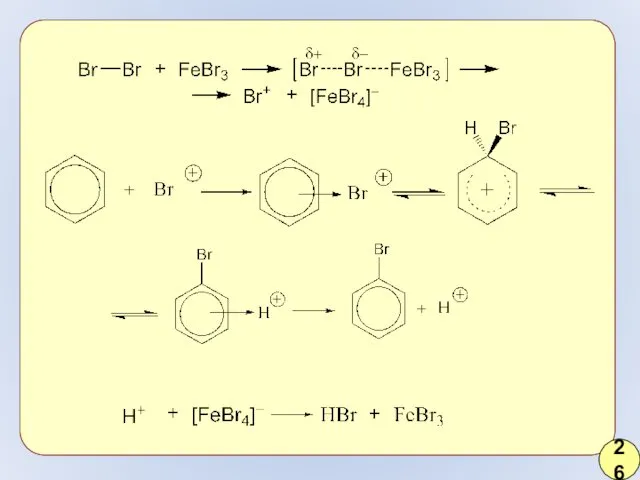
- 20. 26
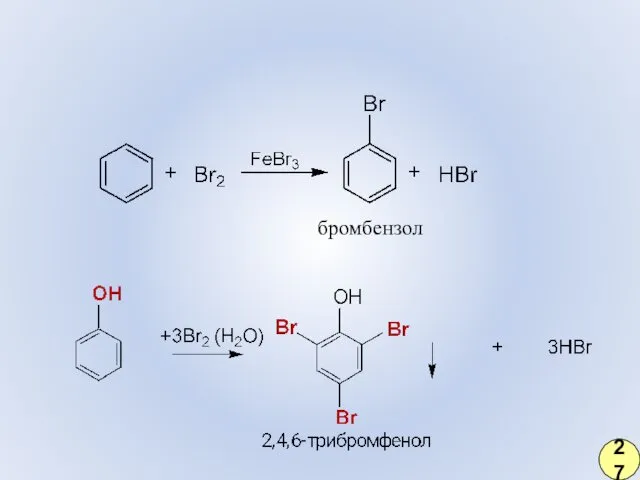
- 21. бромбензол 27
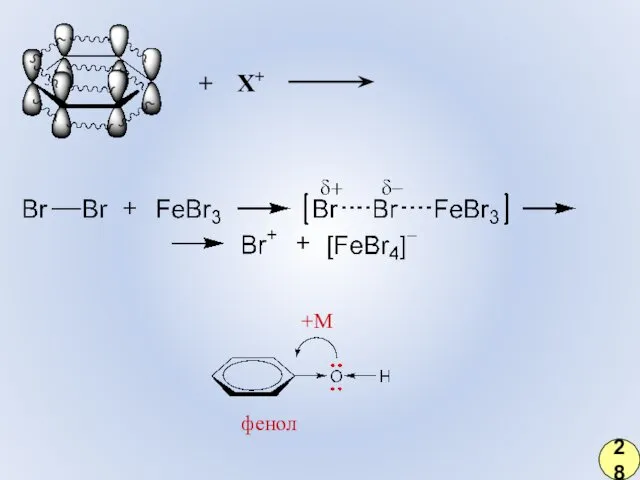
- 22. +М фенол + Х+ 28
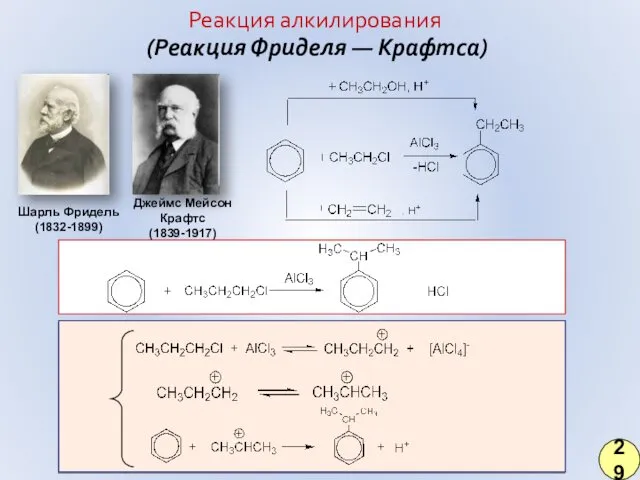
- 23. (Реакция Фриделя — Крафтса) Шарль Фридель (1832-1899) Джеймс Мейсон Крафтс (1839-1917) Реакция алкилирования 29
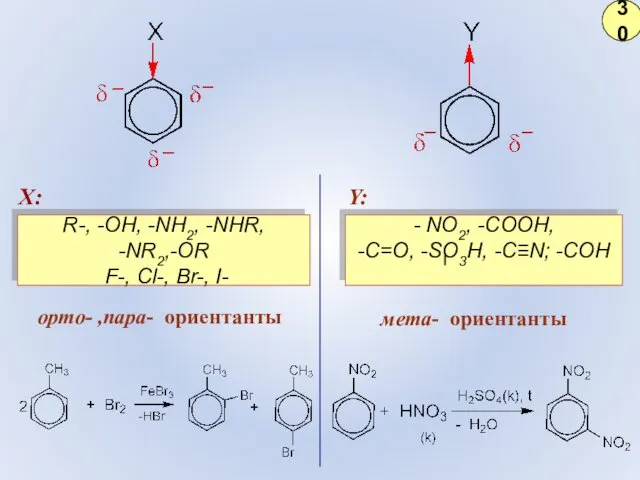
- 24. орто- ,пара- ориентанты мета- ориентанты X: Y: R-, -OH, -NH2, -NHR, -NR2,-OR F-, Cl-, Br-, I-
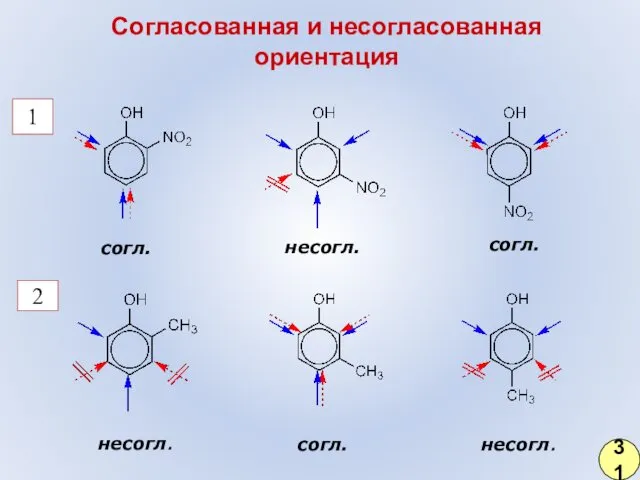
- 25. Согласованная и несогласованная ориентация 1 2 согл. несогл. согл. несогл. согл. несогл. 31
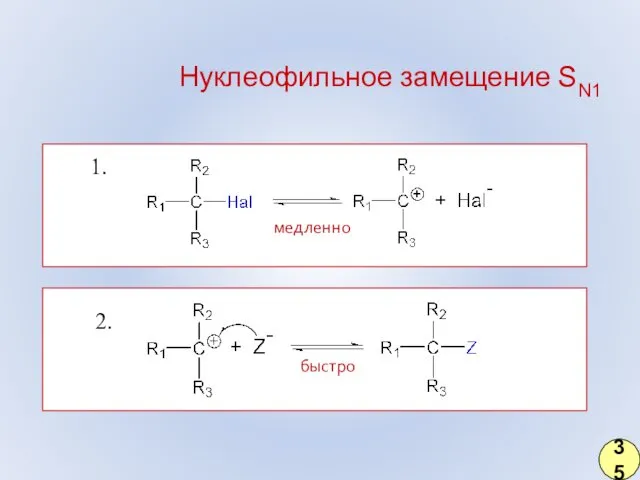
- 26. Нуклеофильное замещение SN1 медленно 1. 2. быстро 35
- 27. Нуклеофильное замещение SN2 «push-pull» – «тяни-толкай» Модель «вывернутого зонтика» 36
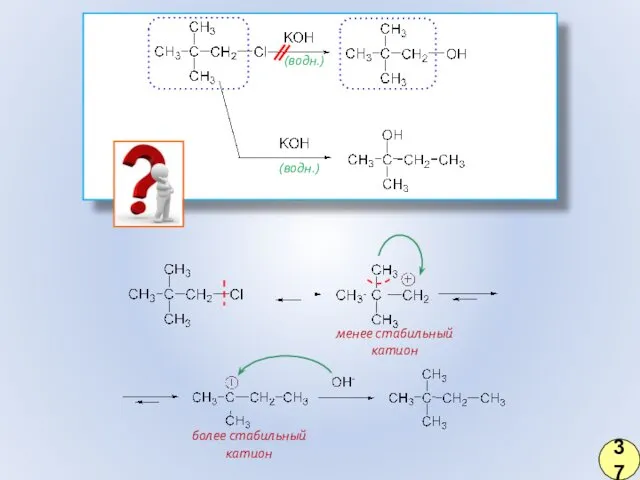
- 28. (водн.) (водн.) менее стабильный катион более стабильный катион 37
- 29. Кислотный катализ
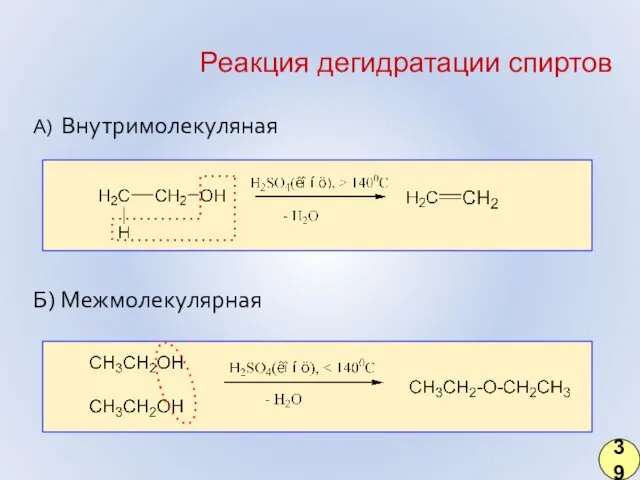
- 30. Реакция дегидратации спиртов А) Внутримолекуляная Б) Межмолекулярная 39
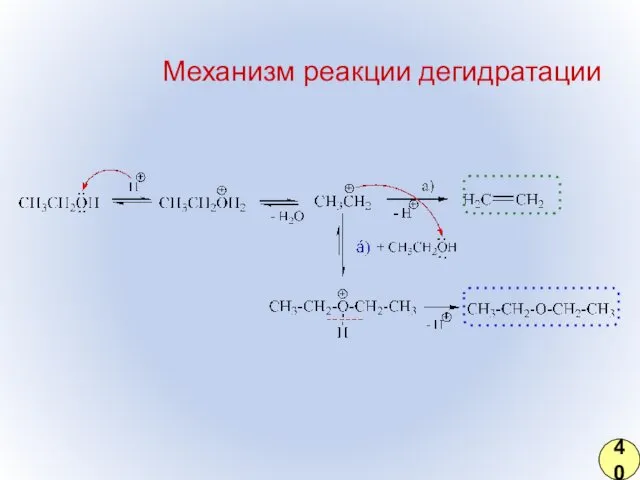
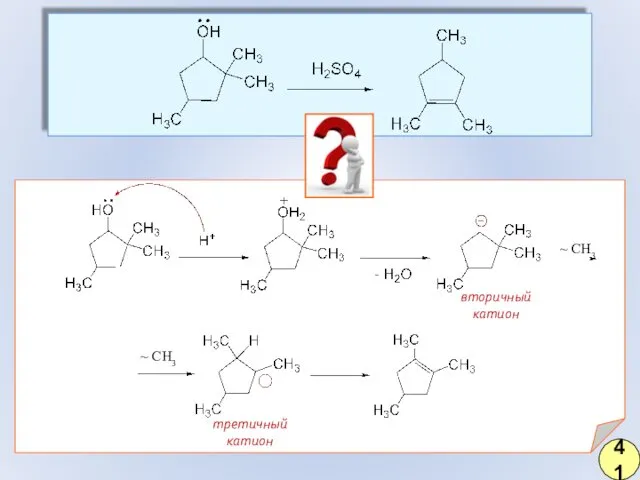
- 31. Механизм реакции дегидратации 40
- 32. ? вторичный катион третичный катион ~ СH3 ~ СH3 41
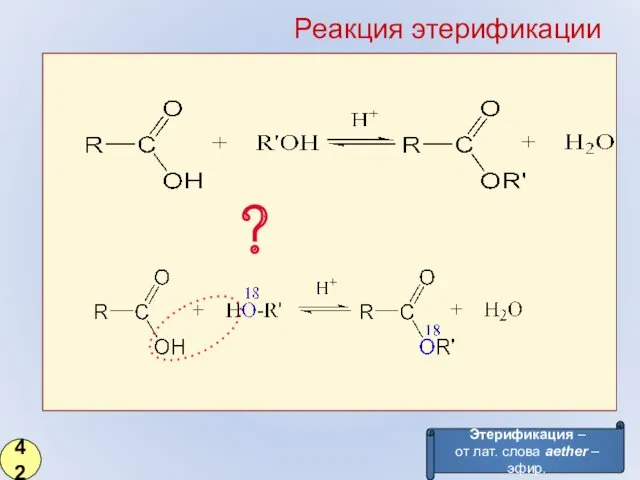
- 33. Этерификация – от лат. слова aether – эфир. ? Реакция этерификации 42
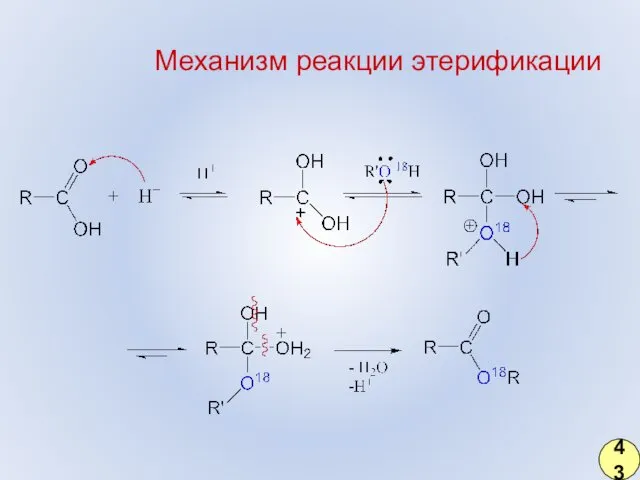
- 34. Механизм реакции этерификации 43
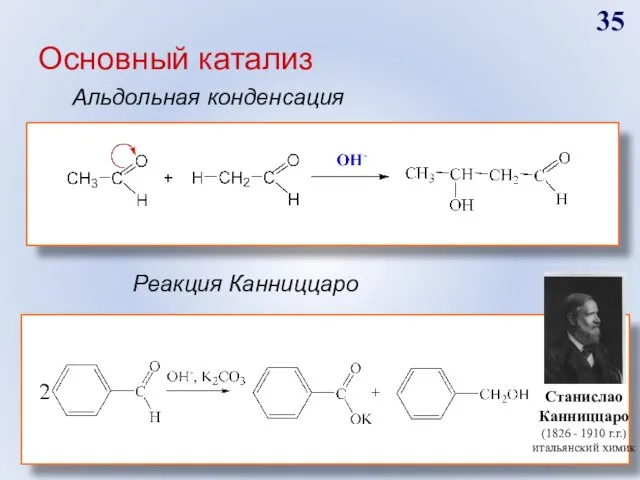
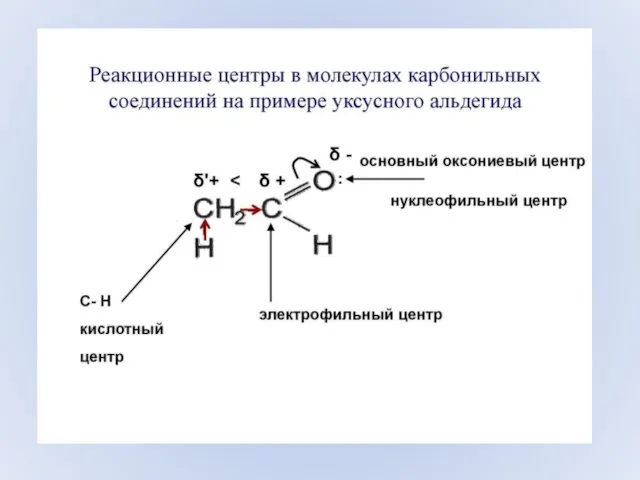
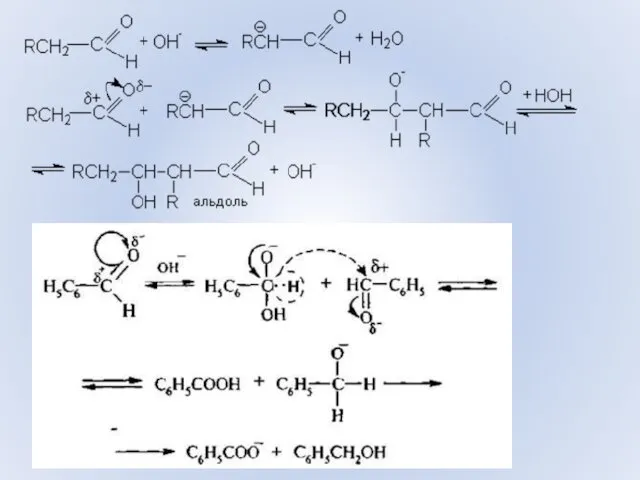
- 35. Основный катализ Альдольная конденсация Реакция Канниццаро Станислао Канниццаро (1826 - 1910 г.г.) итальянский химик
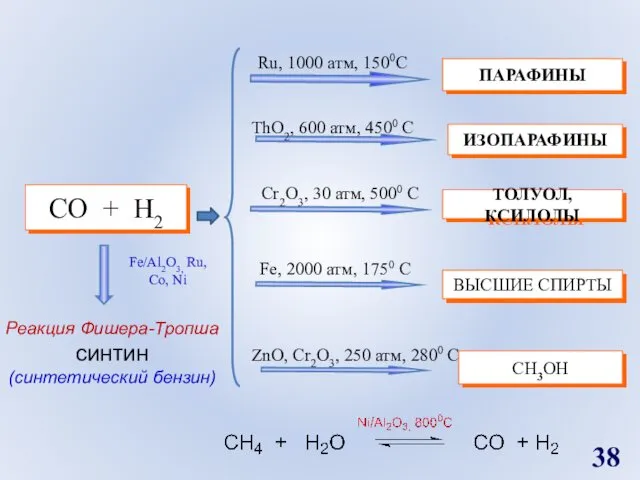
- 38. СO + H2 Ru, 1000 атм, 1500C ThO2, 600 атм, 4500 C Cr2O3, 30 атм, 5000
- 39. При риформинге н-гептана образуется бензол. Винилацетилен получают димеризацией ацетилена. Ацетилен можно получить в результате термического разложения
- 40. Катализатор Циглера - Натта Цис-полиизопрен 51 1963 г. – Нобелевская премия по химии «за открытия в
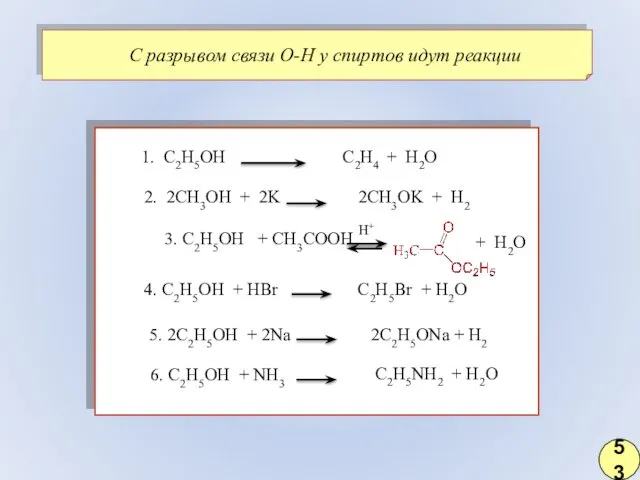
- 41. 1. С2H5OH 2. 2CH3OH + 2K 3. С2H5OH + СH3COOH 4. С2H5OH + HBr 5. 2С2H5OH
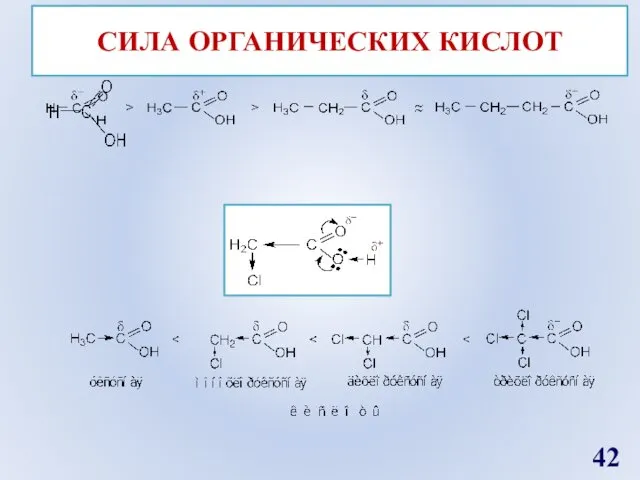
- 42. СИЛА ОРГАНИЧЕСКИХ КИСЛОТ
- 43. pKa 7,1 10,0 10,2
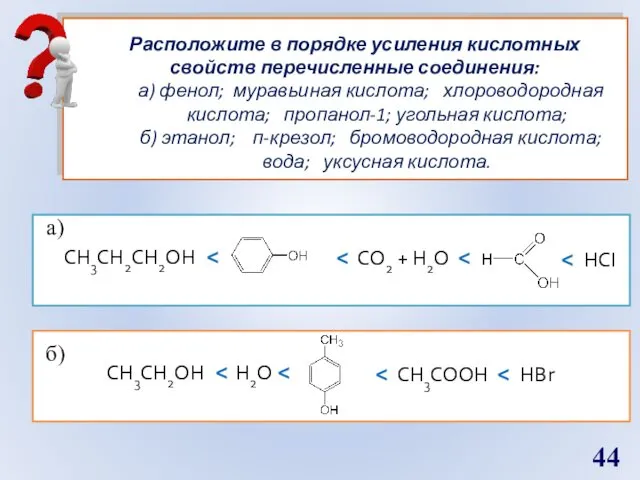
- 44. Расположите в порядке усиления кислотных свойств перечисленные соединения: а) фенол; муравьиная кислота; хлороводородная кислота; пропанол-1; угольная
- 45. Дипольные моменты (µ) винилхлорида и этилхлорида равны, соответственно 1,44 D и 2, 05 D. Как можно
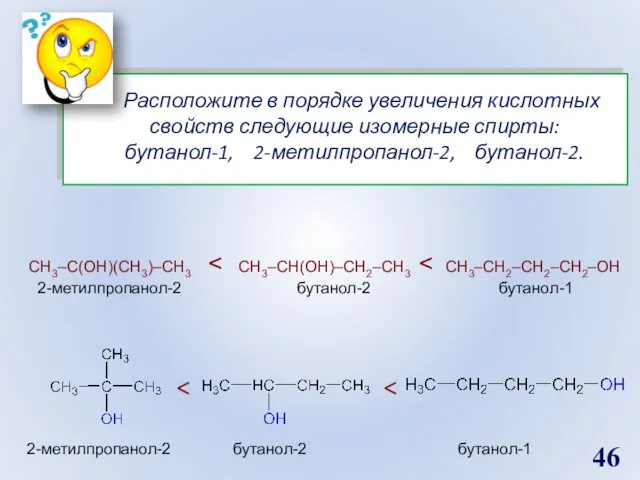
- 46. Расположите в порядке увеличения кислотных свойств следующие изомерные спирты: бутанол-1, 2-метилпропанол-2, бутанол-2. СН3–С(ОН)(СН3)–СН3 2-метилпропанол-2 бутанол-2 бутанол-1
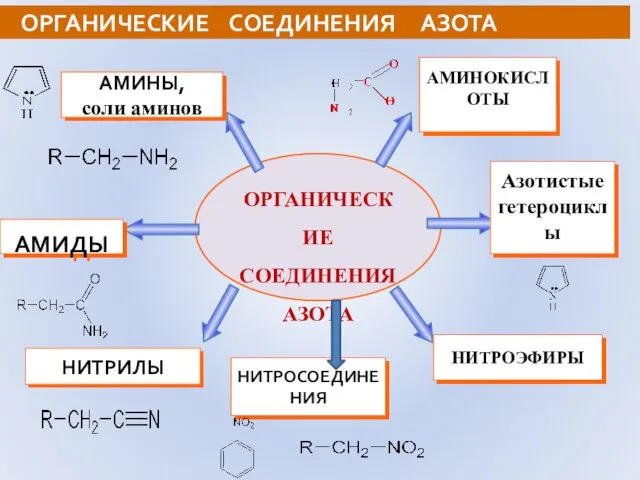
- 47. ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТА ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ АЗОТА АМИНОКИСЛОТЫ Азотистые гетероциклы НИТРОЭФИРЫ НИТРИЛЫ АМИДЫ АМИНЫ, соли аминов НИТРОСОЕДИНЕНИЯ
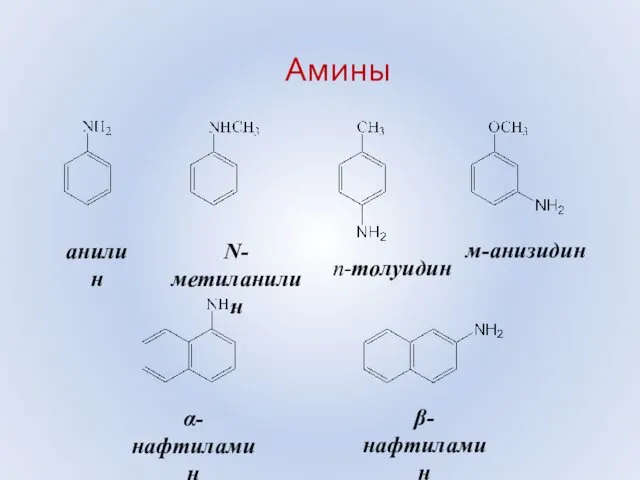
- 48. анилин N-метиланилин п-толуидин м-анизидин α-нафтиламин β-нафтиламин Амины
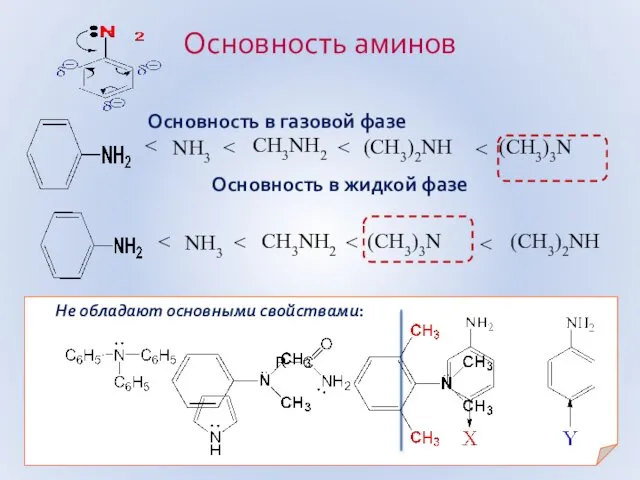
- 49. Основность в газовой фазе Основность в жидкой фазе Не обладают основными свойствами: Основность аминов
- 50. диэтиламин анилин диметиламин дифениламин этиламин пиридин
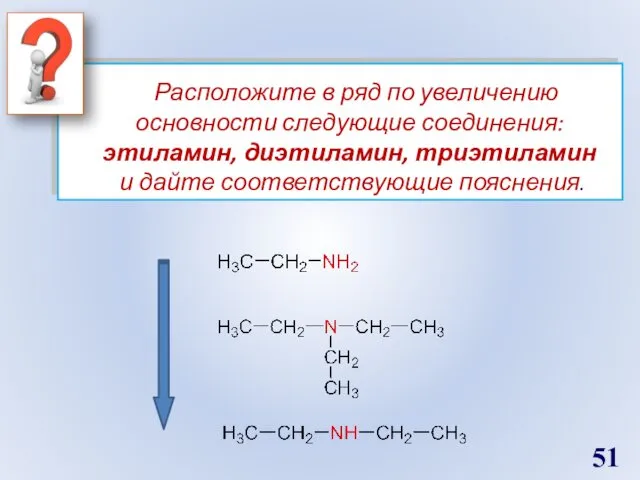
- 51. Расположите в ряд по увеличению основности следующие соединения: этиламин, диэтиламин, триэтиламин и дайте соответствующие пояснения.
- 52. Аммиак и диметиламин Метиламин и анилин Анилин и аммиак Диэтиламин и дифениламин 5. Триметиламин и метиламин
- 53. Анилин - жидкость, хорошо растворимая в воде Анилин легче реагирует с бромом, чем бензол. Анилин токсичен
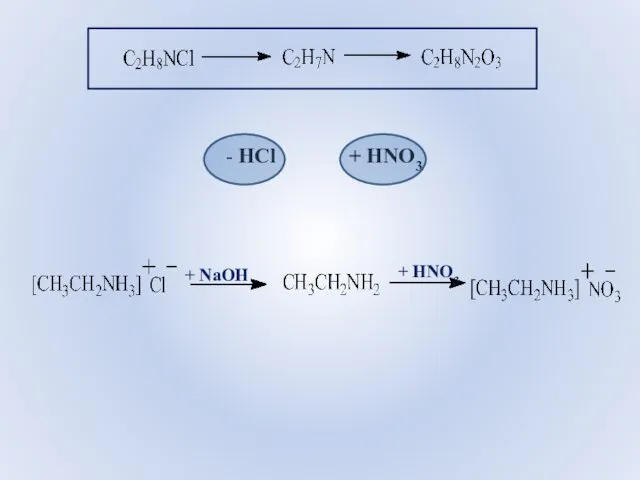
- 54. - HCl + HNO3 + NaOH + HNO3
- 55. Реагирует с КОН Имеет молекулярную структуру Реагирует с AgNO3 Обесцвечивает бромную воду Реагирует c HCl
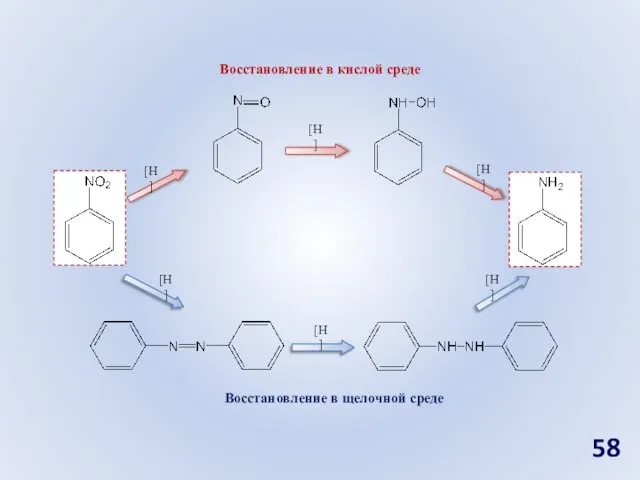
- 56. В кислой среде В щелочной среде В газовой фазе [H] 250-350°C
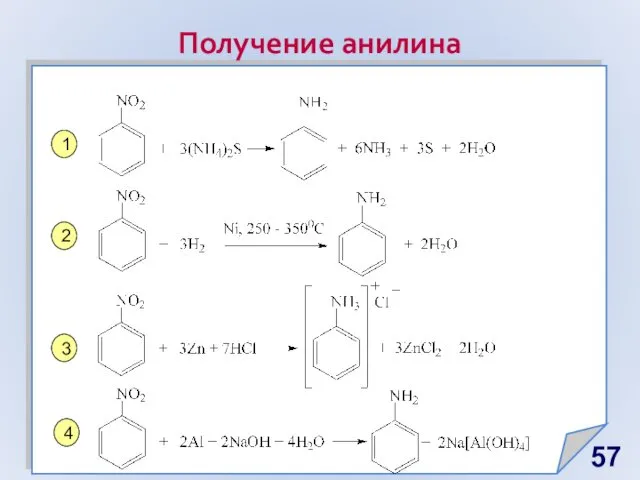
- 57. Получение анилина 1 2 3 4
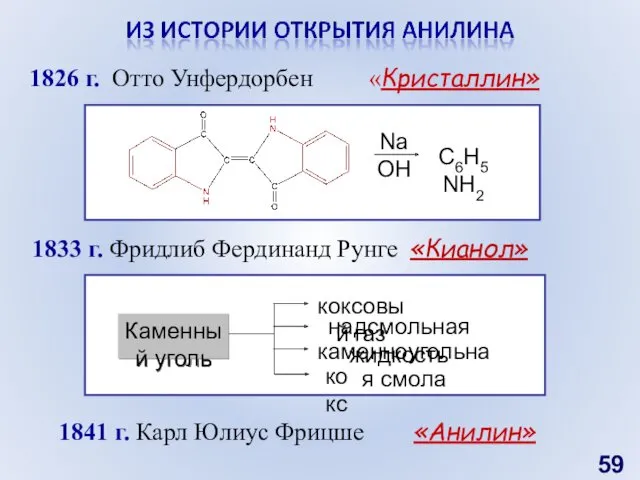
- 59. 1826 г. Отто Унфердорбен «Кристаллин» 1833 г. Фридлиб Фердинанд Рунге «Кианол» 1841 г. Карл Юлиус Фрицше
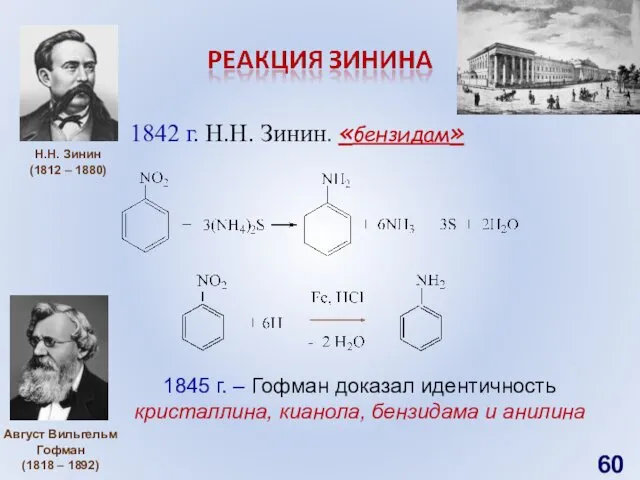
- 60. 1842 г. Н.Н. Зинин. «бензидам» Н.Н. Зинин (1812 – 1880) 1845 г. – Гофман доказал идентичность
- 61. (1809—1880) Ю́стус ЛИ́БИХ (1803— 1873) . Николай Николаевич ЗИНИН (1812— 1880) . Александр Абрамович ВОСКРЕСЕНСКИЙ 6
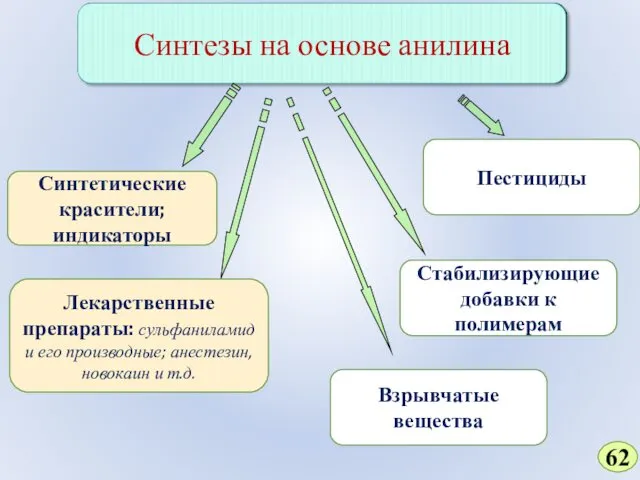
- 62. Синтетические красители; индикаторы Лекарственные препараты: сульфаниламид и его производные; анестезин, новокаин и т.д. Взрывчатые вещества Пестициды
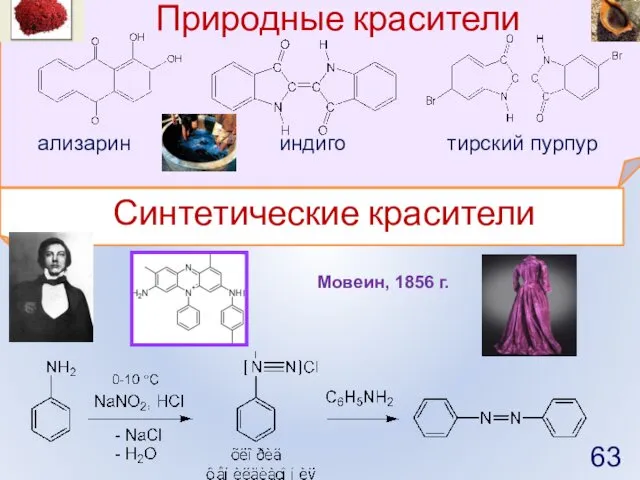
- 63. Природные красители ализарин индиго тирский пурпур Синтетические красители Мовеин, 1856 г.
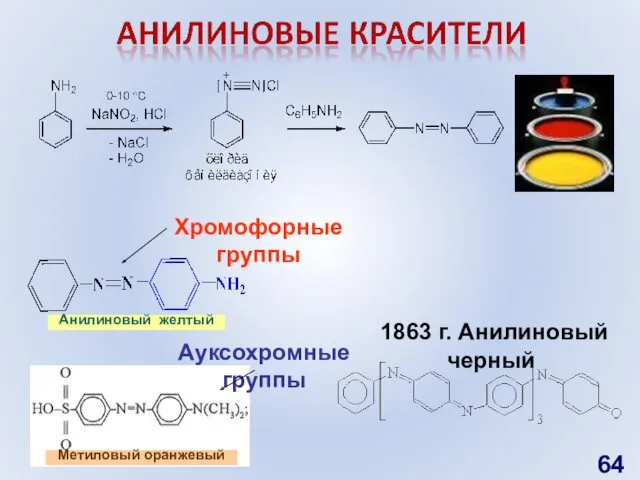
- 64. Анилиновый желтый 1863 г. Анилиновый черный Хромофорные группы Ауксохромные группы Метиловый оранжевый
- 65. Свойства В отличие от триметиламина анилин Реагирует с НСI Взаимодействует с СН3СI Образует с бромной водой
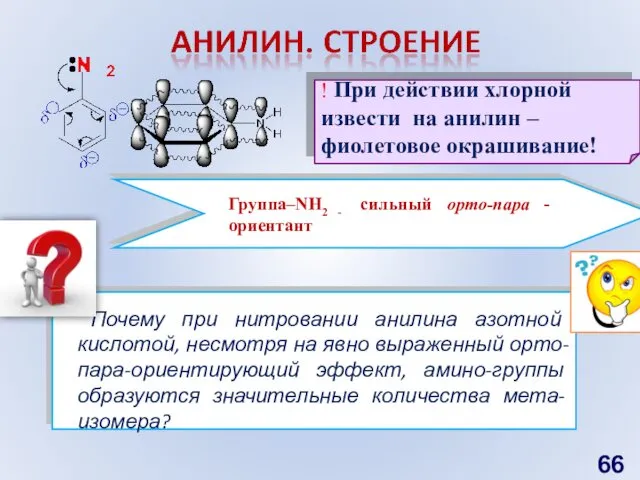
- 66. Почему при нитровании анилина азотной кислотой, несмотря на явно выраженный орто-пара-ориентирующий эффект, амино-группы образуются значительные количества
- 67. Свойства Нельзя различить с помощью бромной воды бензол и фенол бензол и анилин анилин и фенол
- 68. Свойства Установить соответствие между двумя веществами и реагентом, позволяющим их отличить: 1 2 4 3
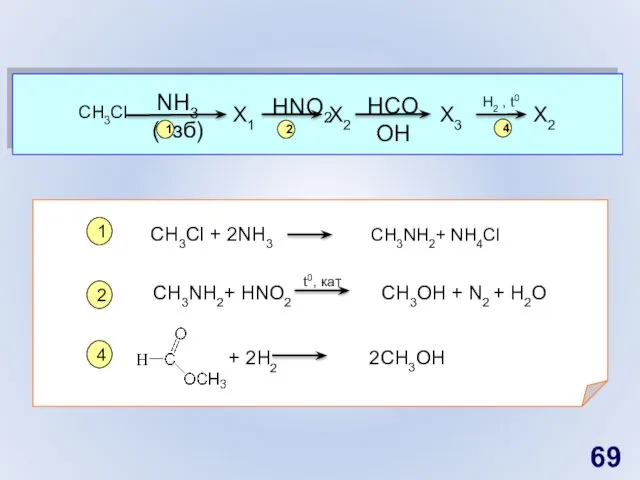
- 69. CH3Cl X1 NH3 (изб) X2 X3 X2 H2 , t0 HNO2 HCOOH 1 4 2 CH3Cl
- 70. CH3СH2CH2CH2OH X1 H2SO4 (конц) t0>1400 X2 X3 HBr, H2O2 NH3 В схеме превращений вещество X3 1-аминобутан
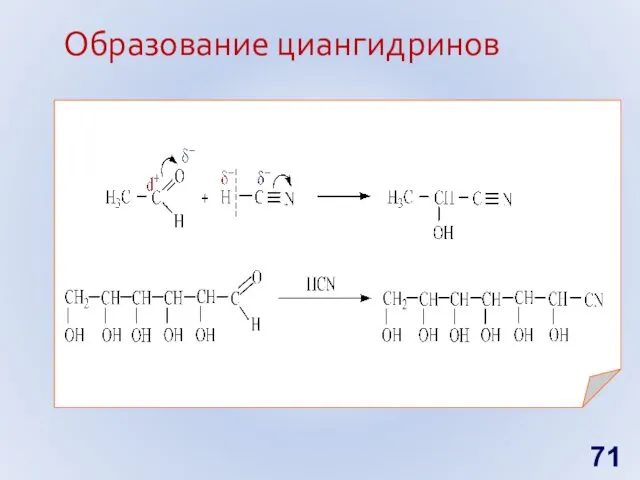
- 71. Образование циангидринов
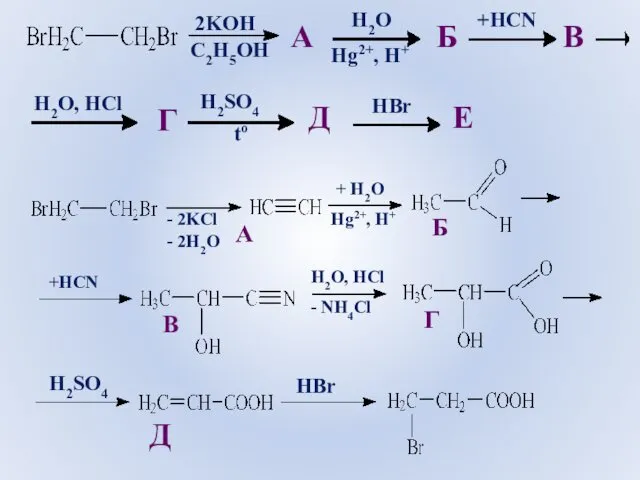
- 72. - 2KCl - 2H2O А + H2O Hg2+, H+ А +HCN Б В H2O, HCl -
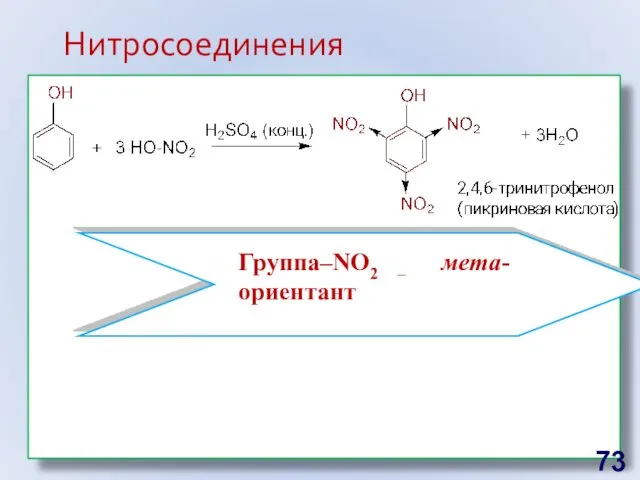
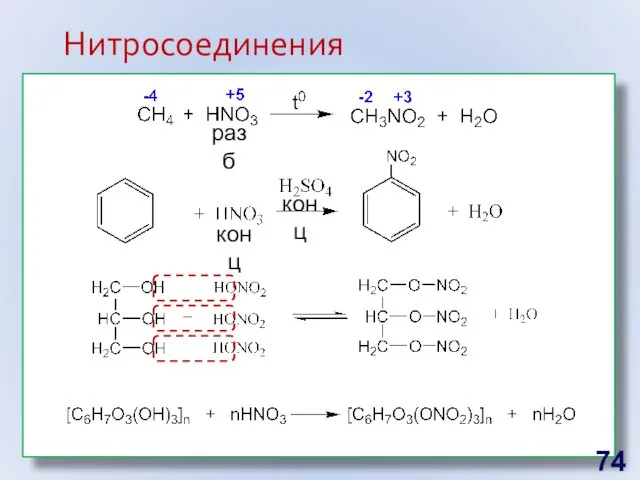
- 73. Нитросоединения Группа–NО2 – мета-ориентант
- 74. конц конц разб Нитросоединения
- 75. Кристиан Фридрих Шёнбейн (1799-1868 гг) профессор Базельскогго университета Нитроцеллюлоза и ее производные Начинка для снарядов и
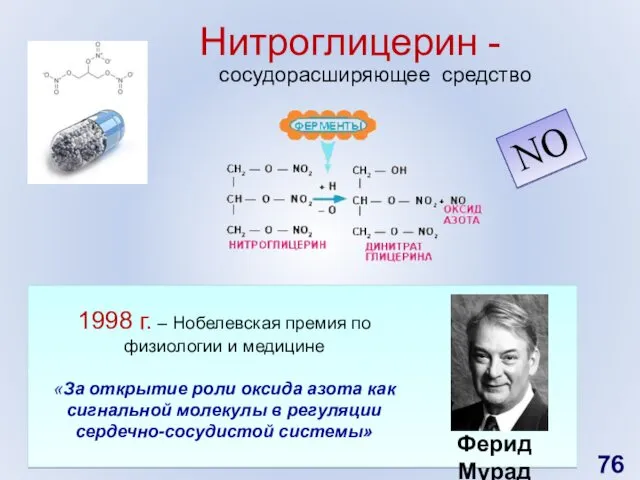
- 76. NO Нитроглицерин - сосудорасширяющее средство Ферид Мурад американский врач 1998 г. – Нобелевская премия по физиологии
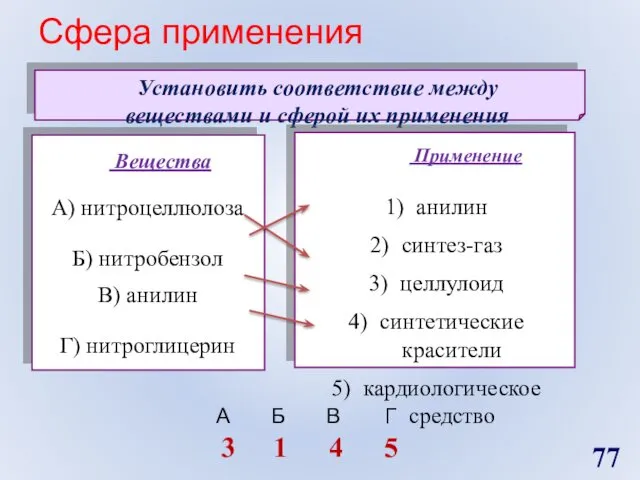
- 77. Сфера применения Установить соответствие между веществами и сферой их применения 3 1 4 5
- 78. Формула С6H5-CH(NH2)-CH2-COOH. Ароматический амин. Образует со спиртами сложные эфиры. Участвует в реакции поликонденсации. Не реагирует с
- 79. KOH, HCl, CH3NH2, СН3OH NaCl, KOH, NH3, H2 HNO2, NaOH, СН3СI, NH3, Na, HCl, NaOH, N2
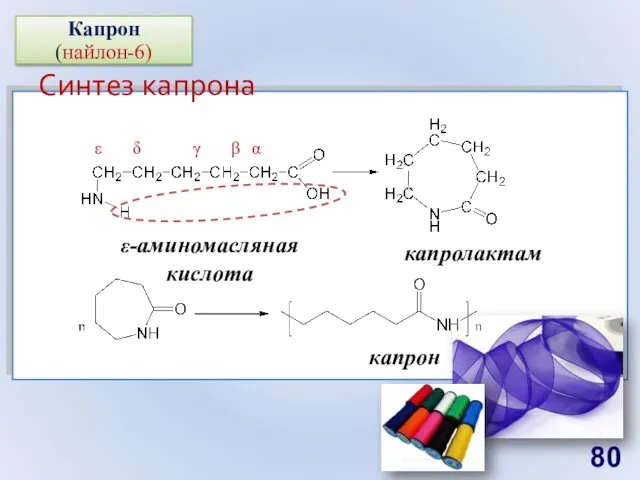
- 80. Синтез капрона Капрон (найлон-6) ε ε-аминомасляная кислота капролактам α δ γ β капрон
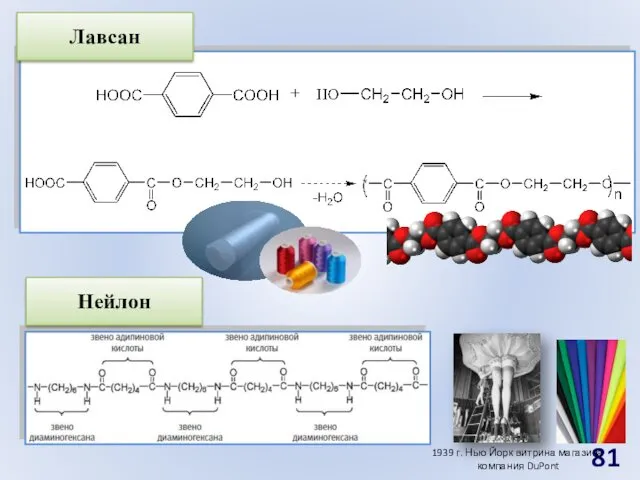
- 81. Нейлон Лавсан 1939 г. Нью Йорк витрина магазина компания DuPont
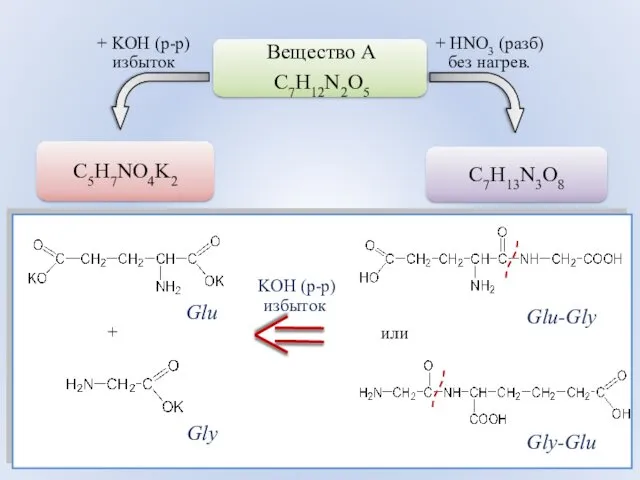
- 82. + KOH (р-р) избыток + HNO3 (разб) без нагрев. Glu-Gly Gly-Glu Glu Gly + или
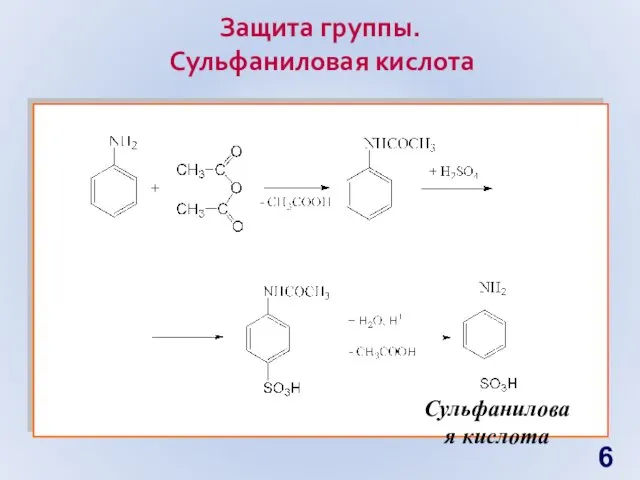
- 83. 6 Защита группы. Cульфаниловая кислота Сульфаниловая кислота
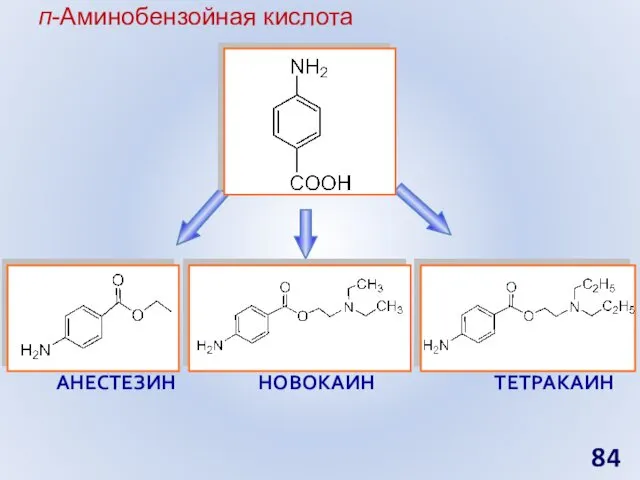
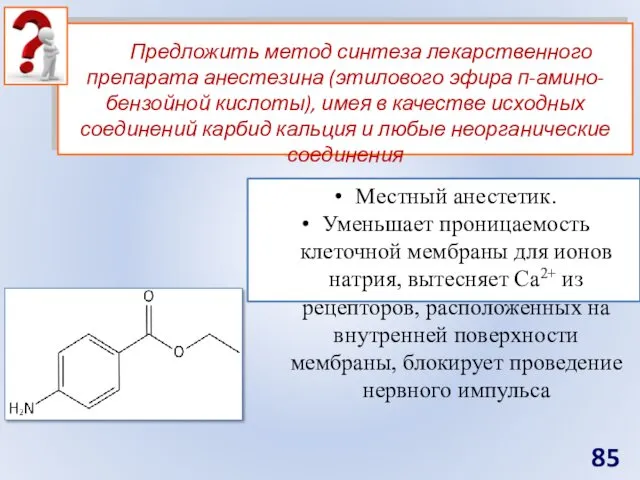
- 84. п-Аминобензойная кислота НОВОКАИН ТЕТРАКАИН АНЕСТЕЗИН
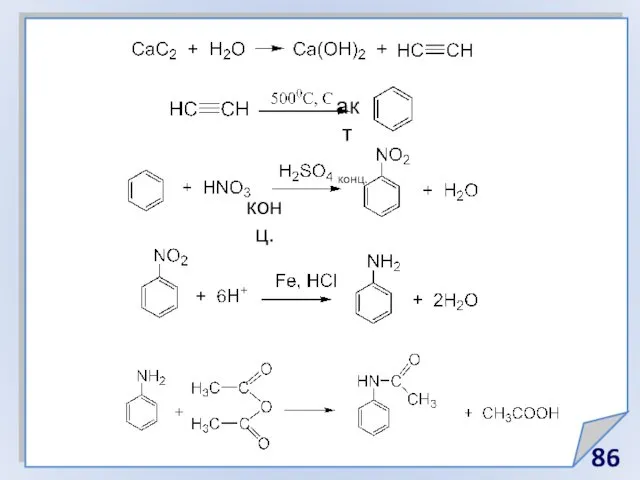
- 85. Предложить метод синтеза лекарственного препарата анестезина (этилового эфира п-амино-бензойной кислоты), имея в качестве исходных соединений карбид
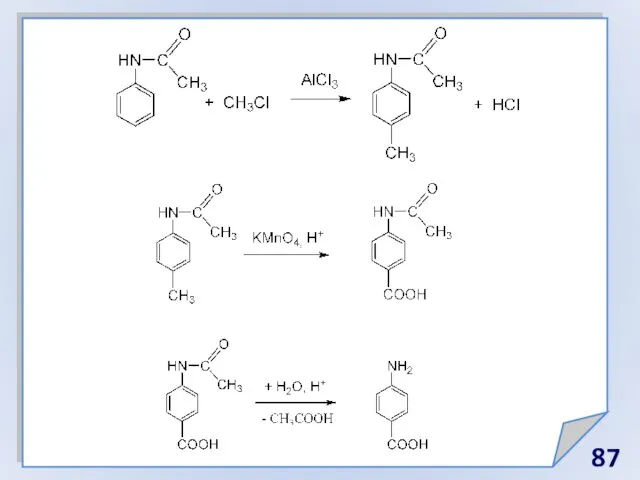
- 86. акт конц. конц.
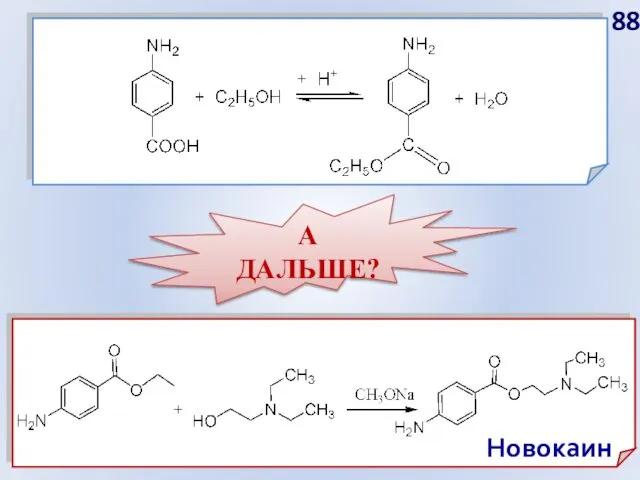
- 88. Новокаин А ДАЛЬШЕ?
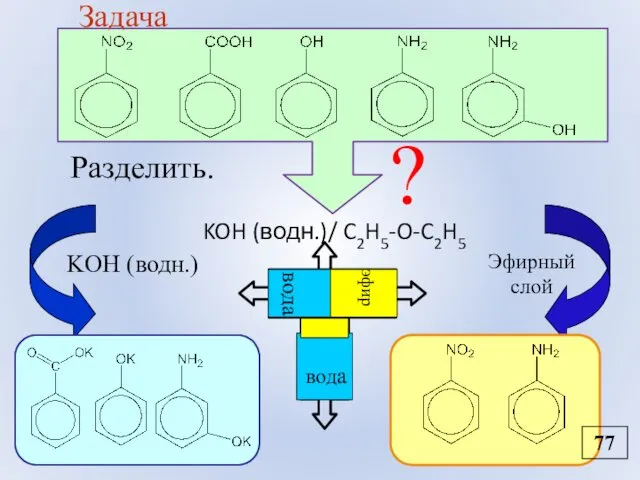
- 89. ? KOH (водн.)/ C2H5-O-C2H5 KOH (водн.) Эфирный слой Задача Разделить. 77
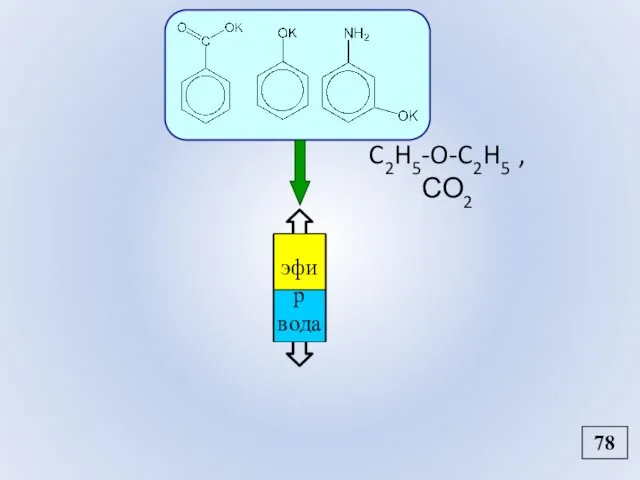
- 90. C2H5-O-C2H5 , СО2 78
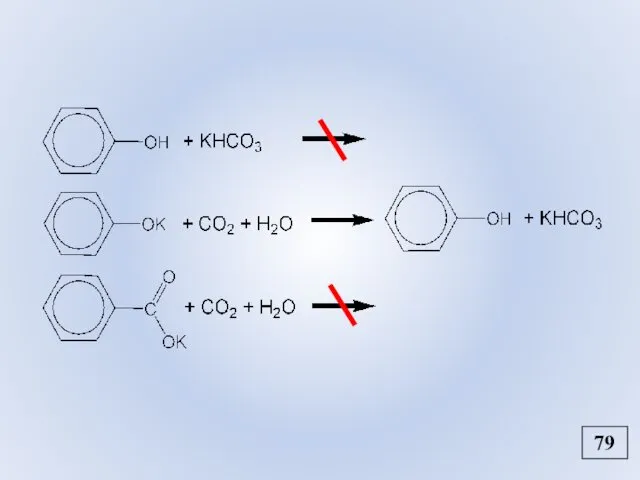
- 91. 79
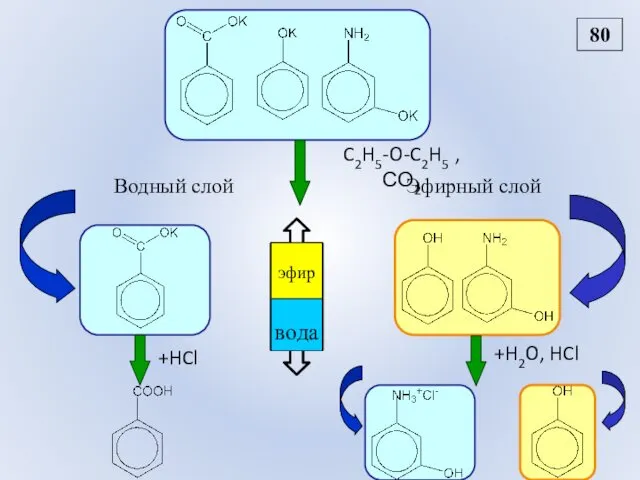
- 92. C2H5-O-C2H5 , СО2 +HCl +H2O, HCl Водный слой Эфирный слой 80
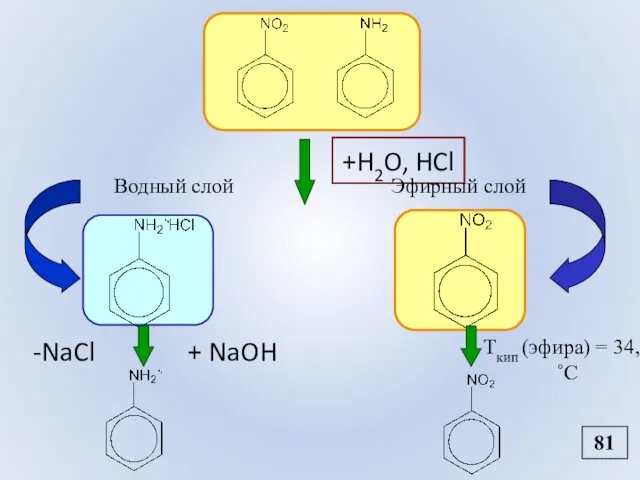
- 93. +H2O, HCl Tкип (эфира) = 34,5˚С + NaOH -NaCl Водный слой Эфирный слой 81
- 95. Скачать презентацию














![В кислой среде В щелочной среде В газовой фазе [H] 250-350°C](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/107324/slide-55.jpg)








 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды