Содержание
- 2. 1) Н2О → Н2↑ + О2↑ 2) Zn + HCl → ZnCl2 + H2↑ 3) Mg
- 3. 1) 2Н2О → 2Н2↑ + О2↑ 2) Zn + 2HCl → ZnCl2 + H2↑ 3) 2Mg
- 4. «Типы химических реакций» Тема урока:
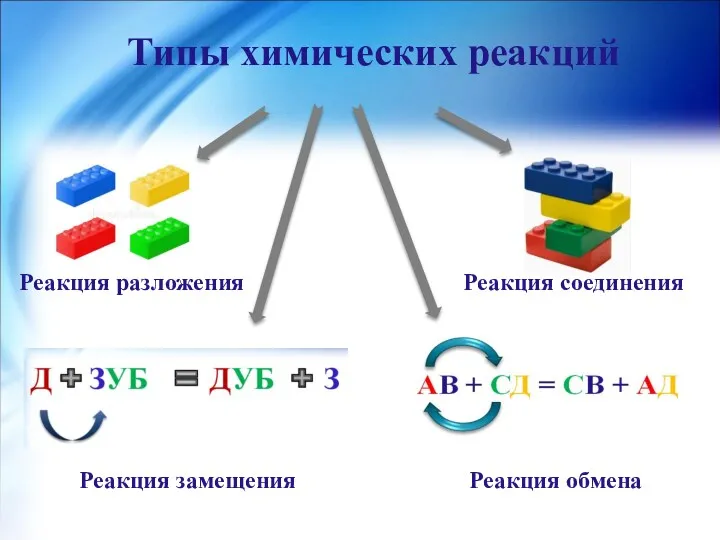
- 5. Типы химических реакций Реакция разложения Реакция соединения Реакция замещения Реакция обмена
- 6. Техника безопасности: Спиртовку зажигаем от спички и тушим, накрывая колпачком. При нагревании веществ пробирку закрепляем в
- 8. Что общего в данных реакциях? 2Н2О = 2Н2↑ + О2↑ 2KMnO4 = K2MnO4 + MnO2 +
- 9. Лабораторный опыт № 1 Cu(OH)2 = CuO + H2O t голубой цвет Порошок черного цвета
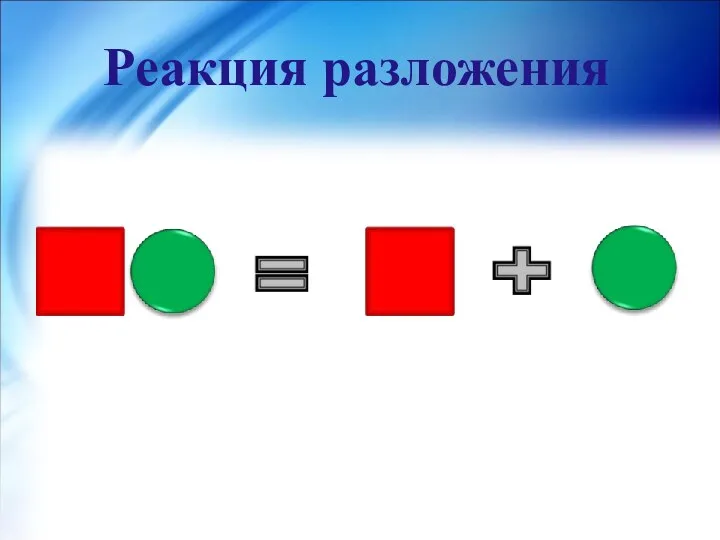
- 10. Реакция разложения- реакция, в результате которой из одного сложного вещества образуются два или несколько простых или
- 11. Реакция разложения
- 12. Что общего в данных реакциях? 2Mg + O2 = 2MgO BaO + H2O = Ba(OH)2 Fe
- 13. Лабораторный опыт № 2 2Мg + O2 → 2MgO + Q
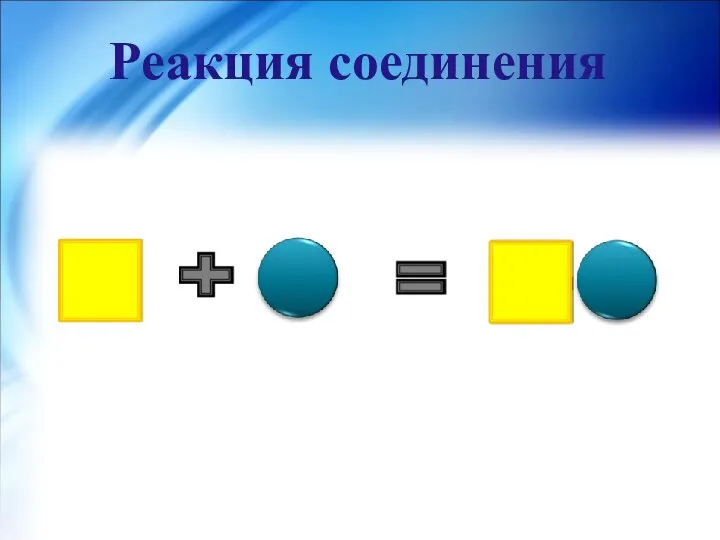
- 14. Реакция соединения- реакция, в результате которой из двух или нескольких простых или сложных веществ образуется одно
- 15. Реакция соединения
- 16. Что общего в данных реакциях? Zn + 2HCl = ZnCl2 + H2↑ H2 + CuO =
- 17. Лабораторный опыт № 3 ↓ Fe + CuSO4 → FeSO4 + Cu Синий раствор Зеленый раствор
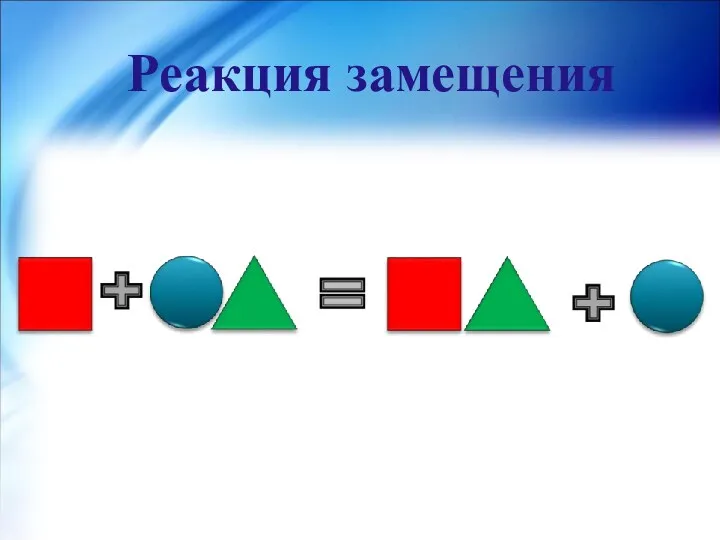
- 18. Реакция замещения- реакция между простым и сложным веществами, в результате которой атомы простого вещества замещают атомы
- 19. Реакция замещения
- 20. Что общего в данных реакциях? Zn(OH)2 + 2HCl = ZnCl2 + 2H2O 2HCl + CuS =
- 21. Лабораторный опыт № 4 ↓ 2NaOH + CuSO4 →Na2SO4 + Cu(OH)2 голубой раствор Осадок синий
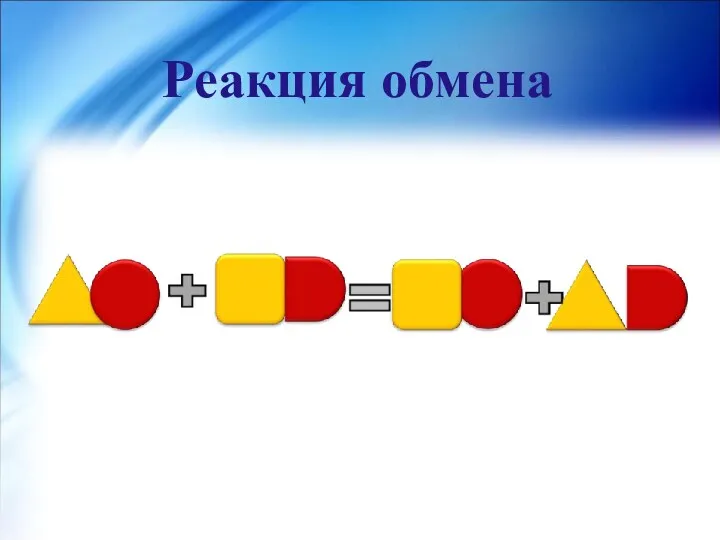
- 22. Реакция обмена- реакция между двумя сложными веществами, в результате которой происходит обмен составными частями сложных веществ.
- 23. Реакция обмена
- 24. Проверь себя
- 25. Закончите уравнения реакций: К какому типу относят каждую реакцию? MgCO3 → MgO + CO2 CuO +
- 26. Проверь знания MgCO3 → MgO + CO2 разл CuO + 2Al → Al2O3 + 3Cu замещ.
- 27. 1.§ 11 Записать и выучить определения типов химических реакций. 2.Упр. 10 (з-о) стр. 57 3. Дополнительное
- 29. Скачать презентацию





















 Физико-химические свойства жиров
Физико-химические свойства жиров Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Соли, их классификация и свойства
Соли, их классификация и свойства Халькогены. Кислород
Халькогены. Кислород Алкадиены
Алкадиены Химические свойства солей
Химические свойства солей Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Полимеры. Структура и свойства
Полимеры. Структура и свойства Амины
Амины Химическая очистка воды
Химическая очистка воды Кристаллохимия негіздері
Кристаллохимия негіздері Этиловый спирт в жизни человека
Этиловый спирт в жизни человека 20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii
20231104_prezentatsiya_teoriya_elektroliticheskoy_dissotsiatsii Crystal structure and surface phase composition of palladium oxides thin films for gas sensors
Crystal structure and surface phase composition of palladium oxides thin films for gas sensors Природные источники углеводородов
Природные источники углеводородов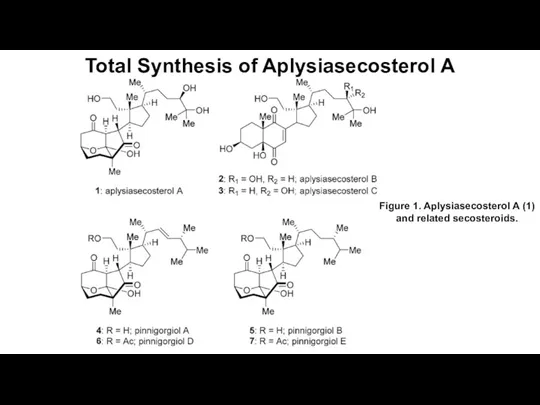 Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Классификация неорганический веществ
Классификация неорганический веществ Изотопы химических элементов
Изотопы химических элементов Окислительно - восстановительные реакции (ОВР) (часть 1)
Окислительно - восстановительные реакции (ОВР) (часть 1) Кислотно-основные (протолитические) равновесия
Кислотно-основные (протолитические) равновесия Каталитикалық риформинг
Каталитикалық риформинг Неметаллические материалы
Неметаллические материалы Кристаллическое состояние вещества
Кристаллическое состояние вещества Концентрация кобальта
Концентрация кобальта Введение в минералогию. Генезис минералов
Введение в минералогию. Генезис минералов Sm-Nd метод
Sm-Nd метод Кислород, его характеристика, получение и свойства
Кислород, его характеристика, получение и свойства Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов