Содержание
- 2. КЛАССИФИКАЦИЯ СОЛЕЙ По растворимости в воде Растворимые Нерастворимые Малорастворимые Аммиачная селитра NH4NO3 Сульфат кальция Фосфат железа
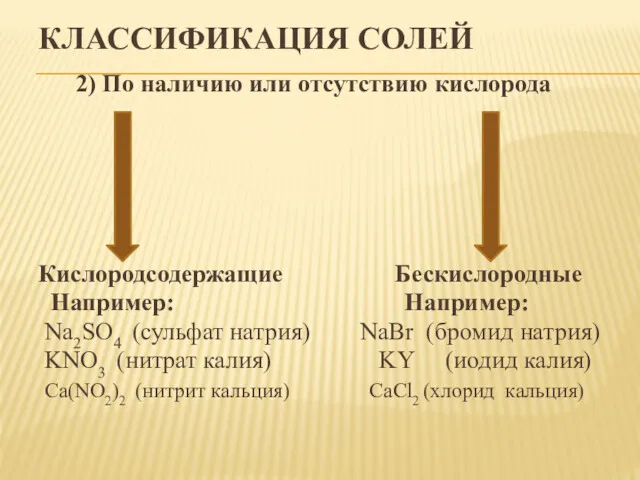
- 3. КЛАССИФИКАЦИЯ СОЛЕЙ 2) По наличию или отсутствию кислорода Кислородсодержащие Бескислородные Например: Например: Na2SO4 (сульфат натрия) NaBr
- 4. КЛАССИФИКАЦИЯ СОЛЕЙ ПО СОСТАВУ Соли бывают: Средние соли – это продукты полного замещения атомов водорода в
- 5. 2) Кислые соли – это продукты неполного замещения атомов водорода в кислоте на металл. Например: NaHCO3
- 6. 3) Основные соли – это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например: (CuOH)2CO3
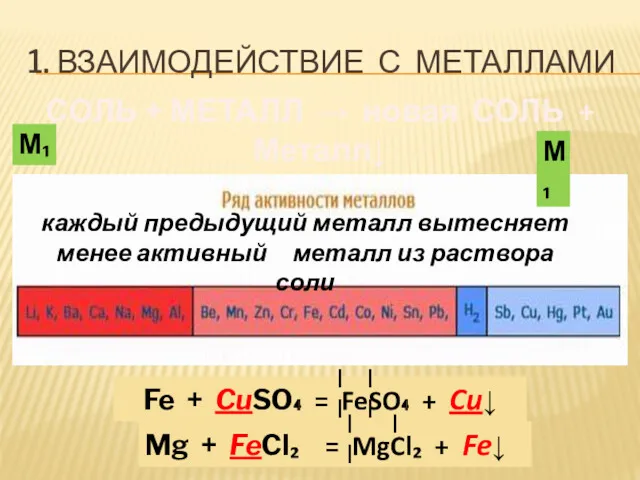
- 7. 1. ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ СОЛЬ + МЕТАЛЛ → новая СОЛЬ + Металл↓ каждый предыдущий металл вытесняет
- 8. ПРИМЕР Al + FeSO₄ → III II Fe + Al₂(SO₄)₃ 2 3 3 Cu + MgCl₂
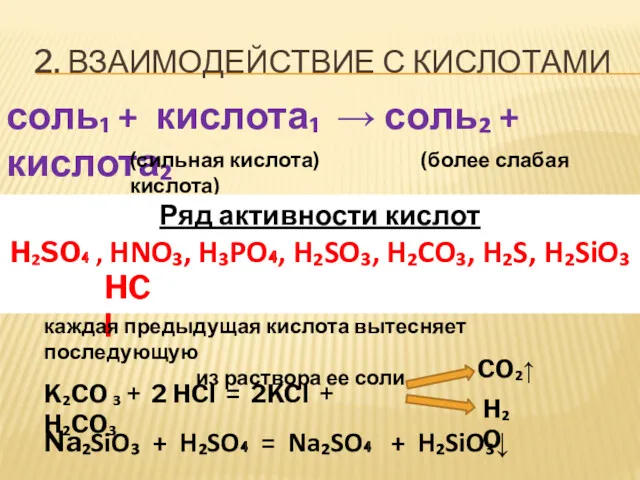
- 9. 2. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ соль₁ + кислота₁ → соль₂ + кислота₂ (сильная кислота) (более слабая кислота)
- 10. ПРИМЕР уравнения реакций: Na₂S + HNO₃→ AgNO₃ + HCl → I I I II NaNO₃ +
- 11. 3. ВЗАИМОДЕЙСТВИЕ С ОСНОВАНИЯМИ соль₁ +основание₁ = соль₂ +основание₂↓ CuSO₄ + 2NaOH = Cu(OH)₂↓ + Na₂SO₄
- 12. 4. ВЗАИМОДЕЙСТВИЕ С СОЛЯМИ соль₁ +соль₂= новая соль₁↓+ новая соль₂ BaCl₂ + Na₂SO₄ = BaSO₄↓ +
- 13. 5. РАЗЛОЖЕНИЕ ПРИ НАГРЕВАНИИ НЕРАСТВОРИМЫХ СОЛЕЙ соль ↓ → оксид металла + оксид неметалла t⁰C BaSiO₃↓
- 14. ВЫВОД: + металл → + кислота → + основание → + соль → разложение при нагревании
- 15. Т Е С Т 1. Карбонат калия - K₂CO₃ реагирует - H₂ 2. Сульфат меди (II)
- 17. Скачать презентацию











 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства