Содержание
- 2. 3. Le trasformazioni fisiche della materia
- 3. 3.1 Gli stati fisici della materia sono detti stati di aggregazione
- 4. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Il mondo che ci circonda è costituito da materia.
- 5. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 I sistemi Un sistema è una porzione delimitata di
- 6. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Gli stati di aggregazione • 1 La materia può
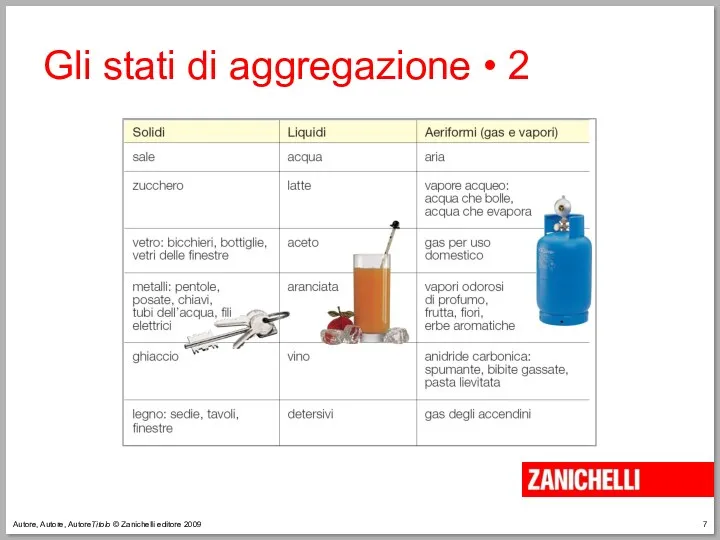
- 7. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Gli stati di aggregazione • 2
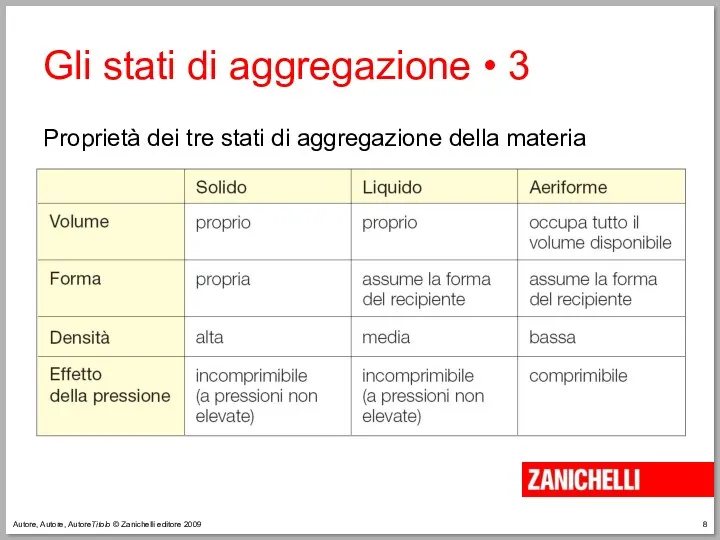
- 8. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Gli stati di aggregazione • 3 Proprietà dei tre
- 9. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Gli stati di aggregazione • 4 Lo stato di
- 10. 3.2 I sistemi possono essere omogenei o eterogenei
- 11. Si dice fase una porzione di materia fisicamente distinguibile e delimitata, con proprietà intensive uniformi in
- 12. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Il contenuto del bicchiere è costituito da due fasi:
- 13. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi omogenei o eterogenei • 3 Un sistema omogeneo
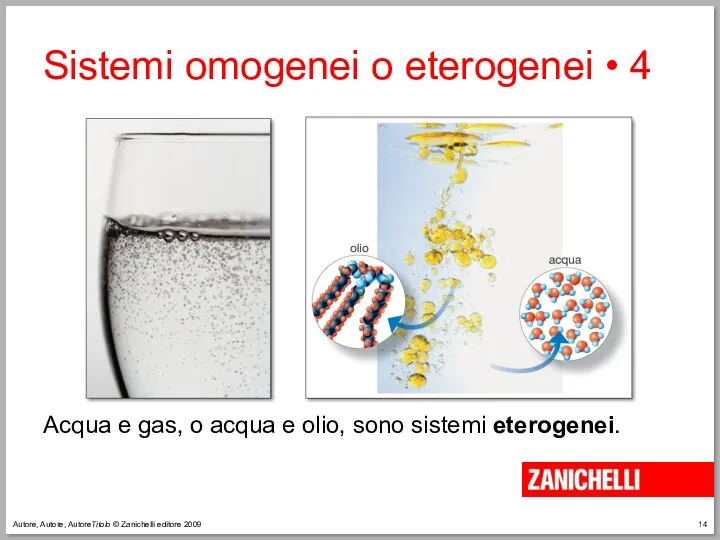
- 14. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi omogenei o eterogenei • 4 Acqua e gas,
- 15. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi omogenei o eterogenei • 5 Il burro è
- 16. 3.3 La materia si divide in sostanze pure e miscugli
- 17. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi puri e miscugli • 1 Un sistema puro
- 18. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi puri e miscugli • 2 L’acqua potabile è
- 19. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi puri e miscugli • 3 Tutte le sostanze
- 20. Sistemi puri e miscugli • 4 Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Anche un sistema
- 21. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi puri e miscugli • 5 Un sistema puro
- 22. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Sistemi puri e miscugli • 6 Differenze tra sistemi
- 23. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Soluzioni • 1 Un miscuglio omogeneo è detto soluzione
- 24. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Soluzioni • 2 L’aria è una soluzione gassosa, di
- 25. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Miscugli eterogenei • 1
- 26. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Miscugli eterogenei • 2 Al microscopio si vedono le
- 27. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Miscugli eterogenei • 3 I miscugli eterogenei possono presentare
- 28. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Miscugli eterogenei • 4 Schiuma: dispersione di un gas
- 29. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Fumo: miscuglio di un solido e un gas (il
- 30. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Emulsione: miscuglio di liquidi immiscibili, ottenuto agitandoli energicamente (la
- 31. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Colloidi • 1 I colloidi hanno caratteristiche intermedie tra
- 32. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Colloidi • 2 Sono sospensioni di grandi particelle (diametro
- 33. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Colloidi • 3 I colloidi appaiono, a prima vista,
- 34. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Colloidi • 4 Effetto Tyndall: In una soluzione le
- 35. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Colloidi • 5 Sono colloidi: il citosol delle cellule,
- 36. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Con speciali procedimenti e ad alta temperatura, è possibile
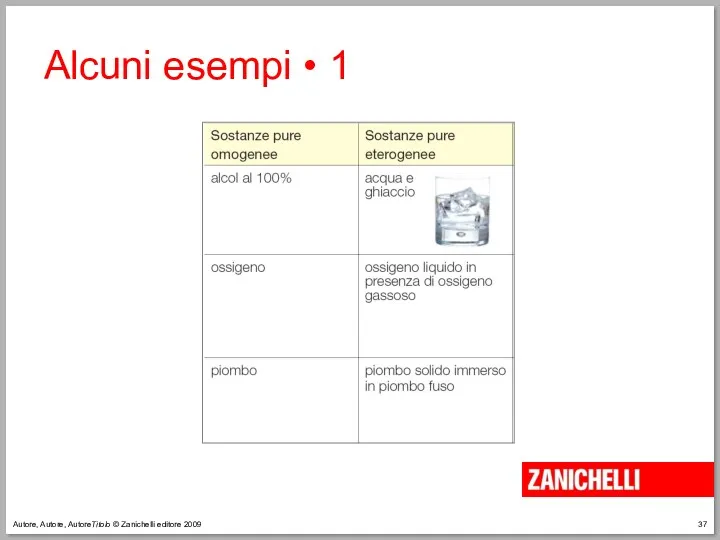
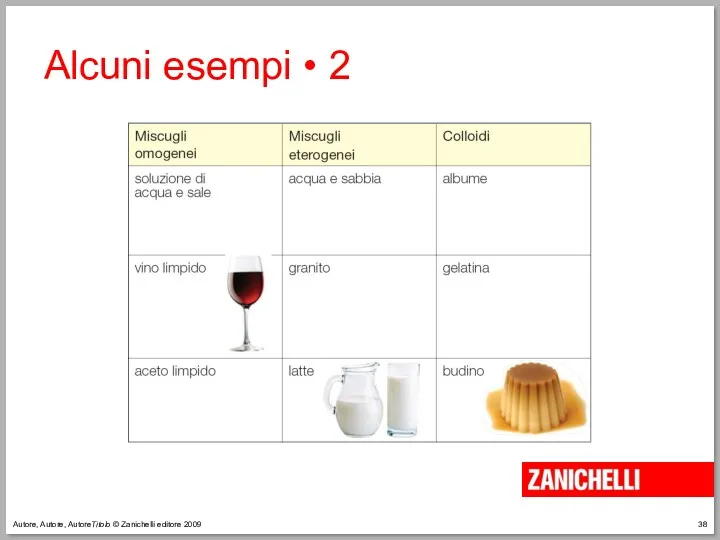
- 37. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Alcuni esempi • 1
- 38. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Alcuni esempi • 2
- 39. 3.4 I passaggi di stato sono variazioni dello stato fisico
- 40. Autore, Autore, AutoreTitolo © Zanichelli editore 2009
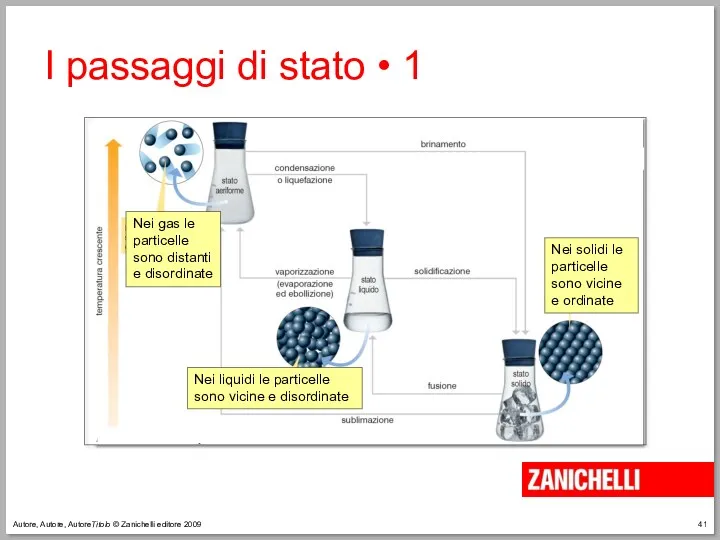
- 41. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 I passaggi di stato • 1
- 42. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Le sostanze passano da uno stato fisico all’altro a
- 43. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 I passaggi di stato • 3 Ad esempio il
- 44. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura critica • 1 Gas e vapore non
- 45. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura critica • 2 La temperatura critica è
- 46. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura critica • 3 L’ossigeno ha Tc =
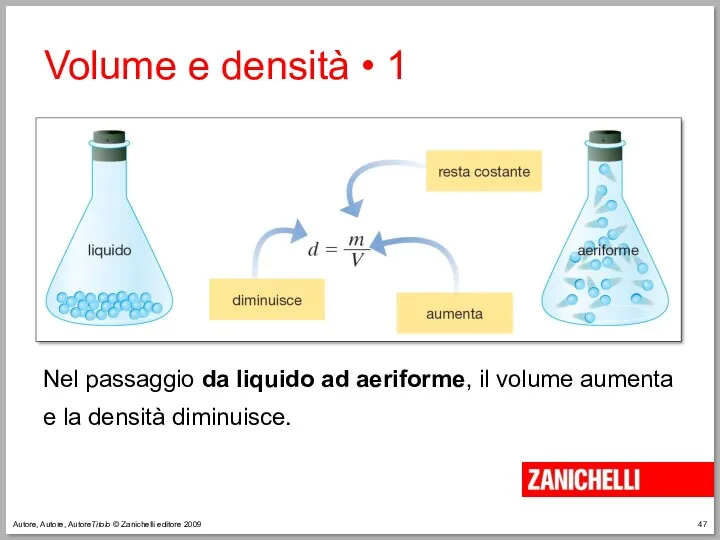
- 47. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Nel passaggio da liquido ad aeriforme, il volume aumenta
- 48. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Volume e densità • 2 Nel passaggio da liquido
- 49. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Volume e densità • 3 Nel passaggio da liquido
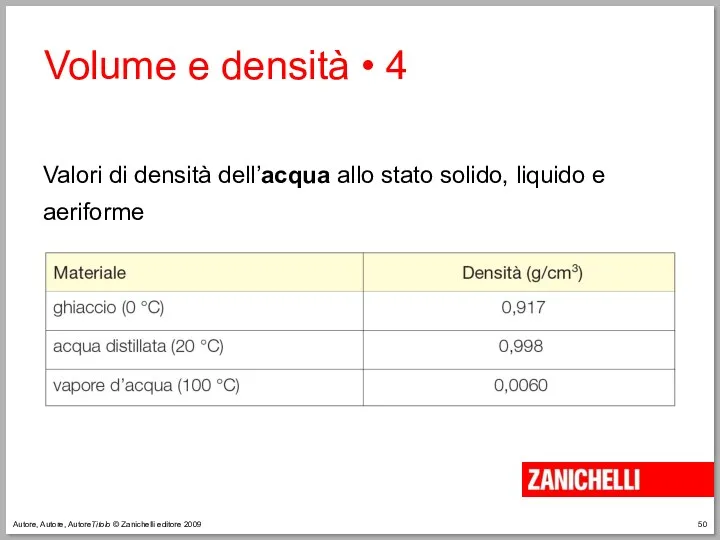
- 50. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Volume e densità • 4 Valori di densità dell’acqua
- 51. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Volume e densità • 5
- 52. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di riscaldamento • 1 Poniamo nel freezer a
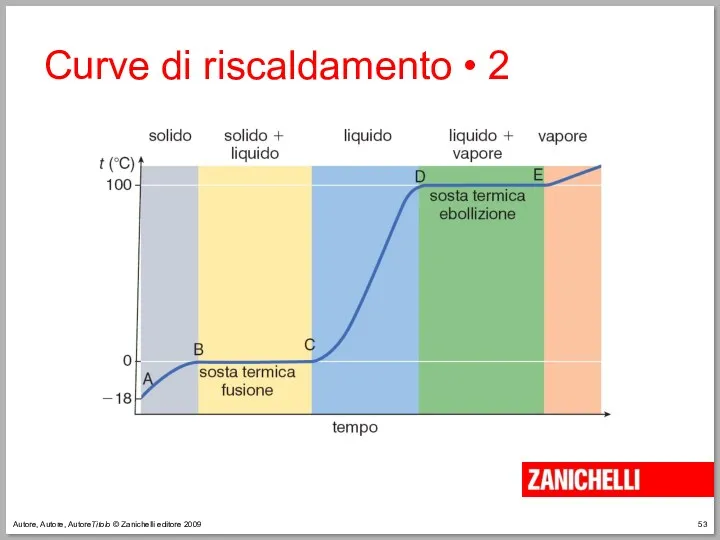
- 53. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di riscaldamento • 2
- 54. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di riscaldamento • 3 La temperatura alla quale
- 55. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di riscaldamento • 4 Durante la fusione la
- 56. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di riscaldamento • 5 Se riscaldiamo il recipiente
- 57. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Il passaggio liquido-aeriforme è detto: Evaporazione se la pressione
- 58. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura a cui la pressione del vapore eguaglia
- 59. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura di fusione e quella di ebollizione sono
- 60. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Supponiamo di raffreddare un recipiente pieno di vapore acqueo
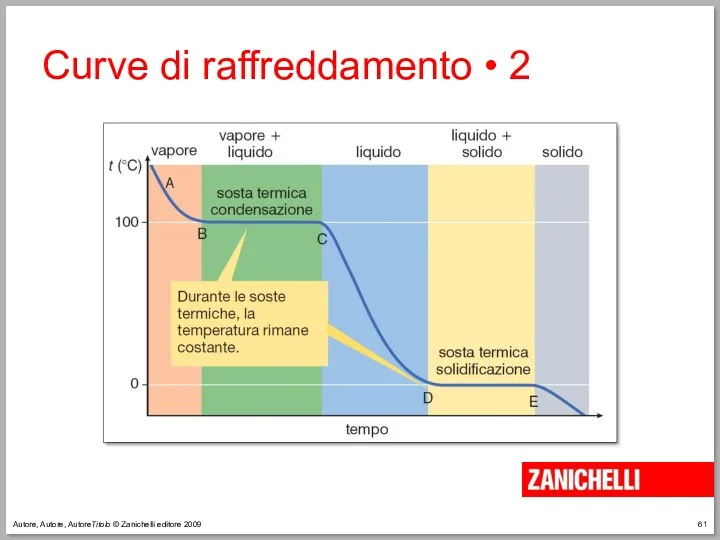
- 61. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Curve di raffreddamento • 2
- 62. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura di condensazione è uguale alla temperatura di
- 63. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La temperatura di solidificazione è uguale alla temperatura di
- 64. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Riscaldamento di un miscuglio • 1 La curva di
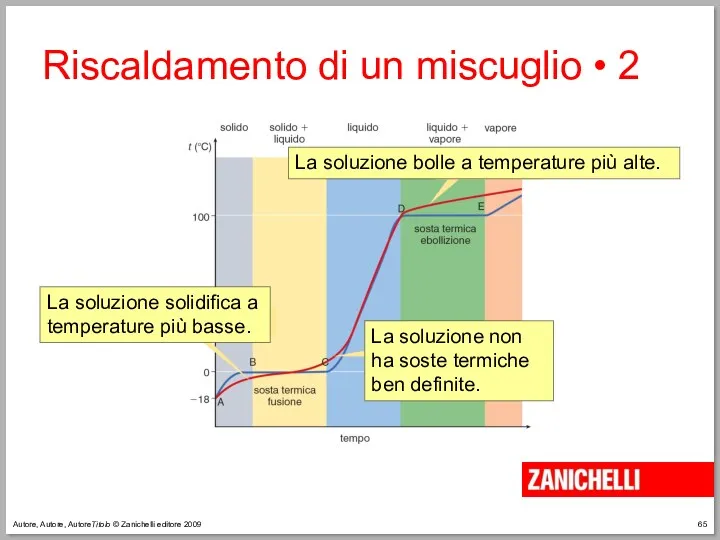
- 65. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Riscaldamento di un miscuglio • 2
- 66. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Riscaldamento di un miscuglio • 3 Le temperature dei
- 67. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Riscaldamento di un miscuglio • 4 Quanto più è
- 68. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Riscaldamento di un miscuglio • 5 La determinazione del
- 69. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 L’acqua può bollire a una temperatura più bassa o
- 70. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Pressione e passaggi di stato • 2 Nella pentola
- 71. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Pressione e passaggi di stato • 3 Nel passaggio
- 72. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Pressione e passaggi di stato • 4 Nel passaggio
- 73. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Pressione e passaggi di stato • 5 A -
- 74. 3.5 Esistono vari metodi di separazione dei miscugli
- 75. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Filtrazione Con l’uso di opportuni filtri, è possibile separare
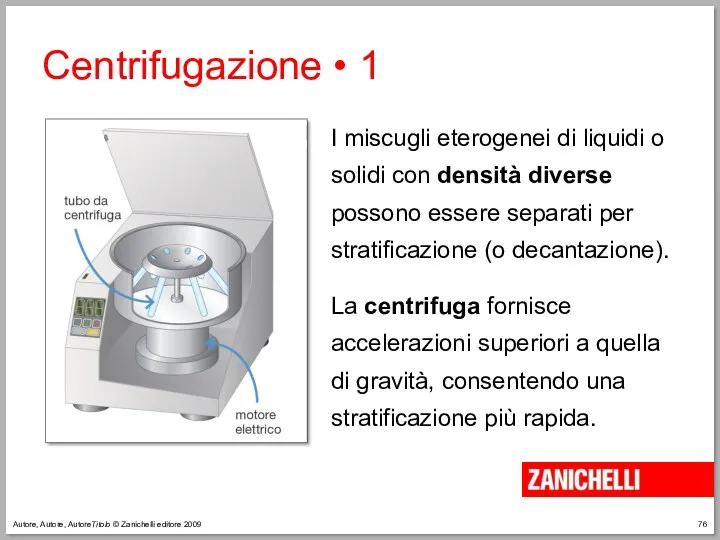
- 76. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Centrifugazione • 1 I miscugli eterogenei di liquidi o
- 77. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Centrifugazione • 2 L’olio d’oliva, dopo la spremitura, viene
- 78. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Estrazione • 1 L’estrazione sfrutta la diversa affinità dei
- 79. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Estrazione • 2 I pigmenti verdi delle foglie e
- 80. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Cromatografia • 1 La cromatografia moltiplica l’efficacia dell’estrazione. Il
- 81. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Cromatografia • 2 In figura: separazione di inchiostri di
- 82. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Cromatografia • 3 La gascromatografia utilizza un gas come
- 83. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La distillazione sfrutta la diversa volatilità dei componenti delle
- 84. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Distillazione • 2 La miscela bolle in un recipiente
- 85. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Distillazione • 3
- 86. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Distillazione • 4 I vapori di una miscela che
- 87. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Distillazione • 5 La separazione è tanto più completa
- 88. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 Tecniche di separazione dei miscugli e proprietà fisiche interessate
- 89. Autore, Autore, AutoreTitolo © Zanichelli editore 2009 La benzina è uno dei prodotti principali della distillazione
- 91. Скачать презентацию











































































 Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Лекция 6. Желтые пигменты
Лекция 6. Желтые пигменты Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Зерттеу әдістері
Зерттеу әдістері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Фазовое равновесие
Фазовое равновесие Сероводород
Сероводород Франций (Francium)
Франций (Francium) Роль хімії у суспільстві
Роль хімії у суспільстві Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Разнообразие неметаллов
Разнообразие неметаллов Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Металл цирконий (ZR)
Металл цирконий (ZR) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химия в повседневной жизни человека
Химия в повседневной жизни человека Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Физические и химические свойства алкенов
Физические и химические свойства алкенов Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова Химия нефти и газа
Химия нефти и газа Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Кислоты, их классификация и свойства
Кислоты, их классификация и свойства