Содержание
- 2. Содержание Химическая формула и строение молекулы Хлороводород Получение Физические свойства Химические свойства Применения Соляная кислота Получение
- 3. Химическая формула и строение молекулы Из всех галогеноводородов особенно большое значение имеют хлороводород и его раствор
- 4. Хлороводород
- 5. Получение В промышленности хлороводород получают сжиганием водорода в хлоре. Cl2 + H2 = 2HCl↑ В лаборатории
- 6. Физические свойства Бесцветный газ С резким запахом Vm= 22,4 л/моль М (HCl) = 36,5 г/моль Dвозд.(HCl)
- 7. Химические свойства В отличии от соляной кислоты хлороводород при обычных условиях не реагирует ни с металлами,
- 8. Применение Основная масса хлороводорода используется для производства соляной кислоты . Благодаря тому что хлороводород может присоединяться
- 9. Соляная кислота
- 10. Получение В лабораторных условиях используется разработанный ещё алхимиками способ, заключающийся в действии концентрированной серной кислоты на
- 11. Химические свойства
- 12. Применение Промышленность Применяют в гидрометаллургии и гальванопластике (травление, декапирование), для очистки поверхности металлов при паянии и
- 13. Особенности обращения Высококонцентрированная соляная кислота — едкое вещество, при попадании на кожу вызывает сильные химические ожоги.
- 14. Верны ли следующие суждения о хлоре? 1 вариант 1.Высшая степень окисления +7. 2.В промышленности хлор полу-
- 15. Эксперименты!
- 16. Опыты,демонстрирующие получение хлороводорода а)Без изменения степени окисления В колбу Вюрца поместить 15-20 г хлорида натрия; в
- 17. б)С изменением степени окисления Тройник с пробкой закрепить в лапке штатива. Газоотводную трубку от прибора для
- 18. Опыты,демонстрирующие физические свойства а) “Дымление” хлороводорода В одну пробирку налить 1-2 мл концентрированной серной кислоты, во
- 20. Скачать презентацию

















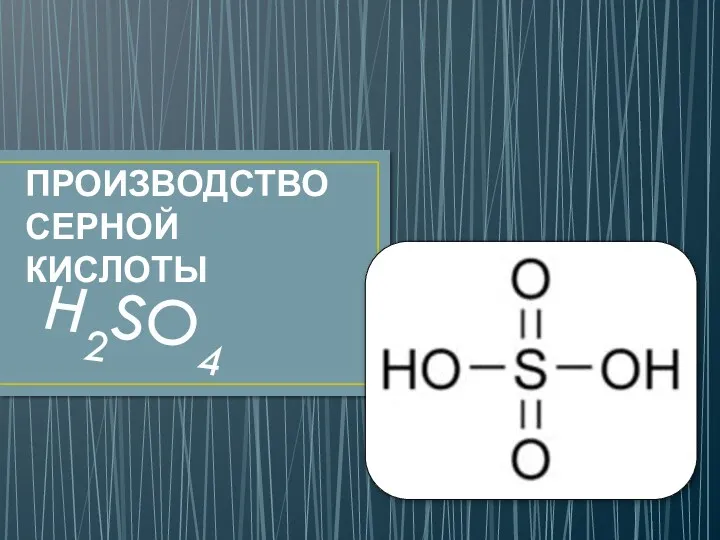 Производство серной кислоты
Производство серной кислоты Комплексные соединения
Комплексные соединения Кислые породы умеренно-щелочного ряда
Кислые породы умеренно-щелочного ряда Химия углеводов
Химия углеводов Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов
Индикаторы окислительно-восстановительного титрования и их применение в анализе лекарственных препаратов Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14 Искусственная радиоактивность. Ядерное оружие и его поражающие факторы
Искусственная радиоактивность. Ядерное оружие и его поражающие факторы Растворы: состав и их коллигативные свойства
Растворы: состав и их коллигативные свойства Неорганические соединения. Основания
Неорганические соединения. Основания Теория электролитической диссоциации
Теория электролитической диссоциации Органічні сполуки і здоров'я людини
Органічні сполуки і здоров'я людини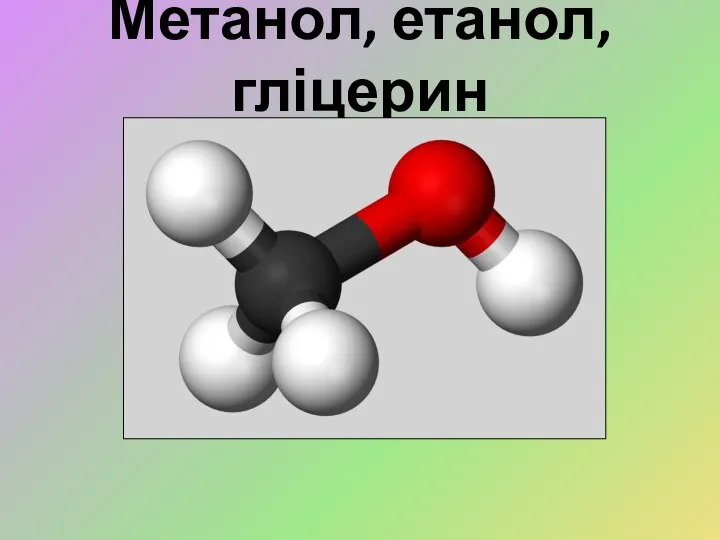 Метанол, етанол, гліцерин
Метанол, етанол, гліцерин Физические и химические свойства воды
Физические и химические свойства воды Строение атома
Строение атома Основания. Названия оснований
Основания. Названия оснований Химический элемент водород
Химический элемент водород Химическая термодинамика и биоэнергетика. Второй закон термодинамики
Химическая термодинамика и биоэнергетика. Второй закон термодинамики Характеристика металу Алюміній
Характеристика металу Алюміній Металлы – простые вещества
Металлы – простые вещества Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка
Соли - это сложные вещества, которые состоят из ионов металла и кислотного остатка ПОЛИСАХАРИДЫ
ПОЛИСАХАРИДЫ Химические уравнения
Химические уравнения История развития промышленности переработки полимеров
История развития промышленности переработки полимеров Аммиак. 9 класс
Аммиак. 9 класс Химическое загрязнение атмосферы
Химическое загрязнение атмосферы Горение топлива
Горение топлива Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел
Кристаллическая структура твердых тел. Межатомные взаимодействия и классификация твердых тел Изотопы, их свойства и применение
Изотопы, их свойства и применение