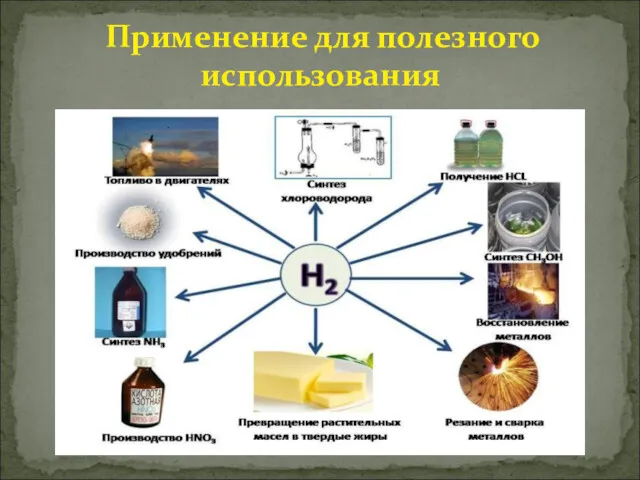
В настоящее время водород получают в огромных количествах.
Очень большую часть
его используют при синтезе аммиака, гидрогенизации жиров и при гидрировании угля, масел и углеводородов. Кроме того, водород применяют для синтеза соляной кислоты, метилового спирта, синильной кислоты, при сварке и ковке металлов, а также при изготовлении ламп накаливания и драгоценных камней. В продажу водород поступает в баллонах под давлением свыше 150 атм. Они окрашены в тёмно-зелёный цвет и снабжаются красной надписью "Водород".Водород используется для превращения жидких жиров в твердые, производства жидкого топлива гидрогенизацией углей и мазута. В металлургии водород используют как восстановитель оксидов или хлоридов для получения металлов и неметаллов.
Практическое применение водорода многообразно: им обычно заполняют шары-зонды, в химической промышленности он служит сырьём для получения многих весьма важных продуктов (аммиака и др.), в пищевой - для выработки из растительных масел твёрдых жиров и т. д. Высокая температура (до 2600 °С), получающаяся при горении водорода в кислороде, используется для плавления тугоплавких металлов. Водород применяют как для полезных дел, так и для вредного применения.
Применение










 Гетероциклические соединения. Пятичленные гетероциклы
Гетероциклические соединения. Пятичленные гетероциклы Зависимость свойств веществ от типа химической связи и кристаллической решетки
Зависимость свойств веществ от типа химической связи и кристаллической решетки Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі
Оттекті органикалық қосылыстар тақырыбын пәнаралық байланыс арқылы оқыту әдістемесі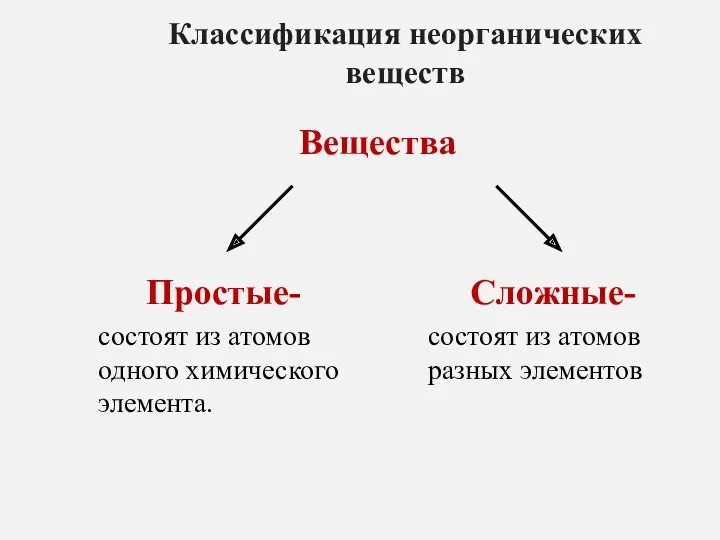 Классификация неорганических веществ
Классификация неорганических веществ Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Дисперсные системы. Свойства коллоидных растворов
Дисперсные системы. Свойства коллоидных растворов Общая характеристика неметаллов
Общая характеристика неметаллов Полімери, Їх властивості та застосування
Полімери, Їх властивості та застосування Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички
Что такое хорошо и что такое плохо, Или правила игры от очень строгой химички Непредельные углеводороды
Непредельные углеводороды Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ) Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Спекание. Основные типы спекания
Спекание. Основные типы спекания Век пластмасс
Век пластмасс Неметаллы. Обобщающий урок. 9 класс
Неметаллы. Обобщающий урок. 9 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Дендример, или арборол
Дендример, или арборол Химия в быту
Химия в быту Хімія і здоров'я людини
Хімія і здоров'я людини Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс)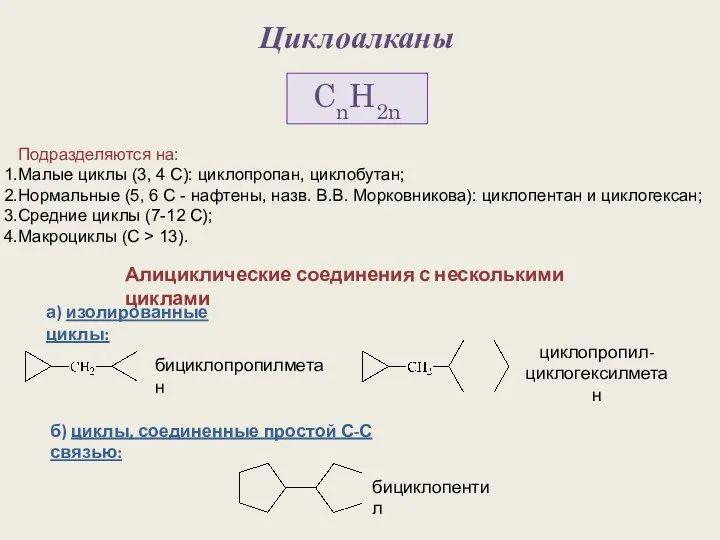 Циклоалканы. Строение алициклов
Циклоалканы. Строение алициклов Химический элемент железо
Химический элемент железо Алканы: общая формула, состав, гомологический ряд
Алканы: общая формула, состав, гомологический ряд Классы неорганических веществ (лекция № 4)
Классы неорганических веществ (лекция № 4) Выращивание кристалла медного купороса
Выращивание кристалла медного купороса Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Vitaminele
Vitaminele