Содержание
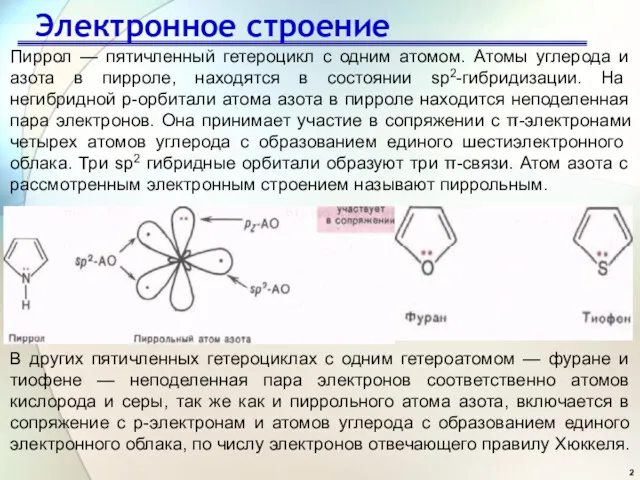
- 2. Электронное строение Пиррол — пятичленный гетероцикл с одним атомом. Атомы углерода и азота в пирроле, находятся
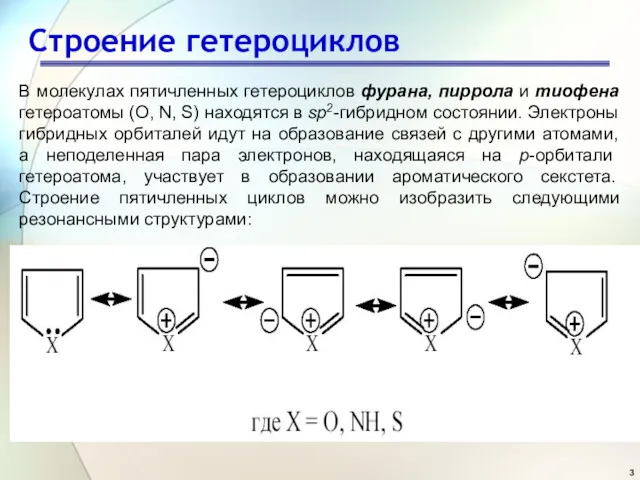
- 3. Строение гетероциклов В молекулах пятичленных гетероциклов фурана, пиррола и тиофена гетероатомы (O, N, S) находятся в
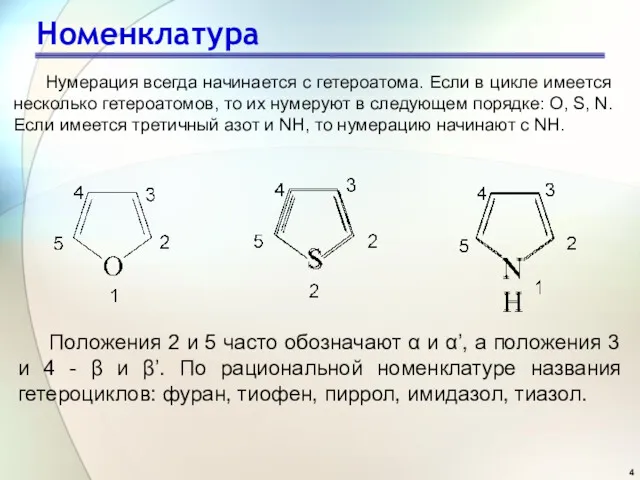
- 4. Номенклатура Нумерация всегда начинается с гетероатома. Если в цикле имеется несколько гетероатомов, то их нумеруют в
- 5. Физические свойства Фуран – бесцветная жидкость, кипящая при 31–32 °С, с запахом, напоминающим хлороформ. Свежеперегнанный пиррол
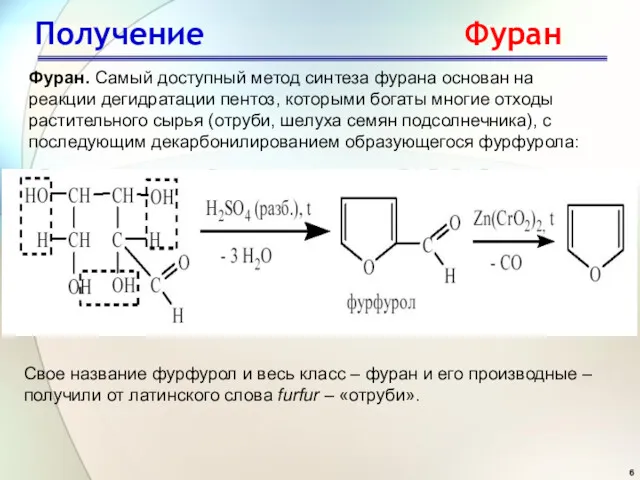
- 6. Фуран. Самый доступный метод синтеза фурана основан на реакции дегидратации пентоз, которыми богаты многие отходы растительного
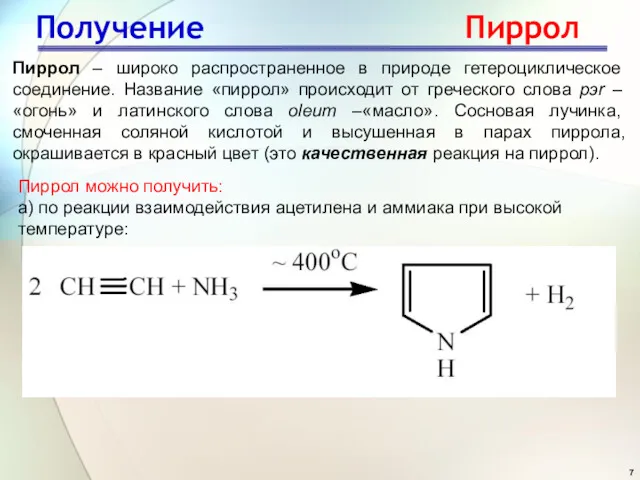
- 7. Получение Пиррол Пиррол – широко распространенное в природе гетероциклическое соединение. Название «пиррол» происходит от греческого слова
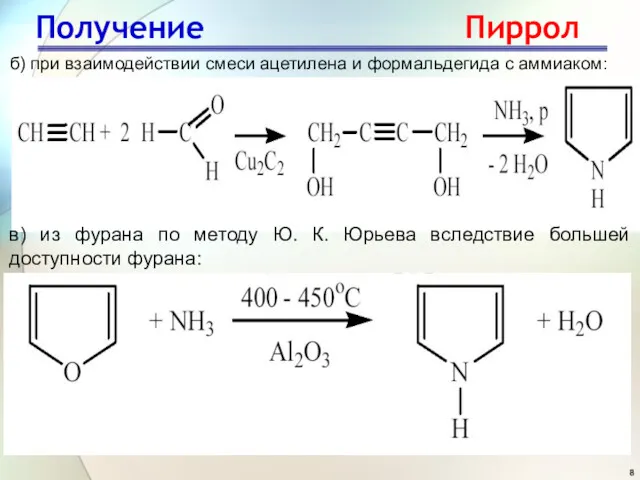
- 8. Получение Пиррол б) при взаимодействии смеси ацетилена и формальдегида с аммиаком: в) из фурана по методу
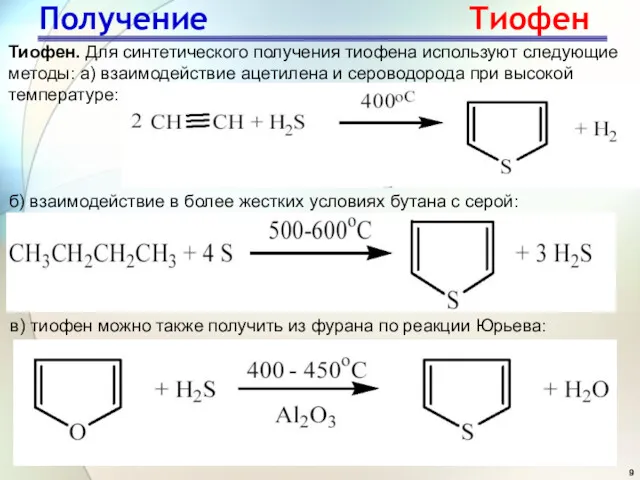
- 9. Тиофен. Для синтетического получения тиофена используют следующие методы: а) взаимодействие ацетилена и сероводорода при высокой температуре:
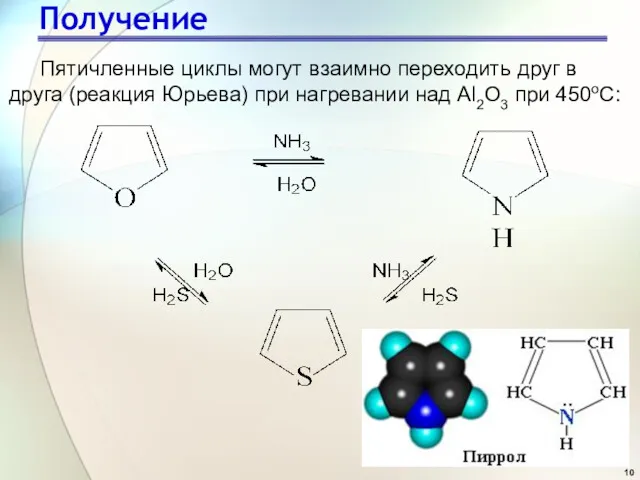
- 10. Получение Пятичленные циклы могут взаимно переходить друг в друга (реакция Юрьева) при нагревании над Al2O3 при
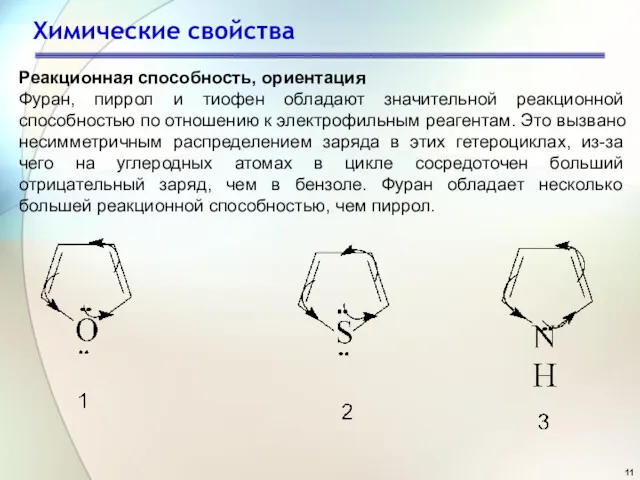
- 11. Химические свойства Реакционная способность, ориентация Фуран, пиррол и тиофен обладают значительной реакционной способностью по отношению к
- 12. Химические свойства Фуран бурно реагирует с сильными кислотами с образованием смолистых веществ, пиррол в результате протонирования
- 13. Химические свойства В катионе (2) двойная связь не может участвовать в мезомерной делокализации положительного заряда. Скорость
- 14. Химические свойства Химические свойства подразделяются на: I. Свойства, в которых проявляется ароматический характер кольца. II. Реакции,
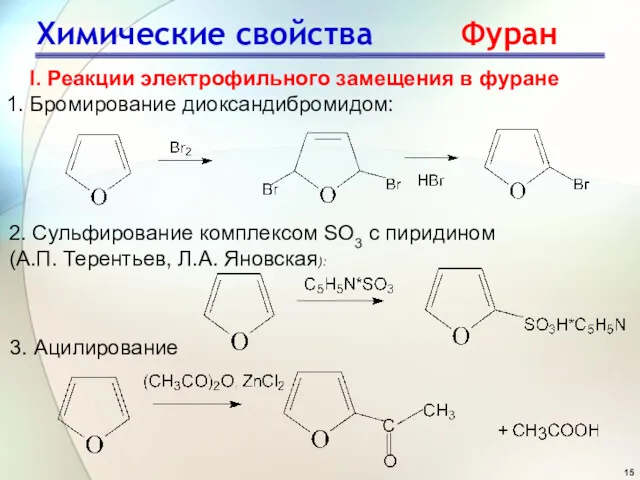
- 15. Химические свойства Фуран I. Реакции электрофильного замещения в фуране 1. Бромирование диоксандибромидом: 2. Сульфирование комплексом SO3
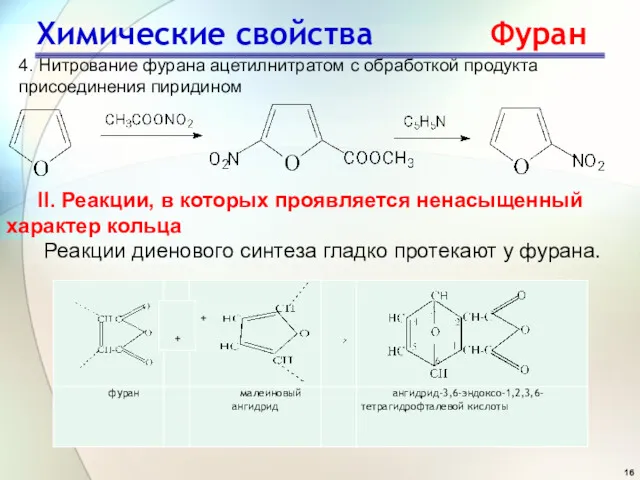
- 16. Химические свойства Фуран 4. Нитрование фурана ацетилнитратом с обработкой продукта присоединения пиридином II. Реакции, в которых
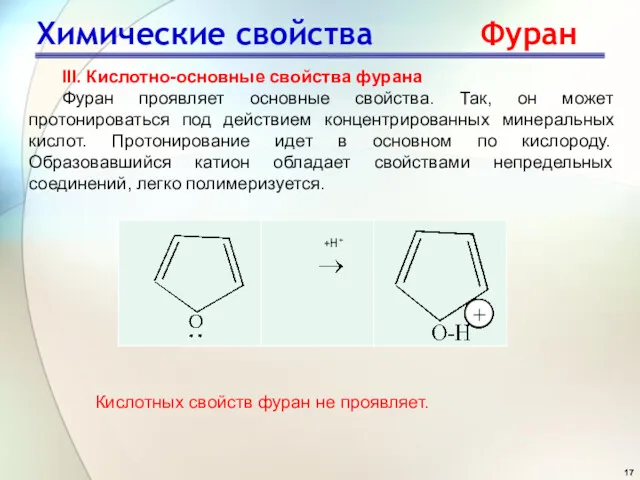
- 17. III. Кислотно-основные свойства фурана Фуран проявляет основные свойства. Так, он может протонироваться под действием концентрированных минеральных
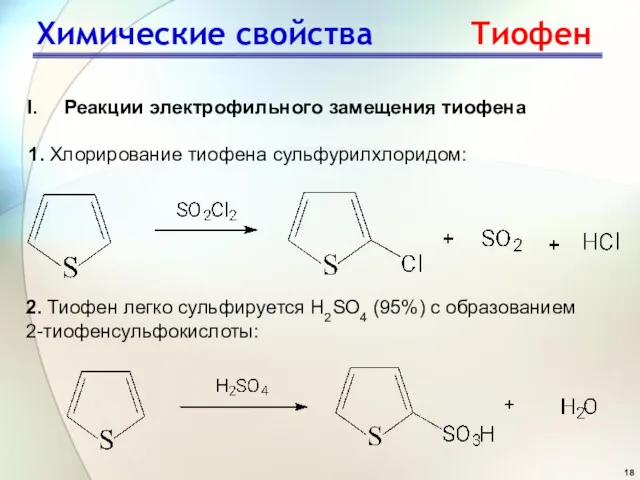
- 18. Реакции электрофильного замещения тиофена 1. Хлорирование тиофена сульфурилхлоридом: 2. Тиофен легко сульфируется H2SO4 (95%) с образованием
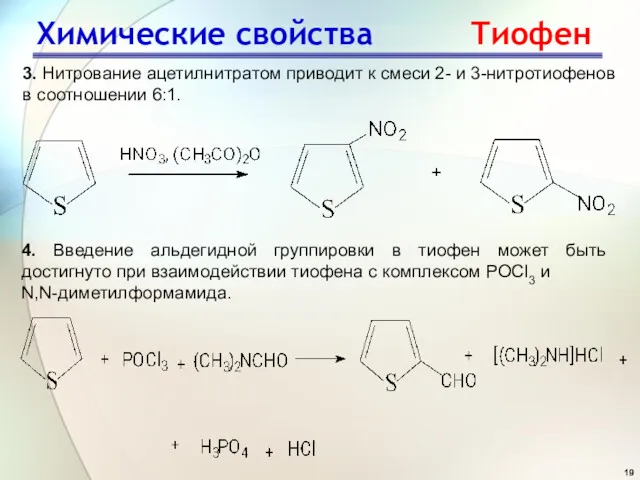
- 19. Химические свойства Тиофен 3. Нитрование ацетилнитратом приводит к смеси 2- и 3-нитротиофенов в соотношении 6:1. 4.
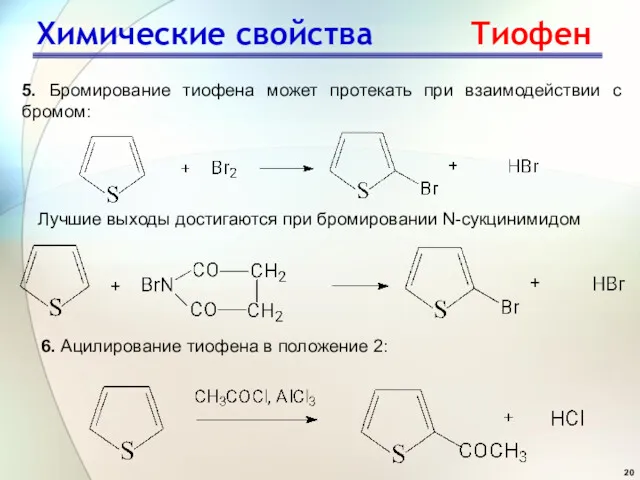
- 20. Химические свойства Тиофен 5. Бромирование тиофена может протекать при взаимодействии с бромом: Лучшие выходы достигаются при
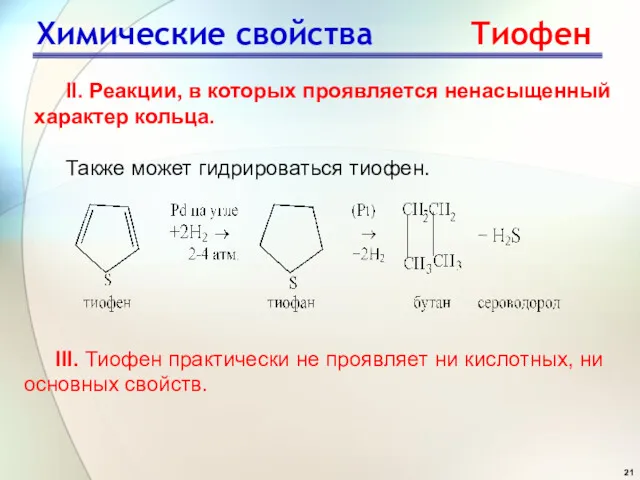
- 21. Химические свойства Тиофен II. Реакции, в которых проявляется ненасыщенный характер кольца. Также может гидрироваться тиофен. III.
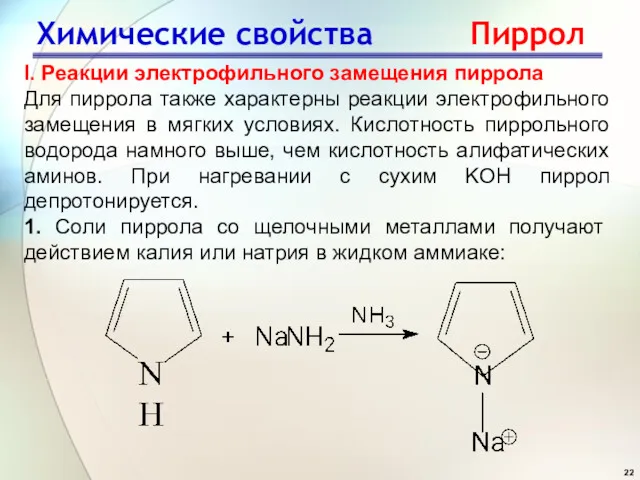
- 22. Химические свойства Пиррол I. Реакции электрофильного замещения пиррола Для пиррола также характерны реакции электрофильного замещения в
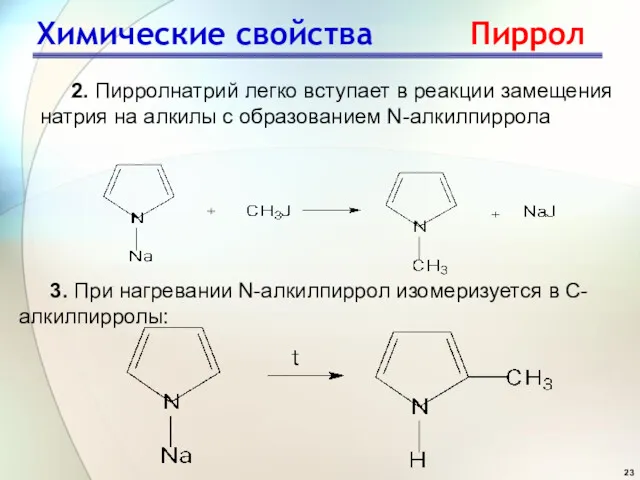
- 23. Химические свойства Пиррол 2. Пирролнатрий легко вступает в реакции замещения натрия на алкилы с образованием N-алкилпиррола
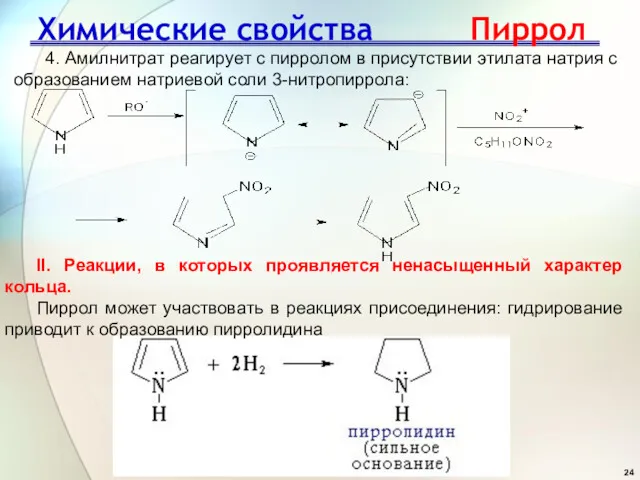
- 24. Химические свойства Пиррол 4. Амилнитрат реагирует с пирролом в присутствии этилата натрия с образованием натриевой соли
- 25. III. 1) Кислотно-основные свойства пиррола а) пиррол, как и все азотистые основания, должен проявлять свойства оснований
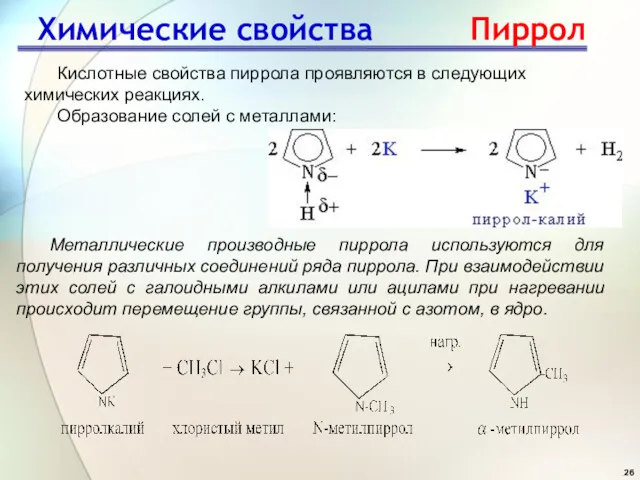
- 26. Кислотные свойства пиррола проявляются в следующих химических реакциях. Образование солей с металлами: Металлические производные пиррола используются
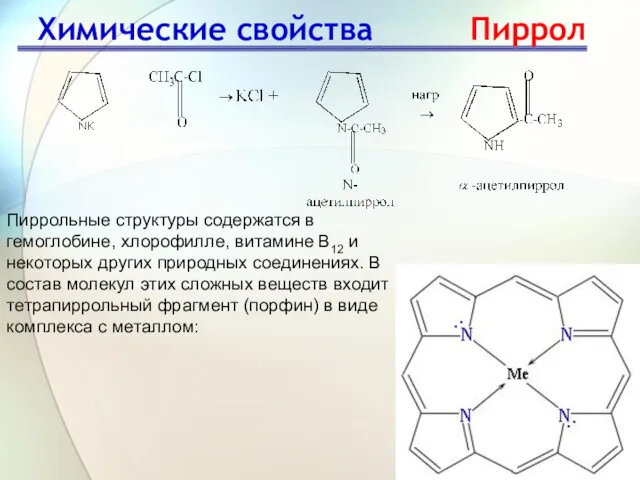
- 27. Пиррольные структуры содержатся в гемоглобине, хлорофилле, витамине В12 и некоторых других природных соединениях. В состав молекул
- 28. Применение Применение и значение пятичленных гетероциклических соединений Пиррол – входит в состав гемоглобина, хлорофилла. Пирролидин –
- 29. Многочисленные гетероциклические соединения играют важную роль в биологии, медицине, сельском хозяйстве и других областях. Они входят
- 31. Скачать презентацию







 Углерод и его свойства
Углерод и его свойства Получение и химические свойства оснований
Получение и химические свойства оснований Энергетика химических процессов
Энергетика химических процессов Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений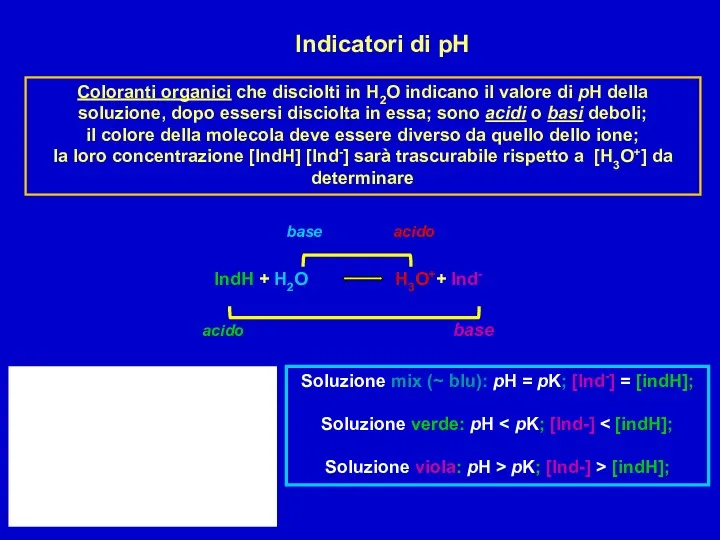 Indicatori di pH
Indicatori di pH Сложноэфирная конденсация Кляйзена-Шмидта
Сложноэфирная конденсация Кляйзена-Шмидта Кислоты. Общая характеристика, химические свойства
Кислоты. Общая характеристика, химические свойства 20231004_agregatnye_sostoyaniya_-_kopiya
20231004_agregatnye_sostoyaniya_-_kopiya Углерод. Carbon
Углерод. Carbon Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения
Фотолабораторный процесс. Основные этапы фото обработки. Рентгеновского изображения Коррозия и защита строительных материалов
Коррозия и защита строительных материалов Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Минералы и горные породы
Минералы и горные породы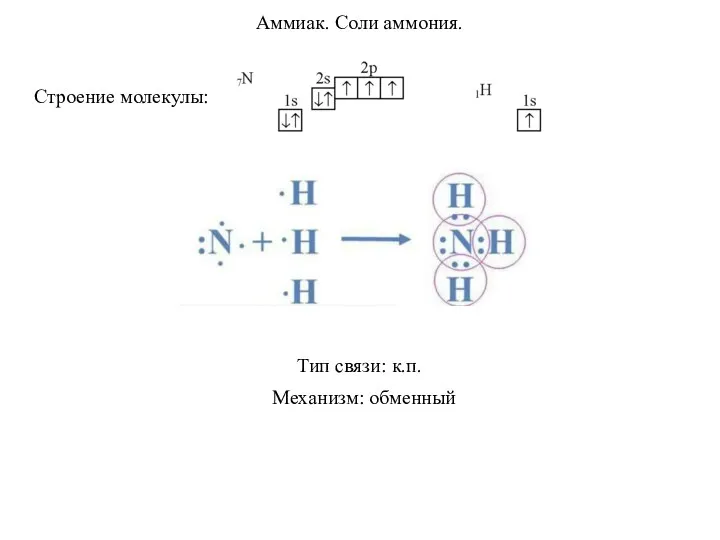 Аммиак. Соли аммония
Аммиак. Соли аммония Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Соединения химических элементов
Соединения химических элементов Химический КВИЗ
Химический КВИЗ 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Простые вещества. Игра Счастливый случай
Простые вещества. Игра Счастливый случай Ертінділер. Ерітінді концентрациясын білдіру тәсілдері
Ертінділер. Ерітінді концентрациясын білдіру тәсілдері Конструкционные функциональные волокнистые композиты. Стеклопластики
Конструкционные функциональные волокнистые композиты. Стеклопластики Фазовые равновесия в растворах
Фазовые равновесия в растворах Занимательные опыты
Занимательные опыты Химические свойства кислот
Химические свойства кислот Алюминий и его соединения. Строение атома
Алюминий и его соединения. Строение атома Этил спирті және оның адам ағзасына әсері
Этил спирті және оның адам ағзасына әсері Химический дискуссионный клуб. Викторина
Химический дискуссионный клуб. Викторина