Содержание
- 2. Химические реакции Обратимые химические реакции – это реакции, одновременно протекающие в прямом и обратном направлениях в
- 3. Признаки необратимости CuCl2 + 2KOH=Cu(OH)2↓ +2KOH – выпал осадок Na2CO3 + 2HCl=2NaCl + H2O + CO2↑
- 4. Химическое равновесие H2 + I2 ↔ 2HI С течением времени скорость прямой реакции уменьшается, т.к. исходные
- 5. Факторы, вызывающие смещение химического равновесия. Состояние химического равновесия может сохраняться долго при неизменных внешних условиях: температуры,
- 6. Принцип Ле Шателье Если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие (изменить давление,
- 7. Изменение концентрации Если увеличиваем концентрацию конечных продуктов, равновесие смещается в сторону обратной реакции. 3H2 + N2
- 8. Изменение концентрации При уменьшении концентрации конечных продуктов реакция равновесия смещается в сторону прямой реакции 3H2 +
- 9. Изменение температуры При повышении температуры химическое равновесие смещается в сторону эндотермической реакции (-Q). 2NH3(г) → N2(г)
- 10. Изменение давления (только для реакций, в которых есть молекулы газа) А) при увеличения давления равновесие смещается
- 11. 1. При повышении температуры равновесие системы смещается… 2SO3 2SO2 + O2 - Q 2. Каким образом
- 12. Как надо изменить концентрации веществ, давление и температуру гомогенной системы PCl5 (тв) ↔ PCl3 (тв) +
- 14. Скачать презентацию











 Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов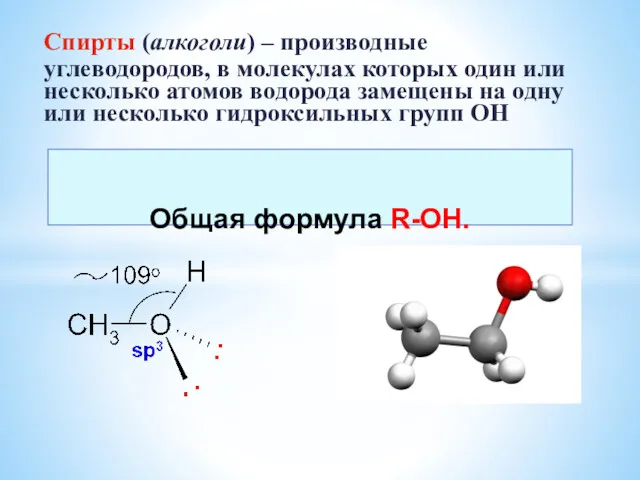 Спирты. Многоатомные спирты
Спирты. Многоатомные спирты Соли. Определение солей
Соли. Определение солей The role of chemistry in the solution of the food problem
The role of chemistry in the solution of the food problem Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Стекловолокно. Что такое стекловолокно?
Стекловолокно. Что такое стекловолокно? Три правила взаимодействия элементов симметрии
Три правила взаимодействия элементов симметрии Простые и сложные полиэфиры. Пентапласт
Простые и сложные полиэфиры. Пентапласт Вольфрам — химический элемент
Вольфрам — химический элемент Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Совйства спиртов. 10 класс
Совйства спиртов. 10 класс Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Растворы. Процесс растворения
Растворы. Процесс растворения Сульфиды. Лекция 6
Сульфиды. Лекция 6 Термопластичные полимеры
Термопластичные полимеры Состав, свойства и роль молока в жизни человека
Состав, свойства и роль молока в жизни человека Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Непредельные углеводороды. Алкены. Номенклатура алкенов
Непредельные углеводороды. Алкены. Номенклатура алкенов Сложные эфиры. Жиры. Мыла
Сложные эфиры. Жиры. Мыла Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття
Явища природи. Фізичні явища, їх різноманітність. Хімічні явища, їх ознаки. Горіння. Гниття Азотные удобрения
Азотные удобрения Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Количество вещества. Единица измерения вещества моль
Количество вещества. Единица измерения вещества моль